肾移植受者围手术期感染危险因素及预防用抗菌药物合理性的分析
刘彦妤,岳慧杰,陈 晨,程东瑞,李 雪,王金泉,周国华
0 引 言
肾移植是目前终末期肾病的最佳治疗手段[1]。自2010年启动公民逝世后器官捐献试点工作以来,公民逝世后器官捐献以及亲属活体捐献成为我国器官移植供体的两大来源[2]。公民逝世后器官捐献包括脑死亡器官捐献、心脏死亡器官捐献(donation after cardiac death,DCD)和脑-心双死亡标准器官捐献[3]。感染是肾移植术后最主要的并发症,是移植术后最常见的非心血管疾病死亡原因。因感染导致的死亡人数约占总死亡人数15%~20%[4-5]。目前国外指南普遍推荐肾移植围手术期预防性单用一代或者二代头孢菌素[6-8];而我国仅有活体供肾移植围手术期抗菌药物预防指南。本研究旨在通过对肾移植术受者的病史资料进行回顾性分析,明确肾移植受者围手术期感染的流行病学特征,探索感染的危险因素,探讨肾移植围手术期预防性使用抗菌药物方案的合理性,以期为临床抗菌药物的合理使用提供参考。
1 资料与方法
1.1 研究对象回顾性分析2015年1月至2019年3月于我院接受肾移植手术的受者共303例,其中进行DCD肾移植180例、活体肾移植123例。
1.2研究方法
1.2.1 调查内容统计患者一般资料、术前情况、手术情况、术后情况、感染资料。其中一般资料包括患者性别、年龄、供肾来源、住院时长、是否二次移植;术前情况包括术前有无糖尿病、术前血红蛋白、术前血清白蛋白、术前透析情况;手术情况包括围手术期诱导方案、手术时长、术中是否输血;术后情况包括术后预防性抗菌药物的使用情况、术后免疫抑制方案、术后是否发生急性排斥反应(acute graft rejection,AR)、术后是否发生移植物功能延迟恢复(delayed graft function,DGF)、术后有无肾周积血;感染资料包括感染发生时间、感染时临床表现、辅助检查、细菌及真菌培养结果等。
1.2.2围手术期感染的诊断标准围手术期指确定手术相关治疗开始至治疗为止,包括术前、术中、术后3个阶段[9]。根据卫生部2001年颁布实施的《医院感染诊断标准》对肾移植受者围手术期发生的不同类型感染进行诊断和治疗[10]。本研究中严重感染指即使给予广谱联合的抗菌药物治疗,感染仍未得到控制,最终予以移植肾切除处理或需定期更换移植肾输尿管支架管,受者预后不佳。
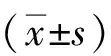
2 结 果
2.1 肾移植受者围手术期感染的基本情况
2.1.1 感染发生率303例肾移植受者中30例发生围手术期感染,发生率为9.90%,其中男19例,女11例。DCD肾移植受者较活体肾移植受者具有更高的围手术期感染发生率,差异有统计学意义(12.78%vs5.69%,χ2=4.114,P=0.043)。
2.1.2感染类型肾移植围手术期最常见的感染类型依次为肺部感染[12/30,40.00%]、肾周感染[8/30,26.67%]、尿路感染[4/30,13.33%]。DCD肾移植组和活体肾移植组不同类型感染分布见表1。DCD肾移植受者和活体肾移植受者围手术期不同类型感染发生率差异均无统计学意义(P>0.05)。

表 1 肾移植受者不同类型感染分布 [n(%)]
2.2肾移植受者围手术期感染病原菌分布及耐药情况
2.2.1 感染受者检出的菌株分布情况30例感染受者共检出病原菌39株。其中G-菌26株(66.67%)、G+菌9株(23.08%)、真菌4株(10.25%)。见表2。

表 2 肾移植受者感染菌株情况
2.2.2感染受者检出的G-菌、G+菌、真菌分布情况产吲哚金黄杆菌和肺炎克雷伯菌为最常见的G-菌,检出率均为15.38%;其次为鲍曼不动杆菌复合群,检出率为11.54%。G+菌中肠球菌检出率最高,占44.44%;其次为表皮葡萄球菌,占22.22%。检出的真菌包括白色假丝酵母菌、阿萨希毛孢子菌、光滑球拟酵母菌和青霉菌。G-菌检出情况见图1。
2.2.3主要检出菌的耐药情况检出的主要G-菌为产吲哚金黄杆菌和肺炎克雷伯菌。产吲哚金黄杆菌对多数抗菌药物均产生耐药性,对复方磺胺甲噁唑的耐药率为25.00%。4株肺炎克雷伯菌,其中2株均对阿米卡星、替加环素及妥布霉素敏感,另2株仅对多粘菌素B敏感。主要的G-菌耐药情况见表3。检出的主要G+菌为肠球菌。肠球菌对万古霉素、替加环素和利奈唑胺均敏感,对链霉素、四环素的耐药率为25.00%,对氨苄西林、青霉素、庆大霉素、环丙沙星、左氧氟沙星、达福普汀的耐药率为50.0%。此外,共检出4株真菌,所有菌株对抗真菌药物氟胞嘧啶、氟康唑、伏立康唑、两性霉素B、伊曲康唑均未表现出耐药性。

图 1 感染受者G-菌检出情况

表 3 肾移植受者围手术期主要G-菌耐药情况
2.3DCD肾移植受者围手术期感染的基本情况180例DCD肾移植受者中,23例发生围术期感染,且其中3例为严重感染(均为多重耐药的肺炎克雷伯菌所致)。
2.3.1感染来源分析23例DCD肾移植感染的病例中,仅有1例供体、受体培养菌株一致,即为供者来源的感染。此例为耐万古霉素的肠球菌肺炎克雷伯菌所致的严重感染,最终导致移植肾切除。
2.3.2不同级别抗菌药物的预防效果使用不同级别的抗菌药物预防,围术期感染率差异无统计学意义(10.47%vs14.89%,χ2=0.790,P=0.374)
2.4肾移植受者围手术期感染相关因素分析单因素分析结果显示,感染组与非感染组供肾来源、住院时长、透析时长、术中是否输血、术后使用的免疫抑制方案以及术后有无肾周积血差异有统计学意义(P<0.05)。多因素分析结果显示,术中输血、术后运用霉酚酸酯联合环孢素及激素的免疫抑制方案是肾移植围手术期感染的独立危险因素。见表4。

表 4 肾移植围手术期感染多因素分析
3 讨 论
3.1肾移植受者围手术期感染流行病学特征
3.1.1 感染发生率本研究结果显示肾移植围手术期多为细菌感染,且感染发生率显著低于国内外的相关报道,考虑存在以下2个方面的原因:①我院针对DCD肾移植受者常规使用广谱且联合的抗感染预防方案,对于感染高危的受者根据药敏结果给予药物干预并延长抗菌药物给药时间;②本研究未检测出巨细胞病毒感染[11-12]。DCD肾移植组感染的发生率显著高于活体肾移植组,这一结果与国外相关研究结果一致[12]。主要原因可能是DCD供者普遍来自ICU,较易发生多重耐药菌的感染或定植,再加上用于筛查活动性或潜在感染的时间窗较短,使相应受者发生供者来源感染的风险增加[13]。其次,活体移植的肾脏冷、热缺血时间比DCD供肾短,活体移植肾可以得到更加及时、有效的灌注[14]。
3.1.2感染类型文献报道移植术后1个月的主要感染类型是手术部位感染、肺部感染、菌血症和尿路感染[15];而尿路感染是肾移植术后最常见的感染类型,发生率为10%~98%[16]。本研究结果显示尿路感染的发生率较低,仅为14.29%。这可能与本中心肾移植受者严格控制留置导尿管和拔除双J管的时间有关。本研究中,肾移植围手术期最常见的为肺部感染,导致肺部感染高发的主要原因可能是肾移植受者术后长期卧床,未在早期加强呼吸功能锻炼。
3.1.3感染来源移植后的感染来源包括供者来源、受者来源、院内获得性和社区获得性[17]。文献报道肾移植术后1个月内发生的感染来源于前3种,超过90%为与手术及其他有创操作相关的医院感染[15, 17]。本研究表明96.67%的感染为医院感染,这与文献基本一致。肾移植围手术期并发的医院感染取决于手术的性质、手术技术和术后护理技术[15, 18]。留置各种导管支架以及手术相关并发症如术中污染、术中输血、术后肾周血肿或输尿管漏尿均会增加术后感染发生的风险[15]。故为有效降低围手术期感染发生率,除合理使用预防用抗菌药物外,还必须严格遵守手术操作规范,同时还要加强术后护理。
本研究表明,供者来源感染发生率仅为3.33%,且主要致病菌为多重耐药菌。虽然供者来源的感染不常见,但对于此类感染,即使在早期预防性使用高级别的抗菌药物,也未能改善受者的预后[17, 19]。因此,在术前要详细了解供者的临床病史,使用更快、更灵敏的检测方法提高筛查水平,综合评估器官质量,严格筛选供者。针对受者来源的感染,在移植前应该根除受者的活动性感染,避免术后使用免疫抑制剂加速感染进程[7]。
3.1.4感染病原菌分布及药物敏感性分析文献报道肾移植术后1个月内感染病原菌与院内感染病原菌谱大致相同,细菌感染发生率可达47%[15,18];且主要病原菌为 G-菌[20-22]。本研究表明肾移植围术期感染致病菌也以G-菌为主(66.67%),G+菌较少(23.08%),部分合并真菌感染(10.26%)。检出的G-菌主要为产吲哚金黄杆菌(15.38%)和肺炎克雷伯菌(15.38%)。检出的产吲哚金黄杆菌虽然耐药率较高,但未造成严重感染,通过抗感染治疗疗效佳,因此无需重点干预。检出的肺炎克雷伯菌多为多重耐药菌,广谱联合的抗感染治疗均无效,最终导致移植肾切除或并发严重的肾周脓肿,使得受者预后不佳,因此提示我们要加强对耐多药的肺炎克雷伯菌感染的干预控制。首先,如果供者检出耐多药的肺炎克雷伯菌,由于受者一旦发生供者来源感染,缺乏有效抗菌药物治疗,死亡率高,则不建议捐献。其次,要重视院内感染的防控,具体措施如下:①对耐多药肺炎克雷伯菌的感染受者进行接触预防;②严格手卫生管理;③定期对周围环境进行清洁消毒;④减少侵入性医疗设备的使用;⑤加强抗菌药物的使用管理,制定特殊级抗菌药物使用规范。
检出的G+菌主要为肠球菌(44.44%),包括屎肠球菌和粪肠球菌。检出的主要菌株与其他报道不完全一致,考虑到主要是由于不同医疗机构的院内病原菌谱有差异[20-22]。本研究中检出的病原菌均出现不同程度的耐药。因此需根据药敏结果合理选用抗菌药物,减少耐药菌株的产生。
3.2肾移植受者围手术期感染相关因素分析本研究显示肾移植围手术期感染的独立危险因素包括术中输血以及使用霉酚酸酯联合环孢素和激素的免疫抑制方案。前者因大量输血会导致输血相关的免疫功能降低,同时异体血中的病原菌也会增加感染风险[23];后者与文献报道结果不一致,其原因可能是本研究为单中心、小样本、回顾性研究,且不同因素对感染结局产生的结果所占比重不同[24]。
本研究还发现了一些与术后感染发生密切相关的因素:①在院天数。因在院时间越长,暴露在各种病原菌易感条件下的时间越长,更易发生医院感染;②术前糖尿病。高糖状态会抑制白细胞对细菌的吞噬及杀伤能力,降低机体对感染的抵抗力[25]。③术前受者的血清清蛋白。清蛋白在一定程度上反映了机体的营养状况,术前受者的营养状况不佳使其对各种病原菌的抵抗力均有所下降,增加机体感染的风险。④术前透析总时长。血液透析可大量释放氧自由基,加重移植肾的缺血再灌注损伤。⑤手术时长。组织长时间的牵拉会导致局部血运较差甚至组织坏死,同时长时间的伤口暴露会增加术野污染风险。
3.3肾移植围术期预防性抗菌药物的选择国外指南普遍推荐在肾移植围术期单用一代或二代头孢菌素,用以预防手术部位的感染,包括尿路感染[6-8,26]。而我国仅有针对活体肾移植的抗菌药物预防指南[27]。本中心目前针对活体肾移植受者普遍采用三代头孢预防感染,而针对DCD肾移植受者多采用亚胺培南联合达托霉素的抗菌药物预防方案。回顾性分析显示DCD肾移植受者预防性使用高级别的抗菌药物与低级别的抗菌药物相比无法显著降低肾移植围手术期感染发生率,反而会增加细菌的耐药性,这一结果与文献报道基本一致[28]。鉴于本研究肾移植受者围手术期感染流行病学特征与其他报道一致,预防性使用高级别抗菌药物无法显著降低感染发生率,同时检出菌株耐药率呈逐年上升趋势,这就提示针对DCD肾移植受者,在选择预防用抗菌药物前要充分筛查与感染发生相关的危险因素:对于无感染危险因素的受者,预防用抗菌药物的选择可参考国外指南;对于存在感染危险因素的受者,可适当提高预防用抗菌药物的级别。
本研究结果显示肾移植围手术期感染多为医院感染,以肺部感染为主,致病菌主要为G-菌。而普遍采用广谱及联合的抗菌药物预防不能有效降低围手术期感染发生率,因此要积极控制感染的来源、减少危险因素,同时要结合院内感染病原菌谱对其加以干预。
本研究为单中心、小规模、回顾性研究,一些隐性感染可能会被忽视,感染发生率可能被低估;此外,没有统一的标准来区分感染和定植,可能将一些定植菌纳入为感染病原菌;还需要注意的是,与DCD肾移植受者相比,对活体肾移植受者做的病原菌培养较少,可能对统计结果产生影响;此外,由于供者数据的缺失,无法对与供者相关的感染影响因素进行探讨。未来需要借助多中心、大样本、前瞻性研究全面考察肾移植围手术期感染流行病学特征,更好地确定感染的危险因素及不同危险因素对感染的影响程度比重,建立感染风险评分标准,针对不同危险级别的受者采用个体化的用药方案。如何进行肾移植围手术期感染个体化抗菌药物的预防有待进一步探究,考虑可以通过免疫监测预测感染风险[29],通过代谢组学研究确定与感染相关的潜在的生物标志物[30]。

