应用组织型纤溶酶原激活物-抑制剂复合物评价脓毒症严重程度的临床价值
钟林翠,宋景春,姜 峻,胡艳晶,何龙平,李兆芳
0 引 言
脓毒症指机体对感染反应失调所导致的危及生命的器官功能障碍综合征[1]。根据全国疾病监测系统结果分析,2015年我国脓毒症相关标化死亡率66.7例/10万人口,即当年死于脓毒症的病例数超过100万[2]。脓毒性休克指在脓毒症的基础上合并严重的循环、细胞和代谢紊乱[3]。脓毒症一旦发展为脓毒性休克,患者病死率会显著升高至40.0%[4]。因此,如何早期发现脓毒症向脓毒性休克转化,及时调整完善治疗方案,是降低脓毒症死亡率的关键环节之一。
组织型纤溶酶原激活物-抑制剂复合物(tissue plasminogen activator- inhibitor complex,t-PAIC)是组织型纤溶酶原激活物(tissue-plasminogen activator,t-PA)和纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,PAI-1)结合形成的复合物[5]。已有研究发现,脓毒症时内毒素和低灌注可导致血管内皮细胞损害,内皮细胞损伤后会立即释放t-PA和PAI-1,进而引起t-PAIC水平显著升高[6]。既往尚无关于t-PAIC与脓毒症严重程度有关的报导。本研究旨在评价t-PAIC判断脓毒症严重程度的临床价值。
1 资料与方法
1.1 研究对象前瞻性观察2018年5月至2019年10月我科收治的163例脓毒症患者。纳入标准:年龄≥14岁;符合脓毒症诊断的患者。排除标准:存在已知的先天性凝血功能障碍;慢性肝功能不全患者;血液系统的恶性肿瘤。诊断标准采用2016年脓毒症3.0诊断标准:即对于疑似或者证实感染,SOFA评分≥2分可诊断为脓毒症;脓毒性休克为在脓毒症的基础上,出现持续性低血压,在充分容量复苏后(30 mL/kg)仍需血管活性药来维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa)以及血乳酸>2 mmol/L[1,7]。根据脓毒症患者病情严重程度,将163例患者分为脓毒症组(n=104)和脓毒性休克组(n=59)。本研究获得医院伦理委员会批准(批准号:LC2018028)。所有患者及家属均签署知情同意书。
1.2方法
1.2.1 仪器及试剂日本Sysmex公司HISCL-800自动化学发光免疫分析仪及配套试剂;美国沃芬公司ACL-TOP700全自动血凝分析仪及配套试剂。
1.2.2t-PAIC检测患者入科2 h内采用枸橼酸钠抗凝管(枸橼酸钠与血液的比例为1∶9)从外周血管采血2 mL。将2 mL枸橼酸钠抗凝全血在室温下以3000×g离心10 min。按HISCL-800说明书步骤进行操作,采用化学发光免疫分析法定量检测t-PAIC浓度[8]。
1.2.3常规凝血项目检测通过TOP700全自动凝血分析仪测定凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)、 纤维蛋白原降解产物(FDP)、D-二聚体(D-dimer,DD)、抗凝血酶 III(AT III)。其中PT、APTT、TT、FIB采用凝固法检测;FDP、DD采用免疫比浊法检测;AT III采用发色底物法检测。
2 结 果
2.1 一般资料比较脓毒症组与脓毒性休克组患者性别差异有统计学意义(P<0.05),但2组患者的年龄差异无统计学意义(P>0.05)。脓毒症组与脓毒性休克组患者消化系统与泌尿系统感染发生率差异有统计学意义(P<0.05)。与脓毒症组相比,脓毒性休克组患者PCT水平显著增高(P<0.05),WBC、CRP水平差异均无统计学意义(P>0.05),见表1。与脓毒症组相比,脓毒性休克组的PT、APTT、TT明显延长,FIB、ATIII水平明显降低,DD和FDP明显升高,PLT计数减少且差异均有统计学意义(P<0.05)。针对疾病严重程度,与脓毒症组比较,脓毒性休克组APACHE II评分、SOFA评分、DIC评分、DIC发生率及乳酸水平显著增高,差异均具有统计学意义(P<0.05)

表 1 脓毒症组与脓毒性休克组患者的基础资料比较
2.2脓毒症组与脓毒性休克组t-PAIC水平比较脓毒性休克组t-PAIC水平为35.20(18.60~48.10)ng/mL,明显高于脓毒症组[10.75(7.10~16.30)ng/mL],差异有统计学意义(P<0.001),见图1。

图 1 脓毒症组与脓毒性休克组患者间t-PAIC水平比较
2.3相关性分析t-PAIC与乳酸和SOFA的相关系数分别为0.56(P<0.001)和0.50(P<0.001),见图2。
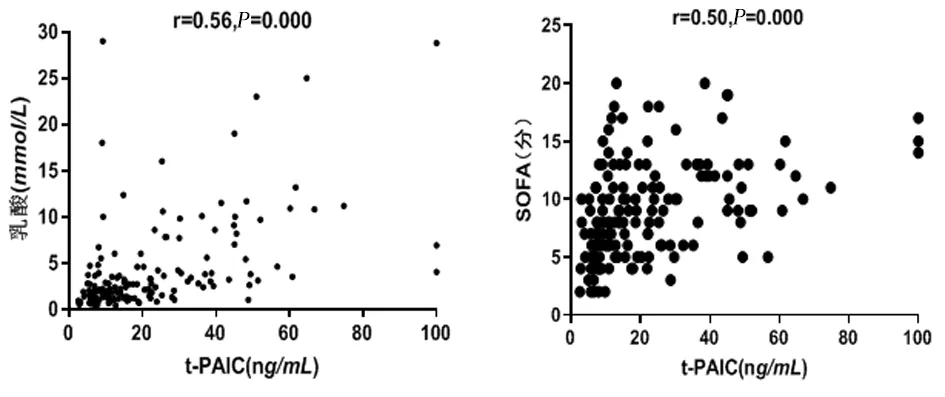
图 2 t-PAIC与乳酸、SOFA的相关性分析
2.4单因素logistic回归和ROC曲线分析采用单因素logistic回归结果显示,t-PAIC是脓毒性休克发生独立危险因素(OR=1.11,95%CI 1.071~1.144,P<0.001)。将t-PAIC纳入ROC曲线分析,结果显示应用t-PAIC诊断脓毒性休克的曲线下面积为0.858(P<0.05);当t-PAIC界值为18.2 ng/mL时,其敏感度、特异度、阳性预测值和阴性预测值分别为0.780、0.788、0.676、0.863。见图3。
2.5不同t-PAIC阈值患者脓毒症的严重程度比较t-PAIC≥18.2 ng/mL者较t-PAIC <18.2 ng/mL者APACHE II评分、SOFA评分、乳酸水平、病死率、DIC发生率及脓毒性休克发生率明显升高,且差异均具有统计学意义(P<0.05)。t-PAIC<18.2 ng/mL者的生存率较t-PAIC≥18.2 ng/mL者升高约2.2倍。见表2,图4。

图 3 应用t-PAIC诊断脓毒性休克的ROC曲线

表 2 t-PAIC不同水平脓毒症患者的严重程度比较

图 4 t-PAIC不同水平的脓毒症患者生存分析
3 讨 论
本研究针对163例脓毒症患者进行前瞻性观察研究,拟评价应用t-PAIC判断脓毒症严重程度的临床价值。研究中脓毒症组包括104例患者,其中20例死亡,病死率为19.2%;脓毒性休克组包括59例患者,其中30例死亡,病死率为50.8%。目前我国重症监护病房的脓毒症流行病学数据显示,在所有脓毒症患者中脓毒性休克的发生率为53.3%,病死率为51.9%[9]。本研究中的脓毒性休克患者死亡率略低于国内平均水平。凝血功能障碍是脓毒性休克最常见的并发症[10]。本研究结果显示,脓毒性休克组的PT、APTT延长,FIB、ATIII水平降低,FDP和DD升高,PLT计数减少,DIC的发生率也升高5倍。脓毒性休克是脓毒症虽然经过充分的液体复苏仍然出现组织灌注不足和微循环障碍,临床诊断需要符合血管活性药维持下平均动脉压≥65 mmHg和乳酸>2 mmol/L的标准,但当血压下降至需要升压药物维持时,无疑休克已经发生到晚期,因此,我们需要及时对脓毒症的严重程度进行判断。
内皮损伤是脓毒性休克的基本病理过程,在低灌注和内毒素等炎症因子刺激下内皮细胞通透性增加,导致内皮屏障功能丧失、血管渗漏,有效循环血量不足,加重组织器官灌注障碍形成恶性循环[11-12]。t-PAIC是由内皮细胞损伤后释放的t-PA和PAI-1聚合而成,故也被认为是反映内皮细胞功能的指标[13-14]。本研究结果显示,脓毒性休克患者的t-PAIC水平显著高于脓毒症患者,t-PAIC水平与乳酸和SOFA评分均呈正相关,提示临床可根据t-PAIC水平的高低判断患者脓毒症的严重程度。Watanabe等[15]研究发现,与无器官衰竭的患者相比,已发生器官衰竭的患者t-PAIC水平显著升高,这与本研究结果一致。本研究采用单因素logistic回归分析结果显示t-PAIC是脓毒性休克的危险因素。取t-PAIC阈值为18.2 ng/mL时,t-PAIC判断脓毒性休克的曲线下面积达到0.858,灵敏度和特异度分别为0.780、0.788。根据t-PAIC界值分组结果显示,t-PAIC≥18.2 ng/mL后脓毒症患者的APACHE II评分、SOFA评分、乳酸水平、病死率、DIC发生率及脓毒性休克发生率均显著升高,且生存率下降约2.2倍。
综上所述, t-PAIC水平的高低与脓毒症严重程度相关。t-PAIC≥18.2 ng/mL时脓毒症患者病死率显著升高。

