三结构域蛋白21对结肠癌生物学行为的影响
贾佩琦,张嘉琦,苏东明
0 引 言
结直肠癌在全球常见癌症中排名第3位,是导致与癌症相关的发病率和死亡率升高的主要原因之一[1-2]。结直肠肿瘤早期往往源于结肠上皮层体积微小的良性腺瘤性息肉,晚期转变为极度分化不成熟的恶性腺瘤,最终随着时间的推移发展为侵袭性癌(I期和II期淋巴结转移)[3]。结直肠癌发生发展的分子机制包括遗传易感性、染色体不稳定性、DNA修复机制缺陷等。这些因素最终导致多种与肿瘤相关的基因突变、表观遗传改变(如异常的DNA甲基化)、miRNA异常、致癌基因的扩增或活性增强、特异性抑癌基因的抑制或失活,从而驱动与肿瘤发生、增殖和转移相关的代谢途径[4-6]。
三结构域蛋白21(Tripartite motif 21, TRIM21)最先作为自身抗原被发现,表达于各种类型的细胞,特别是在T细胞、巨噬细胞和树突状细胞等免疫细胞中广泛表达。TRIM21又称为 Ro52/SS-A,可以参与固有免疫过程,调控多种细胞因子的分泌[7-8]。在干燥综合征、系统性硬化症和系统性红斑狼疮等自身免疫病的患者常见有TRIM21表达异常。随着对其蛋白结构和功能的深入研究,人们发现TRIM21具有E3泛素连接酶活性,并且在自噬发生中也起调控作用[9-12]。TRIM21既能作为受体、又能招募和组织自噬信号通路的重要分子——ULK1、BECN1、ATG16L1和ATG8[13]。
与整个TRIM蛋白家族的其他亚型相比,涉及TRIM21与结肠癌相关机制的文献极少。目前研究表明,TRIM21可下调Par-4水平,对结肠癌发生顺铂耐药起到促进作用[14]。而在结肠癌以外的其他癌症中,与TRIM21相关的研究中则有相反趋势。例如在乳腺癌中,TRIM21介导Snail泛素化,调节乳腺癌细胞上皮向间质转化[15]。TRIM21表达的降低,提示不良预后[16]。因此,了解TRIM21的下游分子,也有助于解释不同癌症中TRIM21蛋白功能的多样性。因此,本研究进一步研究TRIM21在结肠癌的发生发展中可能涉及的分子机制,从而为结肠癌的诊断治疗提供靶点和理论依据。
1 材料与方法
1.1 材料及主要试剂选取2019年10月至2020年4月南京医科大学附属逸夫医院病理科诊断为结肠腺癌的20份患者病理标本。人正常结肠上皮细胞NCM460及人结肠癌细胞HCT116、HT29、SW620购买于美国ATCC公司。FBS胎牛血清购买于中国维森特公司。1640培养基、胰蛋白酶-EDTA消化液购买于美国Gibco公司。带有绿色荧光标记蛋白和嘌呤霉素抗性标记的TRIM21过表达慢病毒载体、带有红色荧光标记蛋白和嘌呤霉素抗性标记的干扰TRIM21慢病毒载体由上海吉凯基因公司构建。Trizol和qRT-PCR试剂购买于日本Takara公司,qRT-PCR引物购买于上海生工生物工程公司。TRIM21:5′-TCAGCAGCACGCTTGACAAT-3′(F), 5′-GGCCACACTCGATGCTCAC-3′(R);GAPDH:5′-TGTGGGCATCAATGGATTTGG-3′(F), 5′-ACACCATGTATTCCGGGTCAAT-3′(R)。DMSO、TEMED、苏木素染液、磺酰罗丹明B购买于美国Sigma公司。BCA蛋白定量试剂盒购买于美国 Thermo 公司。TRIM21(货号:12108-1-AP)和内参GAPDH抗体(货号:60004-1-Ig)购买于Proteintech公司,内源性过氧化物酶抑制剂、PV8000免疫组化兔/鼠通用二抗、DAB染液购买于北京中杉金桥生物技术有限公司。青霉素-链霉素双抗购买于中国碧云天公司。其余试剂均购买于中国上海国药集团公司。
1.2方法
1.2.1 免疫组化检测组织TRIM21表达采用链霉菌生物素-过氧化物酶法(SP法)。染色结果分别根据TRIM21的表达强度进行评分:阴性0分、弱阳性1分、阳性2分、强阳性3分。
1.2.2细胞培养及转染常规培养人结肠癌细胞HCT116采用用含10%胎牛血清的1640完全培养基。慢病毒转染分组:对照组(过表达空载)、过表达组(转染TRIM21过表达慢病毒)、空载组(低表达空载对照)、低表达组(转染TRIM21低表达慢病毒)。新复苏的野生型HCT116细胞传至第3代,消化处于对数生长期的细胞,离心后用完全培养基重悬为单细胞悬液,接种至6孔板中,数量控制在每孔5×104个细胞,置于培养箱中继续培养,待细胞融合度为30%以上再做转染,病毒感染复数值为20;转染72 h后根据荧光表达的强度、荧光细胞占细胞总数目的百分比评估感染效率,接种至10 cm培养皿继续培养,以1 μg/ mL终浓度的嘌呤霉素筛选,同时设置野生型HCT116细胞设为筛选对照。待野生型细胞全部死亡后,以0.6 μg/mL的嘌呤霉素终浓度维持培养,并以96孔板每孔1个细胞的密度铺板,扩增单克隆细胞。
1.2.3Western blot检测结肠细胞系TRIM21表达细胞总蛋白提取全程在冰上操作。按100∶1混匀蛋白裂解液和PMSF,冰浴备用,4 ℃预冷离心机。待培养细胞密度足够时,弃去培养基,用PBS清洗3遍后弃除,滴加准备好的蛋白裂解混合液,与细胞充分接触后用细胞刮将贴壁细胞刮致完全脱落。将得到的细胞悬浮液移入1.5 mL的EP管中,冰浴静置15~20 min,离心、取上清,BCA法测定蛋白浓度后,加6×loading buffer,95 ℃煮样10 min。使用5%浓缩胶、10%分离胶SDS-PAGE电泳分离蛋白,恒流180 mA转膜2 h,转印后PVDF膜使用5%脱脂奶粉封闭2~2.5 h,孵育抗工作液(TBST按TRIM21 1∶800、GAPDH 1∶8000稀释),4 ℃摇床过夜;TBST洗膜15 min,3遍;孵育二抗工作液(TBST按1∶8000稀释),室温60 min;TBST洗膜15 min,3遍后现配ECL超敏发光液显影。
1.2.4磺酰罗丹明B法检测细胞增殖使用上述分组进行实验。消化处于对数生长期的HCT116细胞,进行细胞计数,2500个/孔接种至96孔板;分别在24 h、48 h、72 h和96 h收取96孔板,吸去培养液,用PBS小心洗涤1次;每孔加入200 μL的50%浓度TCA固定液,4 ℃固定60 min;弃去固定液,用去离子水清洗5遍,放置于37 ℃烘箱烘干,或于通风橱晾干;每孔加4 g/L SRB溶液100μL,放置于室温染色15 min;10 mL/L乙酸(1%)轻洗5次,晾干;每孔加10 mmol Tris-base(pH=10.5)100 μL,在平板振荡5 min;使用酶标仪测定波长为490 nm的吸光度值,以空白对照调零;根据吸光度值加权差值计算细胞增殖率。
1.2.5集落形成实验检测细胞增殖使用上述分组进行实验。消化处于对数生长期的HCT116细胞,细胞计数后以500个/孔接种于6孔板中,使细胞分散均匀,放于37 ℃,5% CO2细胞培养箱中培养2周;经常观察,当出现肉眼可见的克隆时,随即终止培养。弃去上清液,用PBS小心浸洗2次;4%多聚甲醛固定细胞5 mL固定15 min。去固定液,加适量GIMSA液色10~30 min,流水缓慢清洗,通风橱内干燥。倒置平皿并叠加一张带网格的透明胶片,肉眼直接计数克隆,或于低倍显微镜计>20个细胞的克隆数。克隆形成率计算公式如下:
克隆形成率=(克隆数/接种细胞数)×100%
1.2.6划痕实验检测细胞迁移使用上述分组进行实验。用尖头记号笔于6孔板背后,每间隔0.5~1 cm沿直尺均匀划横线,横穿过孔,每孔至少穿过5条线;每孔接种约5×105个细胞,具体数量取决于细胞种类,接种原则为过夜后融合率达到90%以上;第2天用枪头沿直尺垂至于马克笔标记划痕;每孔0.5 mL PBS轻柔洗细胞3次,去处划痕处悬浮细胞,加入低血清培养基(< 2% FBS)放入37 ℃,5%CO2培养箱,在划痕后0 h、24 h和48 h取样,拍照;使用Image J图像处理软件获取细胞间距离的均值,根据变化计算细胞迁移率。
1.2.7RNA测序分别提取空载组及低表达组的HCT116细胞总RNA后,用带有 Oligo(dT)的磁珠富集 mRNA,加入Fragmentation buffer 使其片断成为短片段,再以片断后的 mRNA 为模板,合成 cDNA 第一链、第二链,经末端修复、加碱基 A、测序接头,再经琼脂糖凝胶电泳回收目的大小片段,并进行 PCR 扩增,完成文库制备。文库上机用 Illumina HiSeqTM进行测序。对下机数据进行过滤、组装转录本,得到已知的转录本与新的转录本。对基因进行表达量分析与统计,并进行差异表达分析和功能富集分析。
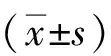
2 结 果
2.1 TRIM21在结肠癌组织和细胞系中表达的比较TRIM21表达于结肠上皮组织及肌层的细胞质及部分细胞核,见图1。结肠癌患者癌组织中TRIM21免疫组化评分(2.700±0.250)明显高于癌旁组织(2.500±0.346),差异有统计学意义(P<0.05)。Western blot结果显示,在结肠癌细胞系HCT116、HT29、SW620中TRIM21的表达(1.443±0.108、2.413±0.526、1.453±0.154)高于正常结肠上皮细胞NCM460(1.000±0.000),差异有统计学意义(P<0.01)。见图2。
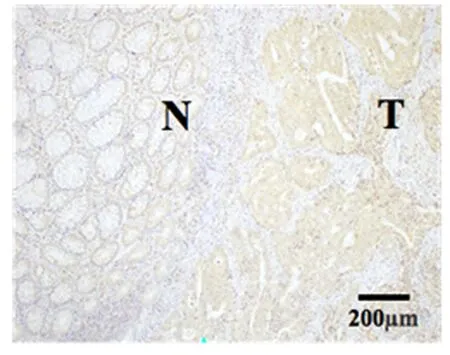
T:腺体异型的结肠癌组织; N:癌旁腺体结构分化基本正常的腺体

1:人正常结肠细胞系; 2-4:人结肠癌细胞系
2.2TRIM21过表达及低表达细胞株的Western blot验证选取TRIM21基础表达量处于结肠细胞系平均水平的细胞系HCT116,慢病毒转染后提取细胞总蛋白进行Western blot验证,结果见图3。与对照组TRIM21相对蛋白表达量(0.639±0.106)相比,过表达组(1.531±0.108)明显升高(P<0.001)。低表达组TRIM21的蛋白表达量(0.293±0.063)较空载组(0.640±0.083)明显降低(P<0.001)。上述结果表明在结肠癌细胞系HCT116中成功构建了TRIM21稳定过表达(TRIM21 OE)及稳定低表达(TRIM21 KD)模型,后续TRIM21表型实验皆采用此模型。
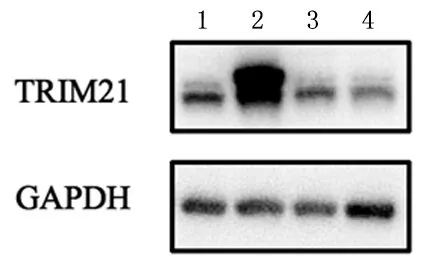
1:对照组; 2:过表达组; 3:空载组; 4:低表达组
2.3TRIM21在体外对结肠癌细胞HCT116增殖能力的影响SRB细胞增殖实验结果显示,在48 h、72 h和96 h,过表达组的HCT116结肠癌细胞生长能力较对照组明显增强(P<0.05)。低表达组HCT116结肠癌细胞生长能力较空载组明显降低(P<0.05),说明TRIM21稳定低表达致结肠癌细胞生长受抑制,见表1。集落形成实验结果显示,过表达组集落个数(446.667±75.719)较对照组(283.333±20.817)明显增加(P<0.05)。低表达组集落个数(413.667±81.070)较空载组(442.537±98.063)明显减少(P<0.05),结肠癌细胞生长受抑制。见图4。
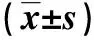
表 1 磺酰罗丹明B法检测细胞增殖的比较

图 4 集落形成实验检测细胞增殖结果
2.4TRIM21在体外对结肠癌细胞HCT116迁移能力的影响24、48 h,过表达组结肠癌细胞的迁移能力较对照组组明显增强(P<0.01),低表达组细胞的迁移能力较空载组显著减弱(P<0.01)。见图5,表2。

图 5 TRIM21对结肠癌细胞迁移能力的影响
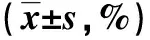
表 2 各组结肠癌细胞迁移率的比较
2.5TRIM21对下游分子的调控与空载组比较,低表达组在mRNA水平下调COX7A2L、KBTBD7、RAD51AP1、C2orf69等分子的表达,上调KRT7、TMEM158、TACSTD2、MAZ等分子的表达。对测序结果提示的TRIM21下游分子进行功能分析,TRIM21与中性粒细胞激活、横纹肌发育、类固醇激素反应、金属离子反应、细胞内受体信号通路、细胞对非生物刺激反应、细胞对环境刺激反应、成骨细胞分化、细胞连接形成、胎盘发育、NADH再生及代谢、葡萄糖分解代谢过程、RNA聚合酶II基因转录、着丝粒形成存在功能相关性,见图6。

a:TRIM21 RNA测序火山图;b:功能气泡图
3 讨 论
TRIM蛋白家族主要通过N端的RING-finger结构域被赋予E3泛素连接酶的功能,TRIM5α、TRIM9、TRIM3、TRIM28、TRIM27和TRIM37等均被报道具有E3泛素连接酶活性[17]。N端除RING-finger结构域之外,还有1-2个被命名为B-box的Zinc-finger结构域、Coiled-coil结构域。除此之外,C端还有PRY、SPRY、COS、FNIII、ACID等结构域。不同结构域之间的功能有所区别。
TRIM21参与固有免疫,调控多种细胞因子的分泌。而TRIM21的异常表达常常出现在干燥综合征、系统性硬化症和系统性红斑狼疮等自身免疫病发生时。同时,目前的研究已经证实TRIM21在多种癌症中存在异常表达,在不同的癌症中有双向功能。在乳腺癌中,TRIM21表达的降低,会促进癌细胞生长,提示不良预后[16];另有文献表明,TRIM21介导Snail泛素化,调节乳腺癌细胞上皮向间质转化[15]。
肿瘤抑制剂前列腺凋亡反应蛋白4(Par-4)在多种肿瘤中能诱导选择性凋亡,是公认的肿瘤抑制剂。TRIM21可通过C端的PRY-SPRY结构域与Par-4发生结合并下调Par-4,从而抑制癌细胞的选择性凋亡,最终增强结肠癌细胞对顺铂的耐药性[14]。带着“在结肠癌发生过程中,TRIM21是否真的扮演一个促癌因子”的疑问,展开对临床标本和细胞系的研究。本研究中,选取20例临床病例结肠癌及癌旁石蜡切片进行免疫组化染色,发现TRIM21在结肠癌组织的表达高于癌旁组织。在对结肠上皮细胞的研究中,通过对正常结肠上皮细胞NCM460及结肠癌细胞HCT116、HT29、SW620的Western Blot实验,证实TRIM21在结肠癌细胞的表达明显高于正常结肠细胞。HCT116、HT29均是从人结肠癌中分离得到的细胞系,HCT116与HT29相比具有较强的干细胞特性(CD44+/CD24-);而SW620为人结肠癌转移至淋巴结后提取到的细胞。
为了探究TRIM21对结肠癌细胞增殖、迁移的影响,本研究选取内生性TRIM21表达处于结肠癌细胞系中等水平的细胞系HCT116,分别构建了TRIM21稳定过表达(TRIM21 OE)稳定转染株、TRIM21稳定低表达(TRIM21 KD)细胞株以及各自的空载对照细胞株(NC、shNC)。细胞增殖实验、集落形成实验证实,分别与各自对照组相比,外源性过表达TRIM21显著促进结肠癌细胞HCT116的增殖;shRNA敲低TRIM21显著抑制结肠癌细胞HCT116的增殖。划痕实验表明,分别与各自对照组相比,外源性过表达TRIM21对结肠癌细胞HCT116的迁移能力起显著促进作用;shRNA敲低TRIM21对结肠癌细胞HCT116的迁移能力起显著抑制作用。
为了从转录组水平进一步研究TRIM21的功能,揭示TRIM21在结肠癌发生过程中的分子机制,RNA测序筛选出了潜在的COX7A2L、KBTBD7、RAD51AP1、C2orf69、 KRT7、TMEM158、TACSTD2、MAZ等下游分子,推测TRIM21与中性粒细胞激活、横纹肌发育、类固醇激素反应、金属离子反应、细胞内受体信号通路、细胞对非生物刺激反应、细胞对环境刺激反应、成骨细胞分化、细胞连接形成、胎盘发育、NADH再生及代谢、葡萄糖分解代谢过程、RNA聚合酶II基因转录、着丝粒形成等诸多生物功能相关。以上结果与TRIM21促结肠癌肿瘤发生的文献报道结果[14]相符,也为研究TRIM21参与调控结肠癌发生发展的分子机制及功能提供了方向。

