普鲁卡因调节SOX2对肾癌细胞增殖与凋亡的影响及其机制研究
余 晖,宋辉琼,程江霞,彭晓红
0 引 言
对肾癌患者来说,肾切除术仍然是局部肾癌的重要干预措施,但对于术后复发或转移性肾癌患者,系统治疗和个性化靶向治疗是主要的治疗手段[1-2]。
研究发现,局部麻醉药物普鲁卡因(procaine,PCA)在肺癌、肝癌、胃癌、乳腺癌等多种癌中取得了一定的疗效,其可终止细胞的有丝分裂,从而抑制肿瘤细胞的增长[3]。但其对肾癌细胞生物学行为的影响目前还未有研究。研究发现性别决定区Y-box蛋白2(Sex-determining region Y-box protein,SOX2)在人肾癌组织中的表达升高,是肾透明细胞癌患者预后的预测指标,与预后不良相关[4]。本研究假设PCA可能通过调控SOX2抑制肾癌,以人肾透明细胞腺癌细胞786-O 细胞为研究对象,以不同浓度PCA处理细胞检测其对786-O 细胞增殖、凋亡的影响及SOX2在此过程的作用,探寻PCA对肾癌的临床意义。
1 材料与方法
1.1 材料人肾透明细胞腺癌细胞系786-O、肾上皮细胞HEK293购自美国ATCC; PCA购自上海源叶生物科技有限公司;RPMI-1640培养基和胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶、四氮唑蓝(MTT)和二甲基亚矾(DMSO)购自北京索莱宝科技有限公司;SOX2抑制物(si-SOX2)、SOX2过表达载体(pcDNA3.1-SOX2)和阴性对照(si-NC、pcDNA3.1)购自上海吉玛制药有限公司;SOX2抗体、Cyclin D1抗体、Bax抗体、Bcl-2抗体和抗GAPDH抗体购自英国Abcam公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;双染色流式法细胞凋亡检测试剂盒购自美国BD公司;流式细胞仪购自美国BD公司,全自动酶标仪购自美国Bio-Rad公司。
1.2方法
1.2.1 细胞培养和药物处理细胞培养:将786-O细胞、HEK293细胞培养于含10 % FBS的RPMI-1640培养基,培养基中添加1% 青霉素和1% 链霉素,置于37 ℃ 5% CO2培养箱中常规培养。待细胞培养至对数生长期,用胰蛋白酶消化传代。药物处理:将100 mg PCA溶于2 mL无水乙醇,无菌水定容至10 mL,即为10 mg/mL的PCA,经过滤除菌分装后冻存。将PCA以终浓度 1、5、10 mmol/L加入RPMI-1640培养基中,培养786-O细胞、HEK293细胞。收集各组细胞,在培养24、48和72 h时,进行MTT实验,酶标仪测定A490nm值。结果表明,PCA低、中、高浓度组786-O 细胞随PCA浓度升高A490值降低,细胞凋亡率升高,Cyclin D1和Bcl-2表达量降低,Bax表达量升高,培养时间48 h。与对照相比,5 mmol/L PCA 786-O细胞中SOX2表达量显著降低(P<0.05)。说明5 mmol/L PCA可抑制786-O细胞中SOX2表达,选用5 mmol/L PCA进行后续实验。
1.2.2细胞转染待786-O细胞培养至对数生长期,按照Lipofectamine 2000说明书进行细胞转染。先用无血清OptiMEM培养液稀释Lipofectamine 2000、SOX2干扰对照质粒(si-NC)、SOX2干扰质粒(si-SOX2),然后将等体积脂质体、载体或片段混合,室温孵育20 min,然后加入到培养好的786-O 细胞中,混合均匀,置培养箱中继续培养,培养6 h后换成RPMI-1640完全培养基继续培养48 h,分别记为si-NC组和si-SOX2组。
将SOX2过表达对照质粒(pcDNA3.1)和SOX2过表达质粒(pcDNA3.1-SOX2)按上述方法转染至786-O 细胞中,6 h后用含5 mmol/L PCA的RPMI-1640培养基继续培养48h,分别记为PCA-M+pcDNA3.1组和PCA-M+pcDNA3.1-SOX2组。
1.2.3流式细胞术测定细胞凋亡率将各组细胞,用无 EDTA 的0.25%的胰蛋白酶消化,用PBS缓冲液洗涤2次,收集细胞,根据 Annexin V/PI 试剂盒说明书进行操作,先加 300 μL Binding buffer重悬细胞,再加入5 μL Annexin V-FITC混匀,避光室温孵育20 min,再加入5 μL 碘化丙啶(PI)和200 μL Binding buffer,用流式细胞仪检测细胞凋亡率。
1.2.4Western blot检测收集各组786-O细胞,加入RIPA裂解液重悬细胞,超声破碎后离心收集蛋白,测定总蛋白浓度。将收集的蛋白样本进行SDS-PAGE,然后将蛋白转移到PVDF膜上,5%脱脂奶粉室温封闭2 h,加入稀释的一抗(SOX2抗体1∶1000、Cyclin D1抗体1∶2000、Bax抗体1∶3000、Bcl-2抗体1∶3000和GAPDH抗体1∶4000),4 ℃孵育过夜,用TBST缓冲液洗膜3次,加入稀释的酶标二抗室温孵育1 h,显影后扫描,以GAPDH 为内参照,分析蛋白表达水平。
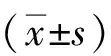
2 结 果
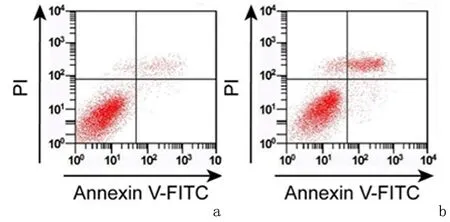
2.1 抑制SOX2对细胞786-O增殖、凋亡的影响与si-NC组相比,si-SOX2组786-O细胞中SOX2、Cyclin D1和Bcl-2 表达量显著降低(P<0.05),Bax表达升高(P<0.05),细胞A490值在24、48和72 h均显著降低(P<0.05),si-SOX2组细胞凋亡率[(22.20±2.23)%]较si-NC组[(7.35±0.74)%]显著升高(P<0.05),见图1、图2,表1。表明抑制SOX2可抑制786-O 细胞增殖并促进细胞凋亡。
a:si-NC组; b:si-SOX2组
1:si-NC组; 2:si-SOX2组
表 1 抑制SOX2对786-O细胞活性、凋亡和786-O增殖、凋亡蛋白表达影响
2.2过表达SOX2能逆转PCA对细胞786-O增殖的抑制作用与对照组相比,PCA组786-O 细胞中SOX2和CyclinD1表达量显著降低(P<0.05),p21蛋白表达量显著升高(P<0.05),细胞A490值在24、48和72 h均显著降低(P<0.05);与PCA-M+pcDNA3.1组相比,PCA-M+pcDNA3.1-SOX2组786-O 细胞中SOX2和CyclinD1含量显著升高(P<0.05),细胞A490值在24、48和72 h均显著升高(P<0.05)。见图3,表2。说明过表达SOX2可逆转PCA对786-O 细胞的增殖抑制作用。
2.3过表达SOX2能逆转PCA对细胞786-O凋亡的促进作用与对照组相比,PCA组786-O 细胞中Bcl-2表达量显著降低(P<0.05),Bax蛋白表达量显著升高(P<0.05),细胞凋亡率显著升高(P<0.05);与PCA +pcDNA3.1组相比,PCA+pcDNA3.1-SOX2组786-O 细胞中Bcl-2表达量显著升高(P<0.05),Bax蛋白表达量显著降低(P<0.05),细胞凋亡率显著降低(P<0.05)。见图4、图5,表3。说明过表达SOX2可逆转PCA对786-O 细胞凋亡的促进作用。
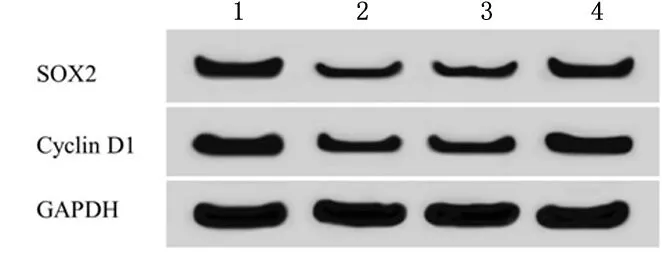
1:对照组; 2:PCA组; 3:PCA +pcDNA3.1组; 4:PCA+pcDNA3.1-SOX2组
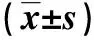
表 2 过表达SOX2能逆转PCA对细胞786-O增殖的抑制作用
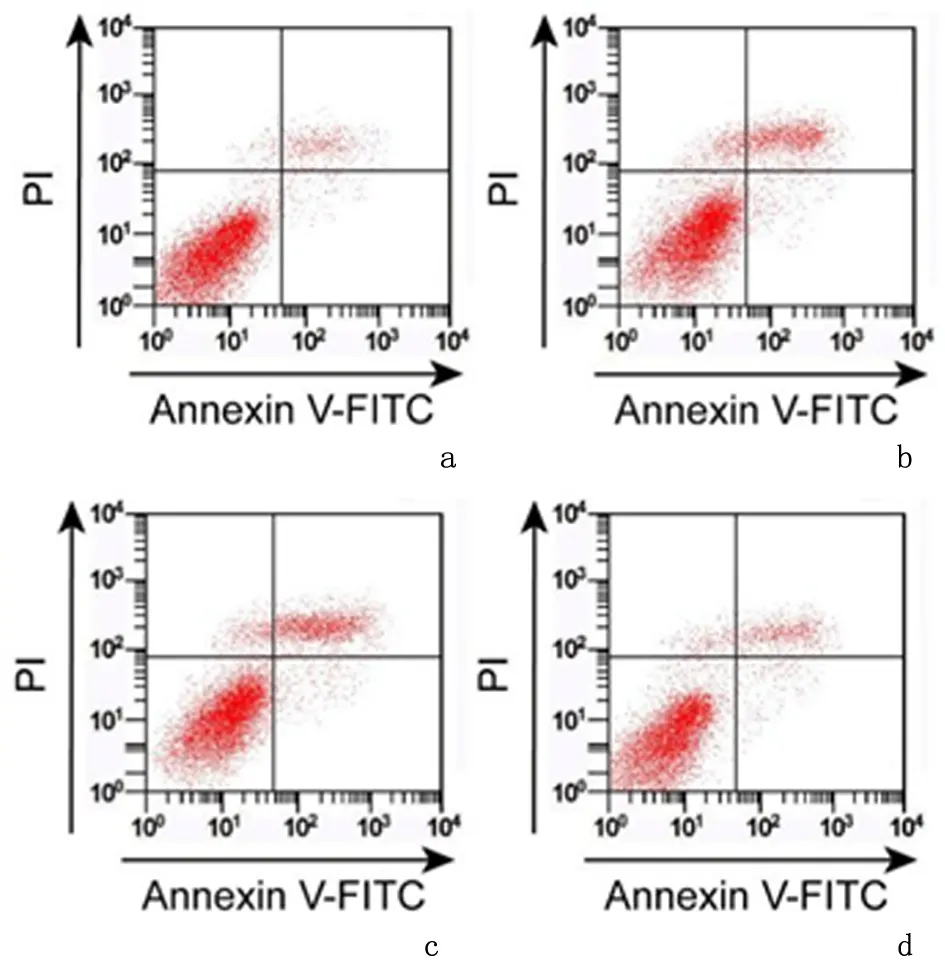
a:对照组; b:PCA组; c:PCA +pcDNA3.1组; d:PCA+pcDNA3.1-SOX2组

1:对照组; 2:PCA组; 3:PCA +pcDNA3.1组; 4:PCA+pcDNA3.1-SOX2组
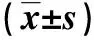
表 3 过表达SOX2能逆转PCA对细胞786-O凋亡的促进作用
3 讨 论
众多研究证实,PCA对胃癌、骨肉瘤、结肠癌和肺癌有显著的抑制作用,但其对肾癌是否也具有抑制作用尚不清楚[5-8]。本研究分别用1、5、10 mmol/L的PCA处理肾癌786-O 细胞和正常肾上皮细胞HEK293,结果表明3种浓度的PCA均可抑制肾癌786-O 细胞增殖并促进细胞凋亡,使增殖相关蛋白Cyclin D1表达下调,凋亡相关蛋白Bax表达上调而Bcl-2表达下调,说明PCA对肾癌具有潜在的临床抑制作用,但其具体作用机制尚不清楚,后续实验选择对786-O 细胞抑制率约50%的5 mmol/L浓度的PCA,但对正常肾上皮细胞HEK293无显著影响。
性别决定区Y-box蛋白2(Sex-determining region Y-box protein,SOX2)是SOX家族成员之一,SOX(SRY-like HMG box)家族是一类具有 HMG(high mobility group)特征性结构域的转录因子家族。转录因子SOX2在胚胎发生过程中必不可少,研究表明其在至少25种不同的癌症中都有表达,与肿瘤生长、转移、耐药性和生存率的增加有直接关系,针对SOX2的表达或其作用方式可以提高某些难以治疗的癌症患者的存活率[9]。SOX2是诱导多功能干细胞形成的重要因素,在中枢神经系统的发育、成体组织的稳态和衰老过程中也有重要作用[10]。SOX2在乳腺癌组织中高表达,与病理学分级、淋巴结转移及TNM分期有关[11]。在II期胰腺导管腺癌(PDAC)患者(均接受吉西他滨治疗)中,SOX2蛋白的高表达与吉西他滨耐药性、肿瘤复发和低生存率有关[12]。研究表明,SOX2在肾透明细胞癌(RCC)患者中高表达,是RCC患者预后的预测指标,SOX2高表达与预后不良相关[13]。下调SOX2可抑制RCC增殖、迁移和侵袭,并诱导细胞凋亡[14]。因此,本研究假设PCA可能通过调控SOX2抑制肾癌细胞的增殖。本研究发现,PCA处理后786-O 细胞中SOX2表达量显著下降,抑制SOX2可抑制786-O 细胞增殖并促进细胞凋亡;过表达SOX2可逆转PCA对786-O 细胞的增殖和凋亡的作用,说明PCA是通过抑制SOX2表达来抑制786-O 细胞增殖并促进细胞凋亡。
综上,本研究发现,PCA可通过抑制SOX2表达抑制肾癌786-O 细胞增殖和促进凋亡,PCA对肾癌具有潜在的抑制作用。
本研究存在一定的局限性,只进行了PCA对一种体外肾癌细胞的实验,后续将补充PCA对多种肾癌细胞及动物体内成瘤模型的作用,为PCA对肾癌的临床应用提供更可靠的实验数据支持。

