三种不同内膜转化方案在冻融胚胎移植中的比较
赵善飞 郑文玲 古昕茹
随着控制性卵巢刺激方案以及实验室培养技术的不断成熟,越来越多体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)新鲜周期有剩余可用胚胎,或者部分患者由于孕酮升高、预防卵巢过度刺激综合征、输卵管积液、内膜回声异常等原因取消新鲜移植,实施全胚冷冻。冻融胚胎移植(frozen embryo transfer,FET)内膜准备方案主要有三种,分别为自然周期、促排卵周期以及激素替代周期(hormone replacement therapy,HRT),前两者有排卵,后者无排卵,由于无排卵完全没有自身的黄体功能,所以外源性雌孕激素的补充对妊娠结局的影响至关重要[1]。HRT 周期需使用孕激素进行内膜转化以及黄体支持。常用药物有黄体酮注射液、阴道用微粒化黄体酮或者黄体酮缓释凝胶以及口服地屈孕酮片,大多数中心都是经验性用药,而且多为联合用药,至今未有证据推荐最佳的使用方案[2]。口服地屈孕酮片依从性好,不良反应少。国内甚少报道在HRT 周期中单独使用地屈孕酮片进行内膜转化以及后续的黄体支持[3]。本文回顾性分析比较3 种不同的内膜转化方案对冻融胚胎移植激素替代周期临床结局的影响。
1 资料和方法
1.1 一般资料
回顾性分析2016 年1 月1 日—2019 年10 月31 日在本中心接受HRT 方案行冻融胚胎移植的患者共325 周期,按不同的内膜转化方案分为三组,A 组单纯使用地屈孕酮片(72 周期),B 组肌肉注射恒定剂量黄体酮(172 周期),C 组肌肉注射递增剂量黄体酮(81 周期)。
纳入标准:(1)年龄<40 岁;(2)有2 个或以上第三天胚胎可移植。
排除标准:(1)存在其他影响胚胎着床的因素,如子宫腺肌症、子宫内膜异位症、子宫畸形、内膜异常、输卵管积水以及宫腔粘连等;(2)严重内外科疾病;(3)复发性流产;(4)反复胚胎种植失败。
1.2 方法
1.2.1 激素替代方法 从月经第3 ~5 天开始口服戊酸雌二醇片(批准文号:国药准字J20171038,规格:1 mg×21 片,生产厂家:法国DELPHARM Lille S.A.S.),每天4 ~6 mg,4天后改为6 ~9 mg,口服补佳乐第8 天复查B 超,若内膜超过7 mm,维持原剂量继续用药4 天,否则补佳乐加量,最大剂量每天不超过12 mg,口服补佳乐不超过21 天,口服补佳乐12 天复查B 超,当内膜厚度≥8 mm 开始给予孕激素转化内膜。
1.2.2 内膜转化方案 A 组(口服地屈孕酮片),内膜转化日开始每天给予地屈孕酮片(批准文号:国药准字H20170221,规格:10 mg×20 片,生产厂家:荷兰Abbott Biologicals B.V)20 mg bid;B 组(肌肉注射恒定剂量黄体酮),内膜转化日开始每天肌肉注射黄体酮(批准文号:国药准字H33020828,规格:1 mL:20 mg×10 支/盒,生产厂家:浙江仙琚制药股份有限公司)60 mg,连续4 天;C 组(肌肉注射递增剂量黄体酮),内膜转化第一天肌肉注射黄体酮(批准文号:国药准字H33020828,规格:1 mL:20 mg×10 支/盒,生产厂家:浙江仙琚制药股份有限公司)20 mg/天,第二天注射40 mg/天,第三天注射60 mg/天。所有患者均于内膜转化第4 天上午解冻移植第3 天胚胎。
1.2.3 后续黄体支持方案 上述3 组均于移植当天起改用口服地屈孕酮片20 mg bid 联合黄体酮阴道缓释凝胶(批准文号:国药准字H20140552,规格:90 mg×15 支/ 盒,生产企业:Fleet laboratories limited)90 mg/天或黄体酮胶囊(批准文号:国药准字H20160265,规格:0.2 g×15 片/盒,生产厂家:Besins Manufacturing Belgium)0.2 g 塞阴道 tid 进行黄体支持,雌激素剂量不变,雌孕激素用至胚胎移植术后第14 天,妊娠者继续黄体支持,雌激素于孕8 周逐渐减量至停药,孕激素于孕12 周停药。
1.3 FET 方法及评分标准
胚胎冷冻及胚胎复苏按本中心常规进行, 冻融过程为玻璃化冷冻法。复苏胚胎为卵裂期第3 天胚胎。FET 的胚胎标准:复苏后胚胎卵裂球数存活一半及以上,且复苏后为4 ~8 细胞期的I ~II级胚胎。胚胎移植由两名移植经验丰富的高年资医生进行。
1.4 妊娠结果判断及监测
胚胎移植14 天后抽血查β-HCG,使用电化学发光法测定血清β-HCG 值(仪器:Cobas e 411 罗氏电化学发光分析仪),若β-HCG ≥25 IU/L 判断为HCG 阳性,HCG 阳性者移植后4 周进行阴道B 超检查,宫腔内见妊娠囊确定为临床妊娠。
1.5 观察指标
分别比较三组的临床妊娠率、胚胎种植率、异位妊娠率以及早期自然流产率。
1.6 统计学方法
采用SPSS 16.0 进行数据统计分析,计量资料用(±s)表示,采用方差分析,计数资料用(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况的比较
三组的平均年龄、原发不孕比例、平均不孕年限、ET 日内膜厚度以及移植优胚数均无统计学差异,P>0.05。见表1。
2.2 妊娠结局的比较
A 组临床妊娠率以及胚胎着床率均低于B 组以及C 组,P<0.01,差异有统计学意义。其余指标各组间比较差异无统计学意义(P>0.05)。见表2。
3 讨论
在排卵性月经周期中,子宫内膜仅有很短的一段时间允许胚胎植入,称为“种植窗”。文献报道[4],子宫内膜种植窗的开放与孕激素的作用有关,孕激素是介导子宫内膜由增生期向分泌期转化的核心因素。在HRT 周期,由于无排卵无内源性黄体生成,需使用孕激素进行子宫内膜转化,使其由增生期转为分泌期,为胚胎着床及维持胚胎在子宫发育作准备。常用的孕激素有黄体酮注射液、黄体酮口服制剂以及黄体酮阴道制剂。其中黄体酮注射液可以避免肝脏的首过效应,短时间内达到较高的血药浓度,价格便宜,生物利用度高,可以单独使用作为黄体支持药物,在我国仍然是常用的黄体支持方式[5]。传统口服天然孕酮及口服微粒化黄体酮由于存在肝脏首过效应,生物利用度低,仅10%,所以甚少单独作为黄体支持药物[5]。而地屈孕酮片是天然孕酮的异构体,分子结构与内源性孕激素极为相似,对孕激素受体有较高的亲和力,口服易吸收,生物利用度高,用药依从性好,但不改变原血清中的孕酮水平,所以国内大多数生殖中心对单独使用地屈孕酮片进行黄体支持存在顾虑[6]。2015 年中华医学会生殖医学分会专家共识提出,目前尚缺乏地屈孕酮在黄体支持中单独应用有效性的循证医学证据[7]。2018 年一项国际随机、开放、多中心、III 期大样本量非劣效性临床研究显示,单独口服地屈孕酮30 毫克/天可以作为IVF 新鲜周期有效的黄体支持方案,而单独应用于冻融胚胎移植周期中的数据有限[8]。国内学者报道,口服地区孕酮片在FET-HRT 周期可替代黄体酮注射液作为内膜转化及黄体支持方案[3,6]。国外也有类似报道,FET-HRT 周期口服地屈孕酮片40 mg/天作为黄体支持与肌肉注射黄体酮50 mg/天以及黄体酮阴道制剂400 mg/天比较,临床妊娠率相当[9]。但本研究发现,在内膜转化早期单独使用口服地屈孕酮片的临床妊娠率及胚胎着床率均低于肌肉注射黄体酮组,差异有统计学意义(P <0.01),与国外Afsoon Zarein 学者报道一致[10],其研究发现在激素替代-冻融胚胎移植周期中,单独使用地屈孕酮片20 mg/天作为黄体支持的临床妊娠率显著低于阴道用黄体酮制剂以及地屈孕酮片联合GnRHa 或HCG 方案,故不推荐单独使用地屈孕酮片作为黄体支持方案。研究报道,口服地屈孕酮与阴道用黄体酮相比,在充分雌激素-子宫内膜启动后产生同相分泌子宫内膜的效果较低[11]。尚有类似报道,IVF 周期取消移植者中口服地屈孕酮片40 mg/天与肌肉注射黄体酮40 mg/天进行黄体支持,其内膜活检病理显示,口服地屈孕酮片后分泌期伴不足及仍为增生期的比例高于肌肉注射黄体酮,但无统计学差异[12-13],未排除与样本量小有关。说明可能地屈孕酮片转化内膜的能力低于黄体酮注射液及阴道用黄体酮制剂,不能引起子宫内膜的完全分泌转化,从而影响子宫内膜容受性,需要更多的临床数据及基础研究进一步证实。
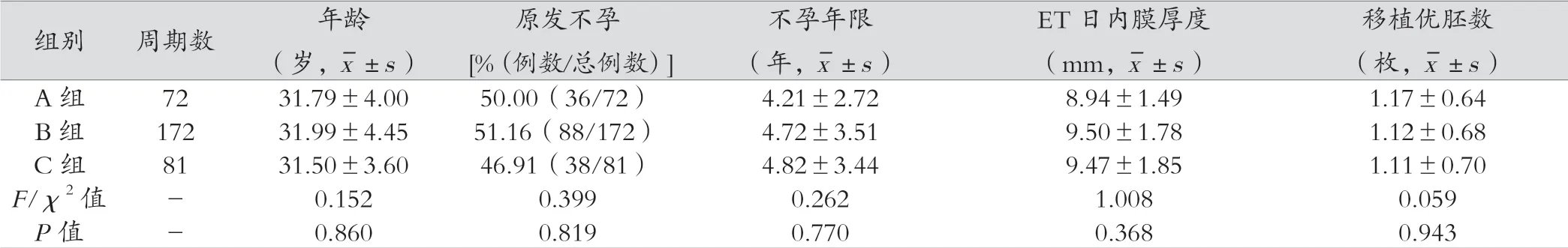
表1 三组患者基本情况比较
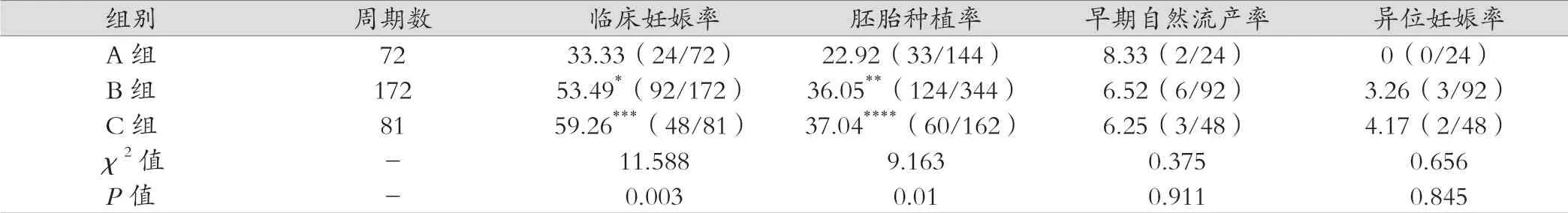
表2 三组妊娠结局比较 [%(例数/总例数)]
本研究中递增剂量肌肉注射黄体酮组能较好地模拟自然周期排卵后孕激素逐渐升高的模式,理论上更接近自然生理状态,与恒定剂量肌肉注射黄体酮组比较,临床妊娠率略有升高(59.26%vs 53.49%),但无统计学差异,可能与样本量较小有关系。在ART 黄体支持中,黄体酮经阴道给予途径是唯一可替代肌肉注射黄体酮的制剂[7]。肌肉注射黄体酮进行内膜转化,胚胎移植后改用口服地屈孕酮片联合黄体酮阴道制剂,可以避免长时间、大剂量使用黄体酮注射液,减少皮肤红肿、皮下硬结、瘙痒、脂膜炎等不良反应的发生。
综上所述,冻融胚胎移植激素替代周期中,肌肉注射黄体酮进行内膜转化妊娠结局优于单纯口服地屈孕酮片。希望国内日后能够有更多前瞻性、大样本的相关研究,以探讨在HRT 周期中何种孕激素转化内膜及黄体支持方案可以获得更好的妊娠结局。

