急性低氧胁迫和复氧恢复对青田田鱼幼鱼氧化应激和能量代谢的影响
齐 明,侯懿玲,刘 韬,苗艺馨,庄淑婷,曲宪成,刘其根
(1.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;2.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306;3.上海海洋大学,上海水产养殖工程技术研究中心,上海 201306)
溶氧(DO)是影响鱼类生存的重要环境因子之一,生境中溶氧的含量影响其代谢、生长和繁育等生理活动[1]。水体中急性低氧一直是水产养殖中棘手的问题,除辅助人工增氧,更多的是依靠鱼类的生理代谢进行适应性调节来缓解[2]。鱼类在急性低氧生境中,易诱发机体的氧化应激反应,尤其在低氧后的复氧过程中,氧化应激会更加剧烈[3]。氧化应激会产生过量的活性氧(ROS),扰乱机体内ROS的动态平衡,损伤细胞内的大分子物质并引起代谢紊乱;同时生境中低氧也会造成鱼体组织的缺氧,干扰正常的能量代谢[4]。
青田田鱼(Cyprinuscarpiovarqingtianensis)又称瓯江彩鲤、田鱼,隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲤属(Cyprinus),是浙江青田、永嘉一带一种特有的稻田养殖鲤[5]。稻田生境有别于传统水产养殖环境,其显著特征为DO昼夜变化幅度较大并存在长时间低氧期(6~10 h,DO<4 mg/L),同时存在干涸的风险并且无法有效进行人工辅助增氧[6]。青田田鱼是如何适应稻田生境,尚未有报道。本研究以青田田鱼为研究对象,探讨其在低氧胁迫和复氧过程中肝胰脏中氧化应激、呼吸和能量代谢指标的变化,了解青田田鱼对溶氧变化的适应性调节机制,为青田田鱼对稻田水环境适应性提供佐证,也为其他鱼类在急性溶氧变化的生理调控机制研究提供参考。
1 材料与方法
1.1 实验材料
试验用鱼购自浙江省青田县愚公生态农业有限公司同一批次繁育的幼鱼,选取活力好,健康无损伤,体长(17.12±0.59)cm和体质量(84.55±7.25)g的幼鱼运送至上海海洋大学生态与渔业实验室进行2周暂养。
1.2 试验设计
暂养时将63尾幼鱼随机平均分配在3个200 L实验桶(养殖用水体积150 L)中,每日投喂鲤人工配合饵料1次(宁波天邦食品股份有限公司),每日8∶00和18∶00分别使用曝气自来水换水一次,每次换水量约为养殖水体的1/2。暂养期间水中溶氧为(7.45±0.16)mg/L,水温为(25.91±1.27)℃,氨氮为(0.19±0.02)mg/L。正式试验前一天停止投食,但每日正常换水两次。低氧胁迫实验前,完成常氧组的取样(每个实验桶取3尾,同一实验桶中3尾鱼相同组织混样),此时的溶氧含量为(7.13±0.28)mg/L,水温为(25.17±0.41)℃。随后往水中注入氮气,待水中溶氧下降到0.5 mg/L左右后,调节氮气和空气的注入流量来控制水中的溶氧,分别在第2,4和6 h时进行幼鱼样本取样,每桶取3尾,胁迫期间水中的溶氧含量为(0.46±0.19)mg/L,水温为(25.37±0.95)℃。待低氧胁迫试验取样结束后,停止氮气注入并增大空气注入量,待水中溶氧含量升至7 mg/L时,调节空气注入量维持水中的溶氧含量,分别在第2,4 和6 h时进行幼鱼复氧恢复试验样本取样,每桶取3尾,恢复期间水中的溶氧含量为(7.75±0.17)mg/L,水温为(25.21±0.87)℃。整个试验期间,每10 min使用多功能溶氧仪(YSIPro20,USA)监测一次水中的溶氧变化。
1.3 样品采集与制备
将各时间点每个试验组的9尾幼鱼置于MS-222的水溶液(200 mg/L)中快速麻醉后,用滤纸擦净幼鱼体表水分后尾部静脉取血1.5 mL。将抽取的血液保存在含有0.05mL肝素钠溶液(浓度为1.5%)的2 mL离心管中,4 ℃静置保存 6 h后离心(4 ℃,3 000 r/min,10 min)取血浆,收集的血浆保存于-20 ℃用于血液指标的测定。
取血后的幼鱼置于冰板上进行解剖,取下肝胰脏,用滤纸吸干表面血液后置于2 mL离心管中,经过液氮预冷后放置在-80 ℃冰箱保存。后期肝胰脏组织在液氮条件下研磨成粉,置于离心管中进行准确称重。根据指标测定需要,往离心管中加入9倍(质量体积比)的0.9%的预冷生理盐水或5~9倍预冷提取液,涡旋振荡后离心(4 ℃,3 000 r/min,15 min)取上清液,进行相关生化指标的测定。
1.4 样品测定
肝胰脏和血液生化指标均使用全波长酶标仪(800TS,BIOTEK,美国)和分光光度计(TU-1900,PERSEE,北京)配合南京建成生物工程研究所生产的试剂盒进行测定。肝胰脏的氧化应激指标包括过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、超氧化物歧化酶(SOD)和谷胱甘肽-S-转移酶(GST)活力,丙二醛(MDA)、总谷胱甘肽(T-GSH)、氧化型谷胱甘肽(GSSG)和还原型谷胱甘肽(GSH)含量。呼吸代谢指标包括己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、柠檬酸合酶(CS)和乳酸脱氢酶(LDH)活力。能量代谢指标包括肝胰脏中糖原(Gn)和乳酸(LD)含量,血糖(B-Glu)和血乳酸(B-LD)含量。具体检测方法详见试剂盒说明。
1.5 数据处理
利用SPSS22.0统计分析软件对试验所得的数据进行单因素方差分析(One-way,ANOVA),运用邓肯(Duncan)多重比较对均值进行差异显著性检验,显著水平设为P<0.05。试验所得数据用平均数±标准差(mean±SD)表示。
2 结果与分析
2.1 急性低氧胁迫和复氧恢复对青田田鱼氧化应激指标的影响
急性低氧胁迫和复氧恢复对青田田鱼肝胰脏中酶促型氧化应激指标的影响见表1。在低氧胁迫阶段,胁迫6 h后SOD活力显著高于常氧组,胁迫2、4和6 h时GST活力均显著高于常氧组。在复氧恢复过程中,CAT活力在恢复2 h到4 h显著降低,但各恢复组与常氧组和胁迫6 h组相比无显著差异;SOD活力在恢复到6 h显著降低,恢复6 h时 SOD活力显著低于胁迫6 h,但与常氧组无显著差异;GST活力在恢复2 h显著升高且在各处理组中最高,随恢复时间的延长其活力显著降低,其活力在恢复6 h和胁迫6 h时无显著差异,但GST活力在恢复6 h显著高于常氧组。
急性低氧胁迫和复氧恢复对青田田鱼肝胰脏中非酶促型氧化应激指标的影响见表2。MDA含量随胁迫时间的延长逐步降低且在6 h时其含量显著低于常氧组;T-GSH含量和GSH/GSSG比例随胁迫时间的延长先升高后降低,T-GSH含量在胁迫2 h时显著高于常氧组而胁迫4 h时显著低于常氧组,GSH/GSSG比例在胁迫2 h和4 h时显著高于常氧组而胁迫6 h时显著低于常氧组。在复氧恢复过程中MDA含量先升后降且在4 h其含量为各处理组中最高,恢复6 h时其含量与胁迫6 h时相比无显著差异;T-GSH含量随着恢复时间的延长显著升高,与胁迫6 h和常氧组相比,恢复6 h时其含量无显著差异;GSH/GSSG比例随恢复时间的延长升高,恢复6 h其比例显著低于胁迫6 h和常氧组。

表1 急性低氧胁迫和复氧恢复对青田田鱼幼鱼肝胰脏中酶促型氧化应激指标的影响Tab.1 Effects of the oxidative index of enzymatic type in the hepatopancreas of juvenile C.carpio var qingtianensis during acute hypoxia and re-oxygenation U/mg prot
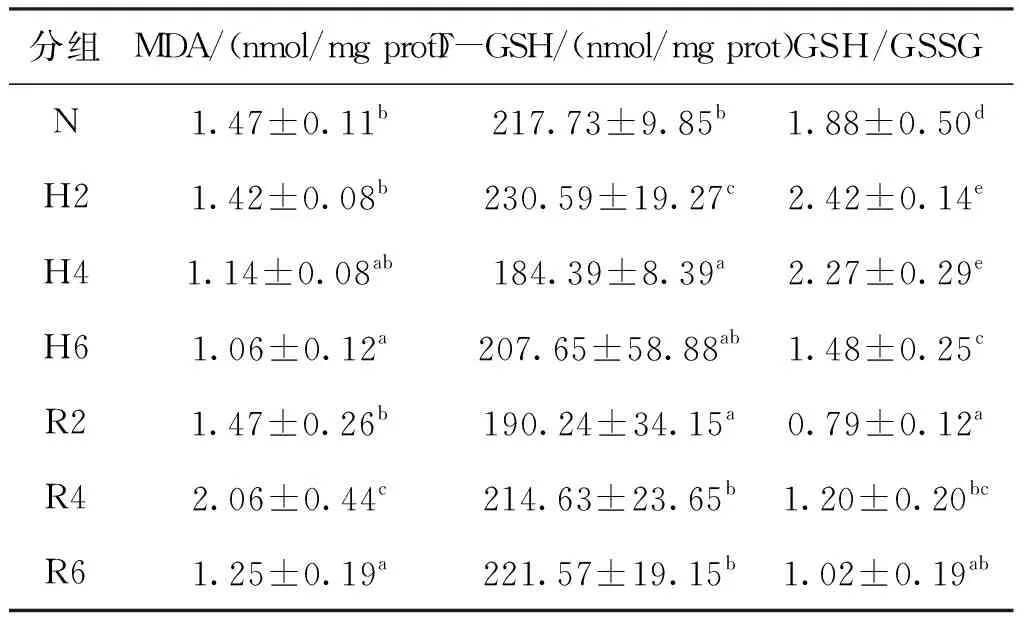
表2 急性低氧胁迫和复氧恢复对青田田鱼幼鱼肝胰脏中非酶促型氧化应激指标的影响Tab.2 Effects of oxidative index of nonenzymatic type in hepatopancreas of juvenile C.carpio var qingtianensis during acute hypoxia and re-oxygenation
2.2 急性低氧胁迫和复氧恢复对青田田鱼肝胰脏中呼吸代谢的影响
由表3可见,胁迫2 h时CS活力显著高于胁迫6 h;胁迫6 h时LDH活力显著高于常氧组,其他各呼吸代谢指标在各低氧胁迫处理时间点无显著差异。经过6 h的恢复,各呼吸代谢指标与胁迫6 h相比无显著差异,但与常氧组相比,HK活力显著升高,在恢复2 h时HK、PFK和PK活力为各实验处理组中最低。
2.3 急性低氧胁迫和复氧恢复对青田田鱼的肝胰脏和血液中能量代谢的影响
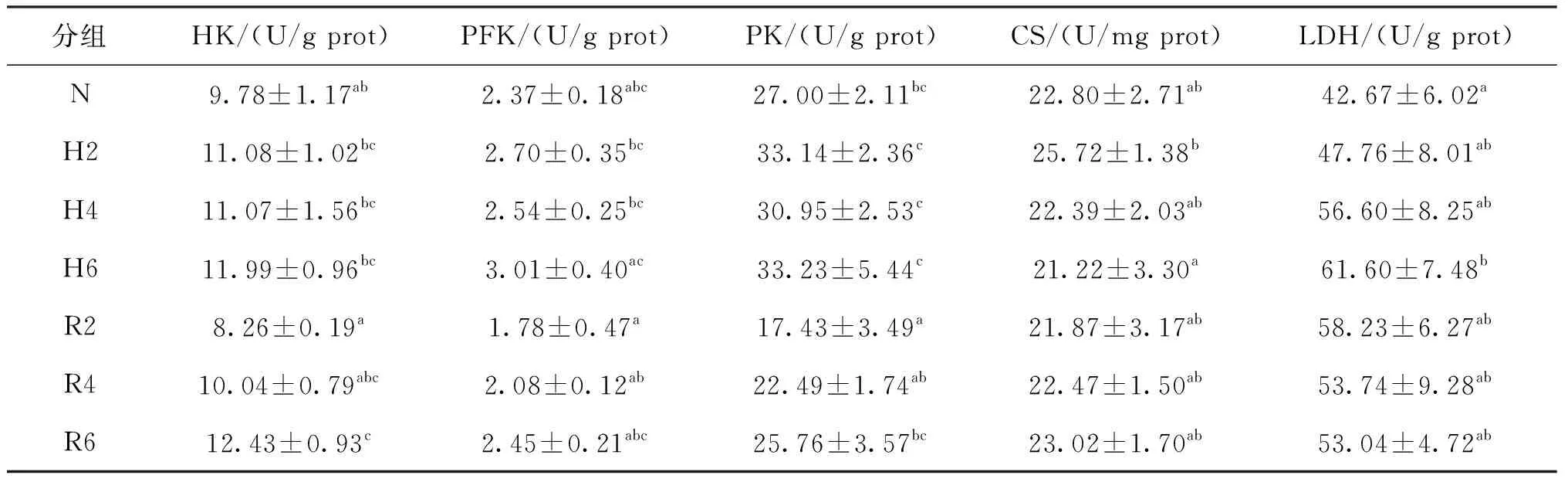
表3 急性低氧胁迫和复氧恢复对青田田鱼肝胰脏中呼吸代谢的影响Tab.3 Effects of respiratory metabolism in hepatopancreas of juvenile C.carpio var qingtianensis during acute hypoxia and re-oxygenation
根据表4可知,Gn含量在低氧胁迫过程中显著降低且各胁迫组显著低于常氧组;B-Glu含量先降低后升高且胁迫6 h时其含量与常氧组无显著差异;LD和B-LD含量随胁迫时间的延长逐步升高且胁迫6 h其含量显著高于常氧组。
在复氧恢复过程中,Gn、B-Glu、LD和B-LD含量无显著变化,恢复6 h Gn和B-Glu含量与胁迫6 h时相比无显著差异;而LD和B-LD含量在恢复6 h时显著高于常氧组,但与胁迫6 h时无显著变化。
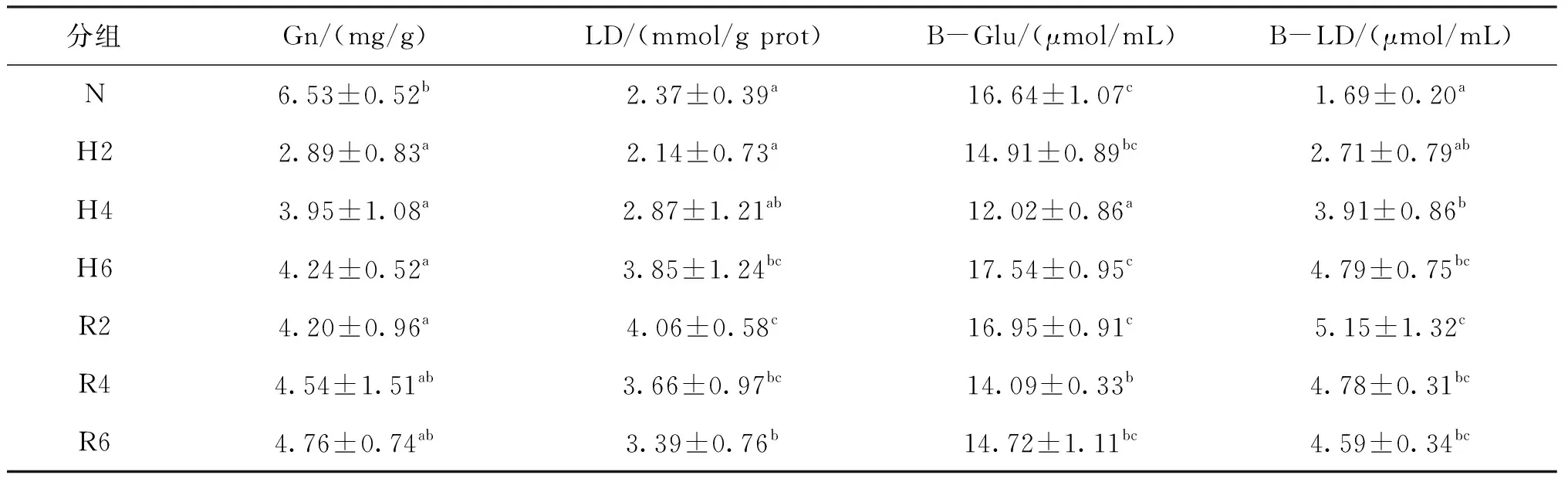
表4 急性低氧胁迫和复氧恢复对青田田鱼的肝胰脏和血液中能量代谢的影响Tab.4 Effects of energy metabolism in hepatopancreas and blood of juvenile C.carpio var qingtianensis during acute hypoxia and reoxygenation
3 讨论
3.1 急性低氧胁迫和复氧恢复对青田田鱼氧化应激指标的影响


青田田鱼肝胰脏中MDA含量在低氧胁迫过程中持续减少,花鲈受到低氧胁迫时也有类似现象,有学者认为ROS的主要来源之一为线粒体内膜的呼吸链底物端,氧化应激产生了过量的ROS抑制了脂质氧化酶的活性,随着低氧时间的延长造成组织功能性缺氧,限制了线粒体电子传递链给O2过程,减少了ROS的产生,脂质氧化水平得到缓解[9,14,17]。肝胰脏中T-GSH含量和GSH/GSSG比例在这一过程都先升后降,不同的是在低氧胁迫2 h时T-GSH含量显著高于其他各时间点,但GSH/GSSG比例变化更加显著,表明肝胰脏通过合成和转化产生大量的GSH来清除ROS,后期GSH含量的减少也印证了ROS在低氧末期的产生受到抑制[18]。
恢复初期,CAT、SOD和GST活力显著升高,MDA含量也在此时显著升高,而T-GSH含量和GSH/GSSG比例显著降低,这是由于青田田鱼再次增强抗氧化防御机制来应对由复氧产生新一轮的氧化应激,这与花鲈[14]和鲻(Mugilcephalus)[19]的结果十分相似,但是不同的是花鲈肝胰脏中SOD、CAT活力并未显著变化,这可能是由于实验设计中低氧浓度和复氧恢复时间有所差异。恢复6 h时,除GST显著高于对照组外,其余氧化应激指标均恢复到常氧组水平,说明青田田鱼肝胰脏组织中基本恢复了稳态。
3.2 急性低氧胁迫和复氧恢复对青田田鱼呼吸代谢的影响
鱼类在低氧压力下会更加依赖碳水化合物代谢供能,同时低氧使鱼类无法通过呼吸获得正常需氧量,造成局部组织的缺氧,进而改变呼吸代谢方式[20]。糖原是鱼体葡萄糖的主要存储形式,相较于肌糖原,肝Gn的葡萄糖单位含量更高,有研究表明糖原与鱼类的耐低氧能力有关[21]。LD既是无氧呼吸产物,也可作为供能代谢的底物[22,23]。HK、PFK、PK、CS和LDH是葡萄糖代谢过程中重要的调控酶,其活力的变化直观反映组织细胞的呼吸代谢方式[24,25]。同时LD含量和LDH活力也常用来评估鱼类的低氧耐受能力[26]。
本试验中低氧胁迫初期肝胰脏中Gn含量急剧下降,LD含量略微下降,表明Gn分解成葡萄糖,一部分进行肝脏供能代谢,另一部分经过葡萄糖转运蛋白输出补充血糖浓度,保障整个机体其他组织的供能代谢[14,27]。HK、PFK、PK、CS和LDH活力均升高,表明青田田鱼在感受到外界溶氧变化后,增强能量代谢进行适应性调整,这与瓦氏黄颡鱼(Pelteobagrusvachelli)[28]和杂交黄颡鱼(P.vachelii♂×P.fulvidraco♀)[26]的研究结果相类似。LD含量无显著变化,这是由于低氧胁迫初期青田田鱼肝胰脏组织以高效的有氧呼吸供能为主。随着胁迫时间的延长,LD含量和LDH活力显著升高,HK、PFK、PK活力和Gn含量无显著变化,而CS活力略微降低,这表明肝胰脏组织缺氧状况加重,加强了无氧呼吸供能,削弱了有氧呼吸代谢[25,29]。
复氧初期,LDH活力会略微降低而CS活力略微回升,同时PFK、HK、PK活力显著降低,Gn含量无显著变化,这是由于随着溶氧的恢复,组织缺氧状况得到缓解,无氧呼吸开始削弱,有氧呼吸代谢方式加强。低氧胁迫阶段肝胰脏中积累大量的LD,可以异生为葡萄糖进行Gn回补和供能代谢,也可以转化丙酮酸进入TCA循环[23]。随着恢复时间的延长,Gn含量和HK、CS活力略微升高,而LDH活力和LD含量降低,这是由于组织缺氧状况得到进一步的缓解,青田田鱼机体有氧呼吸作用得到加强,而无氧呼吸作用相对减弱。复氧末期,LDH、HK活力升高,CS活力略微升高,LD含量逐步降低,Gn含量逐步升高,表明肝胰脏仍然以LD为底物进行糖异生和代谢供能为主,同时加强了糖酵解作用,有氧呼吸开始加强[30]。同时Gn含量恢复到正常水平也说明机体逐步趋于稳态[31]。张国松[28]在瓦氏黄颡鱼的研究中,复氧1.5 h其肝胰脏中的CS活力显著升高而后降低,但在本研究中并未出现这一现象,这可能是青田田鱼长期生活在稻田环境中,对急性溶氧变化产生了一定的适应性。
3.3 急性低氧胁迫和复氧恢复对青田田鱼血糖和血乳酸的影响
血糖是机体内葡萄糖主要运输形式,乳酸为葡萄糖厌氧代谢产物,两者通过血液循环完成组织间能量的再分配[32]。在本试验中低氧胁迫初中期,血糖含量显著降低,这是由于低氧带来的氧化应激压力,各组织加强对葡萄糖的利用,这与低氧胁迫4 h团头鲂(Megalobramaamblycephala)的实验结果一致[33]。低氧胁迫后期血糖和乳酸含量显著升高,这是由于高血糖可以有效地维持机体的能量供给,同时组织缺氧增强了厌氧代谢,造成血乳酸含量的升高,这与黄带拟鲹(Pseudocaranxdentex)无氧运动后出现高血糖反应和血乳酸含量升高的结果相类似[34]。在复氧过程中,血液中血糖和乳酸含量逐步降低,这是由于在复氧过程中,组织缺氧状况得到恢复,乳酸异生为葡萄糖进行能量代谢底物的补充,血糖回补脏器组织进行糖原合成和供能代谢,促进机体稳态[23,35]。
综上所述急性低氧胁迫与复氧对青田田鱼生理代谢产生了显著的影响。在这一过程中青田田鱼通过增强氧化应激防御机制,调整有氧和无氧呼吸的供能方式,保障机体能量供给等手段来适应急性溶氧变化。经过6 h复氧恢复后,抗氧化酶活力和糖原基本恢复到常氧组水平,说明青田田鱼生理代谢趋于稳态,同时对高含量乳酸的耐受,表明青田田鱼有很强的低氧耐受能力和恢复能力。

