中链甘油三酯生酮饮食在神经退行性疾病治疗中的应用
刘春红 靳 力 王正平 张 宁 张瑞岩 尹肖寒 王庆鹏
(聊城大学 生物制药研究院,山东 聊城 252059)
0 引言
经典的生酮饮食是源于19世纪20年代,主要目的是模拟热卡限制饮食时机体的生化改变,是一种高脂肪、低蛋白质和低碳水化合物的一种饮食[1]. 这种限制碳水化合物摄入的高脂肪饮食使机体葡萄糖水平明显减少,而酮体(乙酰乙酸、β-羟基丁酸、丙酮)及脂肪酸水平升高. 由于肝外组织缺乏糖异生的关键酶,外周组织和神经系统必须通过酮体氧化供能,酮体成为机体的主要能量来源. 如今,生酮饮食应用于临床治疗已有90余年,主要用于治疗难治性癫痫[2],效果显著,改善了患者的生活质量. 传统生酮饮食,脂肪与蛋白质加碳水化合物的质量比为4:1,为了使蛋白质和碳水化合物的摄入量趋于正常,增加患者依从性,KD已从经典生酮饮食(LKD),发展为富含中链甘油三酯(MCT)生酮饮食,改良阿特金斯饮食(MAD),低血糖指数治疗型生酮饮食(LGIT)(见表1). 中链甘油三酯生酮饮食由于其易吸收,迅速供能,产酮率高,口感好等特点已广泛应用于临床治疗[3].
临床研究发现KD对神经系统具有保护作用. 机体在“无糖”的条件下,增加脑内γ-氨基丁酸的合成,限制了活性氧的产生,提高了神经元的抗损伤能力[4]. 酮体替代葡萄糖作为中枢神经系统的能量底物,为大脑提供能量,降低了由于线粒体损伤引起的供能不足. 此外,相关研究证实,生酮饮食在调节神经递质、神经营养因子、抑制氧化应激和抗炎等方面也有重要作用,这些适应性改变与多种能量代谢的改变共同调控神经活动.
1 中链甘油三酯的代谢
中链甘油三酯(Medium chain triglyceride,MCT)在胃和十二指肠内被分解成甘油和中链脂肪酸(含6-12个碳). 这些中链脂肪酸相比长链脂肪酸,水溶性较好,不需胆汁的乳化,如癸酸(十碳酸)和辛酸(八碳酸)可直接在小肠毛细血管经门静脉进入肝脏,通过β-氧化快速代谢[6]. MCT的特点是分子量小,吸收快,迅速供能. 中链甘油三酯代谢产物除酮体可以为大脑供能,其分解产生的中链脂肪酸也可以直接为大脑提供能量,MKD在体内的代谢过程见图1. 血浆中50%的脂肪酸可直接透过血脑屏障,为神经元及神经胶质细胞提供能量[7, 8]. 不同碳链长度的中链脂肪酸代谢程度不同. Wlaz P等研究表明,在星形胶质细胞中辛酸比癸酸易接受β-氧化,更易产生酮体[9]. Thevenet, J等研究证实,癸酸优先刺激糖酵解,促进乳酸的产生,为大脑供能. 中链脂肪酸可通过调节星形胶质细胞的代谢,从而激活星形胶质细胞-神经元间乳酸和酮体穿梭系统,为邻近的神经元提供能量[10].

表1 四种生酮饮食的特点
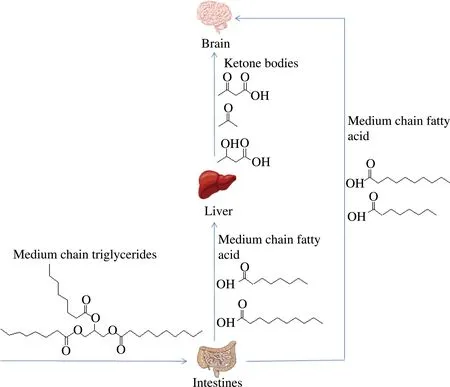
注:MKD在小肠内被代谢为中链脂肪酸,一部分中链脂肪酸(辛酸、癸酸)可经肝脏分解成酮体(乙酰乙酸、
丙酮、β-羟基丁酸)直接为大脑供能;另一部分中链脂肪酸可直接透过血脑屏障为大脑提供能量.
图1 MKD代谢过程
2 MKD在神经退行性疾病中的应用
2.1 MKD在癫痫中的应用
癫痫是一种中枢神经系统功能失常的慢性疾病,以脑神经元异常放电引起反复痫性发作为临床特征,表现为突发意识障碍,四肢抽动,眼睑上翻等症状,其特点为病程长、致残率高,给患者造成巨大的生理负担和心理负担,影响患者生活质量. 脑神经元的膜电位不稳定,惊厥阈值下降是其主要病理改变. 早在1921年KD就应用于癫痫的治疗,并取得了肯定的疗效. 近年来,MKD在治疗难治性癫痫疾病中成为新的研究热点. MKD联合抗癫痫药物的使用,不仅可以降低其药物带来的不良反应及副作用,而且更有效降低癫痫的发作频率和强度. Danielle等研究证实,对48名儿童和青少年癫痫患者以及成年癫痫患者进行MKD治疗,连续两年随访发现,大多数癫痫患者发作程度均有下降趋势[11,12]. 可见,MKD不仅可以减少癫痫的发作频率,还可以降低癫痫发作等级. 尽管生酮疗法可减少癫痫发作频率,且有充足的循证医学证据支持,但其作用机制目前仍不明确. 目前,大量学者对MKD治疗癫痫的机制进行了探索,提出了不同假设,以下几个方面是MKD代谢产物可能对癫痫的作用机制.
2.1.1 酮体对癫痫的作用机制. (1) 酮体具有直接抗惊厥作用:乙酰乙酸和β-羟基丁酸均能阻断谷氨酸转运体囊泡的形成,抑制谷氨酸在突触间的传递,从而起到抗惊厥的作用. Huttenlocher, P. R.等通过一项临床实验证实,血浆中的酮体有直接抗惊厥的作用[13]. (2) 通过线粒体代谢激活ATP敏感型钾离子通道:三磷酸腺苷钾离子通道开放的作用是降低动作电位频率、保护神经元,起负反馈调节作用. Yellen, G等研究发现,ATP依赖的钾离子通道的激活能够保护神经元免受损伤,从而减轻癫痫发作对大脑的损害[14]. 在进行生酮饮食治疗时,因动物体内的糖酵解途径受抑制,ATP/ADP减小,进而使钾离子通道开放,发挥脑保护作用,预防癫痫发作[15]. (3) 碳水化合物摄入减少的直接作用:葡萄糖转运蛋白(GLUT1)可以将葡萄糖从血液循环运送到大脑,当患者GLUT1发生突变时,会导致大脑中的葡萄糖供应不足,经典生酮饮食和中链甘油三酯生酮饮食对有GLUT1突变的患者有积极的治疗作用,被认为是酮替代了葡萄糖为大脑提供能量[16]. 在小鼠癫痫模型中,碳水化合物的补充会降低生酮饮食抗惊厥的作用效果[17],说明高脂低糖对控制癫痫发作有重要作用.
2.1.2 中链脂肪酸对癫痫的直接作用. 尽管酮体具有一定的抗惊厥作用,但在对突触传递和内在神经兴奋性是直接或间接的影响仍有争议. 在氨基丁酸受体拮抗剂戊四唑建立的大鼠癫痫模型中发现,高浓度酮体与癫痫的发作频率相关性较弱[15],最新研究发现,MKD代谢产生的中链脂肪酸,如辛酸和癸酸对控制癫痫发作有直接的作用. Wlaz P等研究证实,MKD中辛酸可以增大大鼠皮层的惊厥阈值,减少癫痫发作频率[8].在6Hz刺激试验(耐药癫痫的一种模型)和最大电击试验(强直性阵挛发作模型)的动物模型中证实,癸酸可以降低癫痫发作的阈值,对癫痫控制起到直接作用. Tan, K. N. 等研究表明,MCT干预的癫痫患者中,癸酸摄入后可以很快的通过血脑屏障,在大脑中达到足够的浓度后以减少兴奋,从而减少癫痫发作频率[18]. α-氨基-3-羟基-5-甲基-4-异恶唑受体(AMPA)介导中枢神经系统快速兴奋性突触传递,其在突触后膜的动态表达与长时程增强、长时程抑制的诱发和维持有关. Rogawski, M.A. 等人研究证明极低浓度的癸酸可以选择性或直接地抑制AMPA受体,抑制兴奋性突触的传递[19]. 直接抑制AMPA受体活性已被证实与治疗局灶性癫痫和广泛性强直性阵挛性发作有关,部分抗癫痫药物是通过抑制AMPA受体来发挥疗效,但作用靶点与癸酸不同[19,20].
2.2 MKD在多发性硬化症中的应用
多发性硬化症是一种以脑、脊髓白质脱髓鞘为特点的中枢神经系统(Central nervous system ,CNS)自身免疫性疾病. MS多发生于中青年,女性患病率约为男性的3倍. 病理特征为CNS脱髓鞘,轴索肿胀,炎性细胞浸润,星型胶质瘢痕增生,病灶分布广泛. 临床表现为感觉异常、视觉障碍、肌肉无力、共济失调、认知障碍等. 目前,该疾病无法彻底治愈,药物只能减缓疾病进展,常规的治疗药物主要是基于:(1) 对免疫系统的调控,增强免疫调节;(2) 对中枢神经系统的保护,改善神经元的功能,进而改善病程的进展. 有研究证明MS的发生与线粒体功能损伤和炎性有关.
William T.Regenold等研究显示,MS患者CNS葡萄糖代谢的线粒体外途径活性增加,这些能量代谢的改变可能与MS疾病进展的发病机制直接或间接相关. 可见,保护线粒体或促进线粒体能量代谢有助于MS疾病的治疗[21]. PGC-1α是线粒体功能的转录辅助激活因子,调控机体能量代谢, PGC-1α在MS患者皮质锥体神经元中的表达显著降低,导致ATP供应不足[22]. 大量相关研究显示,MKD在改善线粒体功能,抗炎等方面有重要的作用. Kirk Nylen等研究发现,生酮饮食可以增强线粒体功能,促进ATP生成,改善PGC-1α缺乏导致的ATP供应不足[23]. 越来越多的研究证明,核苷酸结合寡聚化结构域样受体蛋白3 (Nucleotide- binding oligomerization domainlike receptors family pyrin domain containing 3, NLRP3)炎症小体异常活化参与MS的发病过程. NLRP3最重要的功能是形成炎症小体,并促进IL-18 和IL-1β的成熟与分泌. 实验性自身免疫性脑脊髓炎(简称EAE),是一种常见的模拟MS的动物模型. 炎症小体的产物Caspase-1、IL-11β及IL-18已被证实有助于EAE的发生发展. Caspase-1、IL-1β及IL-18的缺陷鼠表现出对EAE的抵抗耐受,同时也伴随着IFN-r以及IL-17水平的降低. 有关报道指出,NLRP3缺陷鼠的EAE病情明显缓解,同时炎性细胞的浸润明显减少,说明NLRP3通过IL-18调节EAE. Inoue等研究发现,在MS患者中Caspase-1、IL-1β 和 IL-18 的表达显著升高,表明NLRP3炎性小体与MS有关[24]. Goldberg, E. L等研究发现,生酮饮食代谢产物β-羟基丁酸可以抑制NLRP3炎性小体,起到抗炎的作用,而MKD产酮率高,可更有效的控制MS疾病的进展[25]. 此外,MCT在体内消化代谢的速度与葡萄糖相当,且产生的能量高于葡萄糖产生能量的2倍,可改善MS患者脑能量供应不足的情况.
2.3 MKD在阿尔茨海默症中的应用
阿尔茨海默症是一种常见的中枢神经系统退行性疾病,临床表现以记忆功能障碍、认知障碍、视空间技能损害、执行功能障碍以及以人格和行为改变等全面性痴呆表现为特征. 主要病理学改变包括:大脑皮质弥散性萎缩,错误折叠的β-淀粉样蛋白(Aβ)在大脑中沉淀形成的淀粉样蛋白斑块,Tau蛋白过度磷酸化导致的神经纤维缠结,神经元大量丢失等. 随着人口老龄化加剧,阿尔茨海默症的发病率逐年增高,给社会和家庭带来沉重负担. 大多数药物(如多奈哌齐、卡巴拉汀、加兰他敏、美金刚等)治疗仅能适度缓解症状,但不能改变疾病的进展. 考虑到一些肝损伤患者代谢酶活性的下降,以及MKD对大脑的积极作用,结合阿尔茨海默病的多种病理特点,使患者优先考虑MKD进行干预治疗. MKD可以通过各种途径有效的治疗AD:(1) MKD能够增强线粒体供能,改善糖代谢;(2) 代谢产物酮体,尤其是β-羟基丁酸可以防止β淀粉蛋白毒性对海马神经元造成损害;(3) 改善tau蛋白和β淀粉蛋白的病理状态.
谷氨酸是中枢神经系统兴奋性神经递质,谷氨酸受体的活化和Ga2+内流对神经元的形成及存活和脑发育时神经细胞的迁移及突触的形成有着至关重要的作用. 谷氨酸受体过度刺激,将导致Ga2+内流,神经细胞损伤. AMPA受体,是谷氨酸受体的一种亚型,AMPA受体介导中枢神经系统快速兴奋性突触传递,导致钙离子大量内流,从而引起神经毒性[26].此外,AMPA受体参与tau蛋白的异常磷酸化,与神经原纤维缠结的形成有关,可见,AMPA受体过度活跃促进AD的神经毒性. MKD代谢产物癸酸可抑制AMPA受体活性,从而减少神经毒性,起到治疗AD的作用. Yoshihiro Kashiwa等研究表明,β-羟基丁酸可以保护海马神经元不受β-淀粉样蛋白毒性的损害[27]. Miho Ota等在20名轻度阿尔茨海默症患者接受MKD治疗后的第12周并对AD患者进行数字符号测试和即时逻辑记忆测试发现,AD患者的症状明显改善[28]. 可见,MKD在治疗轻度AD患者非文字记忆中起到积极的作用. 此外,MKD治疗时,AD患者可通过使用酮体作为大脑的能量补充来源,减少淀粉样斑块的沉积,逆转淀粉样毒性. 越来越多的证据证明,MKD可能通过多种代谢机制治疗阿尔茨海默病如减少神经炎症、通过增强线粒体功能来加强代谢等,值得临床广泛研究.
2.4 MKD在帕金森中的应用
帕金森是老年人常见的中枢神经系统退行性疾病,其临床特征主要表现为视觉减退、顽固性便秘、睡眠障碍、情绪障碍、疼痛、疲劳、运动迟缓、静止性震颤、肌强直以及姿势步态异常等症状[29]. 中脑黑质多巴胺能神经元的变性、死亡或是缺失是其主要病理改变. 随着老龄化社会的到来,其发病率呈上升趋势. 近年来,临床实验研究发现高脂饮食可以降低帕金森患病的风险. Vanltallie 等在一项临床实验中,证明受试患者接受4周生酮饮食后,所有受试者的疲劳、步态和平衡障碍均有改善[30].
帕金森应用比较广泛的动物模型是神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP).MPTP可引起多巴胺神经元的退行病变,产生与帕金森相似的症状和病理改变. Kim Tieu等通过MPTP建立的小鼠帕金森模型,发现KD代谢产生的β -羟基丁酸能够保护神经元减少MPTP诱导下多巴胺神经元的退行性病变和改善帕金森病的运动障碍功能[31]. CHENG B等通过对小鼠MPTP模型观察发现,生酮饮食组在逆转MPTP诱导下,细胞外谷氨酸盐降低,增加纹状体的谷氨酸盐上较其它组均差异显著,这种增加可能与丘脑-皮层-纹状体通路活性增强有关[32]. Ilona Joniec-Maciejak等在MPTP诱导的小鼠PD模型中发现,补充辛酸可以增加过氧化物酶体增殖物受体γ共激活因子-1α(PGC-1α)的表达,从而显著改善纹状体多巴胺神经传递的障碍[33]. 另一项研究显示,在神经毒共性6-羟多巴胺建立的帕金森模型中,MKD能够上调黑质和纹状体区谷胱甘肽水平,增强线粒体抗氧化能力,防止线粒体DNA受氧化剂的损伤,保护多巴胺神经元抵抗6-羟多巴胺的毒性作用[34].
有关研究发现PD的进程和炎性有关,PD患者黑质密部存在大量激活的小胶质细胞. 激活的小胶质细胞能够释放多种炎性因子,如IL-1,IL-6,TNF-a、干扰素(IFN)-r,巨噬细胞集落因子,趋化因子等,这些因子可增强谷氨酸能神经元的传递,对中枢神经系统造成明显的兴奋性神经毒性作用. MKD的抗炎作用,其机制可能通过降低NF-kB表达水平,抑制白介素合成,抑制诱导型一氧化氮合成酶的(iNOS)活性及抑制谷氨酸兴奋性突触的传递等方面,对PD起到治疗的作用.
2.5 MKD在亨廷顿病中的应用
亨廷顿又称慢性进行性舞蹈症,多发生于中老年人,起病隐匿,进展缓慢. 其病理特征为,基底节区和大脑皮质变性,神经元死亡. 临床症状主要表现为舞蹈样不自主运动、精神障碍和进行性痴呆. 非药物饮食疗法-MKD,可通过以酮体作为供能物质,改善线粒体损伤,从而减缓病程的发展. HD与其他神经退行性疾病相似,与线粒体损伤和能量代谢缺陷有关[35]. Marta Balietti等研究发现MKD干预亨廷顿小鼠8周后,线粒体琥珀酸脱氢酶的活性高于对照组,说明MKD可以改善线粒体功能损伤,起到神经保护的作用[36]. 在 HD 细胞模型中发现,胰岛素和 IGF-1 激活 AKT 后能改善细胞线粒体功能,抑制细胞凋亡[37]. David N.Ruskin等在亨廷顿病转基因小鼠模型(R6/21J)中发现,生酮饮食组减缓转基因亨廷顿小鼠体重的下降,增强其运动和协调能力[38]. 综上所述,生酮饮食疗法可以改善HD模型组线粒体损伤,增强机体的能量代谢.
3 小结与展望
MKD对多种神经退行性疾病具有一定的治疗效果,可明显改善患者的临床症状,社会行为,相较药物更为安全,无毒副作用,具有广阔的发展前景. 中链甘油三酯生酮饮食与其他类型生酮饮食相比不仅产酮率高而且代谢产生的中链脂肪酸还可直接为大脑供能,更有效地降低了由于供能不足引起的脑代谢障碍. MKD改变了传统的饮食结构,脂肪酸成为主要的能量来源,因此,长期食用“生酮饮食”会引起胃肠道不适、进行性骨钙丢失,骨密度降低[39]. 在KD治疗早期,需经医嘱,客观评价患者的胃肠道功能,检查尿酸水平、电解质及微量营养素等[40]. 目前,虽然MKD的作用机制目前尚未明确,但是MKD可以通过影响神经元能量代谢,增强线粒体功能,改善抗氧化应激,抗炎等方面,增强对神经系统的保护. 神经系统疾病是多机制引起的,MKD可能从多个机制发挥作用,改善患者的生活质量. MKD的潜力巨大,有待发掘.

