甲基丙烯酸甲酯对大鼠外周神经痛行为学影响的研究
首都医科大学良乡教学医院(102401)邓介超 史宗新
首都医科大学附属北京友谊医院(100050)包利 陈浩 贾璞 唐海
经皮椎体成形术(percutaneous vertebro plasty,PVP)及在其基础上发展而来的经皮椎体后凸成形术(percutaneous kyphoplasty, PKP)是目前骨质疏松性椎体压缩骨折的首选治疗方法。目前普遍认为椎体成形术镇痛机制主要与三方面相关:①骨水泥注射进椎体后增强椎体强度,稳定了骨折。②骨水泥凝固过程中产热,椎体内神经受到热损伤后坏死。③骨水泥单体毒性导致骨内神经疼痛敏感性下降。目前尚无骨水泥单体对骨内神经疼痛敏感性影响的研究。
本实验按照目前常用的动物疼痛模型的建立方法,建立SD大鼠MMA疼痛模型。将不同浓度的MMA注射至大鼠足底皮下,在注射前和注射后不同时间点观察自发痛现象,并测定爪体积和机械痛敏的变化。用布比卡因和A-317491对MMA给药部位进行局部阻滞,以鉴别MMA对痛敏的影响是否是通过作用于外周神经发挥作用。为验证骨水泥单体毒性导致骨内神经疼痛敏感性下降而在椎体成形术镇痛机制中发挥作用的观点提供依据。
1 材料和方法
1.1 材料
1.1.1 动物来源及标准 实验动物为健康雌性SD大鼠,体重200~220g,均由军事医学科学院实验动物中心提供。
1.1.2 试剂及器械 MMA(stryker,US.),布比卡因(上海和丰制药有限公司),A-317491(Sigma,US.)。Von Frey Hair测量机械痛敏,体积测量仪(UGO BASILE,Italy)测量大鼠爪体积。
1.2 方法
1.2.1 动物饲养及分组 大鼠每笼3只,室温23℃~24℃,昼夜循环12/12h,自由摄水摄食。①生理盐水对照组、MMA浓度2μL/ml、10μL/ml、50μL/ml、200μL/ml、500μL/ml每组各6只。②利多卡因阻滞10μL/ml MMA:分为MMA给药前抑制和给药后抑制两组各6只;A-317491阻滞10μL/ml MMA:分为MMA给药前抑制和给药后抑制两组各6只。
附表1 NS对照组与不同浓度MMA对大鼠机械痛敏的影响(±s,g)

附表1 NS对照组与不同浓度MMA对大鼠机械痛敏的影响(±s,g)
组别 给药前给药后时间1h 1h 2h 3h 4h 1d 2d 3d 4d 7d 10d 12d 14d 21d NS对照组 12.1±0.8 12.6±0.5 12.3±1.0 12.3±0.9 12.2±1.1 12.4±1.2 12.8±1.3 12.6±1.2 13.0±1.0 12.2±0.8 12.3±0.7 12.5±0.7 12.8±0.8 12.5±0.9 2μl/ml 13.2±1.4 8.4±1.6 7.7±2.0 7.8±1.3 8.7±0.7 9.9±1.0 10.5±0.8 10.9±1.3 12.1±1.4 12.7±1.5 13.1±1.3 13.1±1.3 13.1±1.5 13.3±1.3 10μl/ml 12.6±0.8 6.0±3.7 3.7±2.6 3.7±2.6 4.7±3.0 5.6±2.8 6.0±2.7 5.3±1.0 5.1±1.8 6.9±2.0 8.5±0.7 8.8±0.9 10.2±1.8 12.1±1.4 50μl/ml 12.0±0.9 18.5±1.7 9.2±2.7 9.2±2.7 7.4±2.5 9.2±0.9 8.7±0.6 8.7±0.9 7.4±0.7 8.3±1.1 10.0±0.7 11.3±0.8 1.8±1.0 12.2±0.9
附表2 布比卡因和A-317491对机械痛敏的抑制和翻转效应(±s,g)
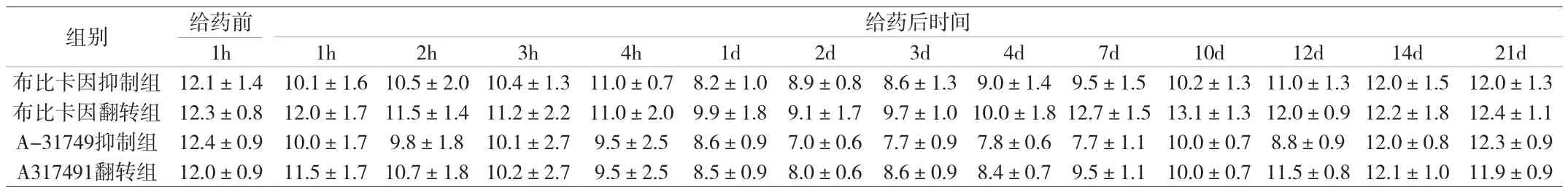
附表2 布比卡因和A-317491对机械痛敏的抑制和翻转效应(±s,g)
组别 给药前给药后时间1h 1h 2h 3h 4h 1d 2d 3d 4d 7d 10d 12d 14d 21d布比卡因抑制组 12.1±1.4 10.1±1.6 10.5±2.0 10.4±1.3 11.0±0.7 8.2±1.0 8.9±0.8 8.6±1.3 9.0±1.4 9.5±1.5 10.2±1.3 11.0±1.3 12.0±1.5 12.0±1.3布比卡因翻转组 12.3±0.8 12.0±1.7 11.5±1.4 11.2±2.2 11.0±2.0 9.9±1.8 9.1±1.7 9.7±1.0 10.0±1.8 12.7±1.5 13.1±1.3 12.0±0.9 12.2±1.8 12.4±1.1 A-31749抑制组 12.4±0.9 10.0±1.7 9.8±1.8 10.1±2.7 9.5±2.5 8.6±0.9 7.0±0.6 7.7±0.9 7.8±0.6 7.7±1.1 10.0±0.7 8.8±0.9 12.0±0.8 12.3±0.9 A317491翻转组 12.0±0.9 11.5±1.7 10.7±1.8 10.2±2.7 9.5±2.5 8.5±0.9 8.0±0.6 8.6±0.9 8.4±0.7 9.5±1.1 10.0±0.7 11.5±0.8 12.1±1.0 11.9±0.9
1.2.2 行为学观察 将30cm×30cm×30cm的透明有机玻璃箱置于50cm高的铁架上,铁架底部为铁丝网,网孔大小为0.5cm×0.5cm。实验前2天,每天将动物放入实验箱中适应2h,使之适应环境。在大鼠左侧后足底中心皮下注入不同浓度的MMA,每次注射20μL,注射后立即将大鼠放回实验箱开始计时。观察并记录1h、2h、3h、4h及1d、2d、3d、4d、7d、10d、12d、14d、20d的机械痛阈。将von-Frey纤维通过铁丝网格刺激给药侧足底中心部位,刺激强度由小到大,每个强度重复刺激3次(每次间隔3min),直至出现缩足反射,将出现缩足反射的强度作为机械痛阈值。连续测量3次取平均值。
用标记笔在大鼠左后足掌底皮肤与毛交界处作标记,作为每次浸入水中的深度的标准(液平面恰与左后足的标记线重叠),记录体积测量仪显示的数据。放下大鼠,擦干左后足,至少间隔10秒钟再进行第2次测量,测3次取平均值。
2 结果
本次实验结果中,不同浓度MMA对大鼠机械痛敏的影响详见附表1。布比卡因和A-317491对机械痛敏的抑制和翻转效应详见附表2。
2.1 给药前1h机械痛敏差异分析 所有大鼠给药前测定机械痛敏的结果:方差分析示为正态性(P=0.121>0.05),具有方差齐性,且差异无统计学意义(P=0.179>0.05)。
2.2 NS对照组机械痛敏差异分析 空白对照组给予生理盐水20μl足底皮下注射,不同时间点测得机械痛敏无统计学差异(P=0.948>0.05)。两两时间点之间比较无统计学意义(P>0.05)。表明生理盐水皮下注射不影响大鼠机械痛敏。如附图1所示。
2.3 给药后不同浓度组机械痛敏变化趋势 2μL/ml、10μL/ml两个浓度MMA均能显著减低大鼠机械痛敏。在3h时间点机械痛敏达最小值,此后机械痛阈持续减低并逐渐恢复正常,在给药后21d恢复至正常值。其中10μL/ml降低机械痛敏的效果最强。如附图2所示。
50μL/ml浓度MMA在给药后1h显著升高大鼠机械痛敏,在给药后1d开始逐渐恢复,恢复过程中出现短暂的类似2μL/ml、10μL/ml机械痛敏下降过程,在21d时机械痛敏恢复正常值。如附图3所示。
2.4 布比卡因与A-317491对机械痛敏的抑制、翻转效应 布比卡因是强效和长时效局麻药,作用时间为4~6小时。在足底皮下注射MMA前10min,足底皮下注射20μL剂量的0.2%布比卡因,拟抑制MMA的降低机械痛敏效应。结果显示,布比卡因在给药后1h显著抑制MMA降低机械痛敏的作用,并在给药后1d逐渐恢复正常趋势。如附图4所示。
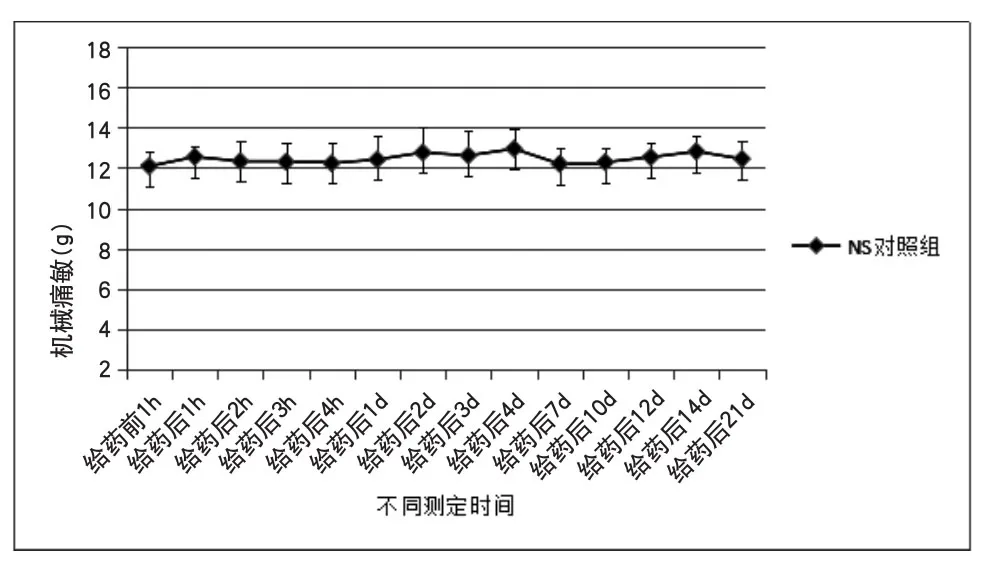
附图1 NS对照组机械痛敏的变化
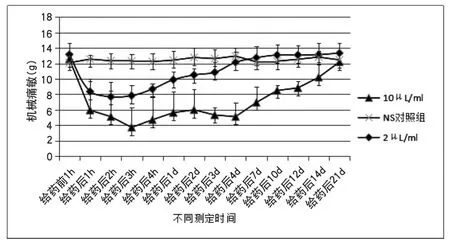
附图2 机械痛敏在2μL/ml、10μL/ml浓度MMA作用下的变化趋势
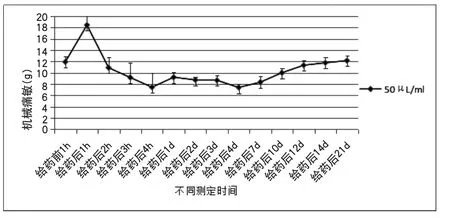
附图3 机械痛敏在50μL/ml浓度MMA作用下的变化趋势

附图4 布比卡因对机械痛敏的抑制效应
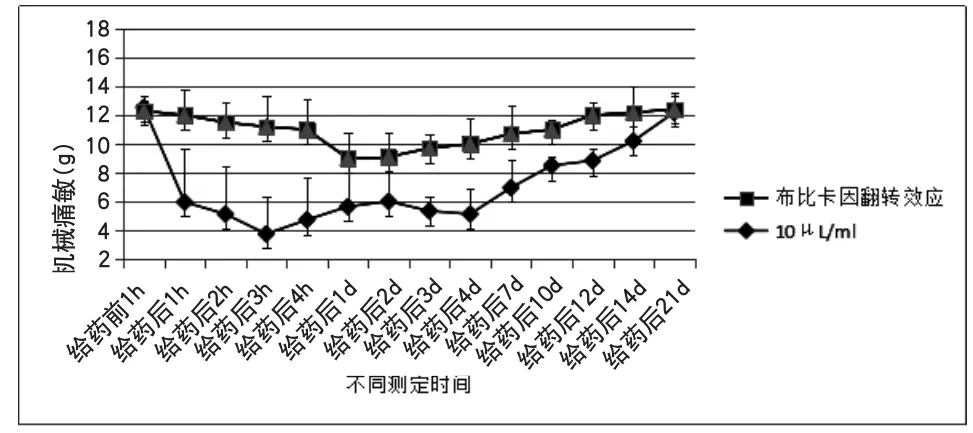
附图5 布比卡因对机械痛敏的翻转效应

附图6 A-317491对机械痛敏的抑制效应
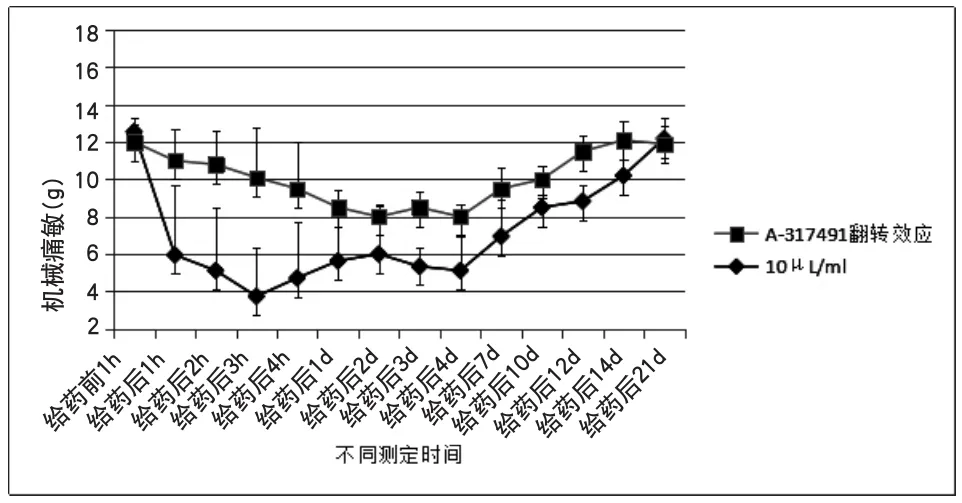
附图7 A-317491对机械痛敏的翻转效应
2.5 在足底皮下注射MMA后10min,足底皮下注射20μL剂量的0.2%布比卡因,拟翻转MMA的降低机械痛敏效应。结果显示,布比卡因在给药后1h显著抑制MMA降低机械痛敏的作用,并在给药后1d逐渐恢复正常趋势。如附图5所示。
2.6 在足底皮下注射MMA前10min,足底皮下注射20μg剂量的A-317491,拟抑制MMA的降低机械痛敏效应。结果显示,A-317491在给药后1h显著抑制MMA降低机械痛敏的作用,并在给药后7d逐渐恢复正常趋势。如附图6所示。
2.7 在足底皮下注射MMA后10min,足底皮下注射20μg 剂量的A-317491,拟翻转MMA的降低机械痛敏效应。结果显示,A-317491在给药后1h显著抑制MMA降低机械痛敏的作用,并在给药后7d逐渐恢复正常趋势。如附图7所示。
3 讨论
丙烯酸骨水泥自发明以来被逐步应用至骨科领域[1][2]。硬化后的丙烯酸骨水泥可以持续在长达几周的时间内持续释放单体[3]。椎体成形术中使用的是注射型骨水泥,单体聚合过程较普通骨水泥长,在牙膏期时注入椎体内释放大量的单体,该浓度明显超过细胞毒性的浓度[4]。
3.1 MMA诱发注射部位炎性水肿和缩足自发痛 外周感觉神经受损或组织受到炎症刺激时,常出现痛觉过敏、痛觉超敏和自发痛等反应性增强或敏感化的表现。痛觉过敏是对伤害性刺激产生过于强烈的反应;痛觉超敏是对非伤害性刺激产生伤害性反应;自发痛是在没有刺激条件下出现的自发性疼痛[5-10]。
SD大鼠足底注射20μL量200μL/ml浓度的MMA可引起注射侧足明显水肿、爪体积增大,给药后第3天水肿消退。500μL/ml浓度的MMA可诱发明显的持续1小时的自发缩足反射、舔足等自发痛表现,1小时后给予60g的von-Frey纤维不能诱发机械痛阈(即无法测量),并且第21天时仍无法测得机械痛阈。
3.2 MMA诱发镜像痛 躯体一侧组织或神经损伤后导致对侧相对应的部位出现疼痛的现象,被称为镜像痛(mirror-image pain)。躯体两侧神经系统间存在相互作用既有解剖学基础,又有生理学证据[11]。
诸多关于镜像痛敏发生机制的研究表明,镜像痛敏的发生是由中枢敏化过程所介导,而且中枢敏化一旦建立,就不再依赖外周伤害性信息传入的维持[12]。根据这一理论可以推断:①低浓度的MMA对神经产生可逆性损伤并引起原发性机械痛敏,依赖中枢敏化机制产生镜像机械痛敏。②高浓度的MMA对神经产生不可逆的损伤,在这一过程中产生长达1小时以上的单相持续性自发痛反应,但是该自发痛行为无镜像性。注射侧足明显水肿,在水肿消退前、消退后测量同侧和对侧的机械痛阈均大于60g(60g重量可将大鼠下肢抬起,即无法测得),并且在第20天仍大于60g,这样间接证明高浓度的MMA导致足底神经纤维受到不可逆损伤。
3.3 MMA对大鼠机械痛阈的影响 MMA作用于大鼠足底神经后引起机械痛阈下降,下降程度与浓度相关,浓度越大机械痛阈越低。高浓度的MMA可诱发大鼠缩足、自噬肢体等自发痛[13-16]。
3.4 MMA对大鼠痛行为的影响是通过外周神经系统发挥作用 MMA注入之前和之后给予局部布比卡因和A-317491浸润均可剂量依赖性地抑制MMA诱发大鼠机械痛行为反应[17-20]。
P2X3受体激活后引起疼痛反应,且对机械痛具有特异选择性。背根神经节是外周神经与中枢神经的信号转导中继站,其中的小细胞与痛觉传导有关,P2X3亚基高度选择性的表达于处理伤害性信息的小直径感觉神经元上[21]。
A-317491是P2X3受体选择性拮抗剂,可有效减轻大鼠的神经病理性疼痛[22]。在慢性坐骨神经压迫性模型中,A-317491可以完全阻止机械性疼痛和热痛觉过敏,并能明显减轻由弗氏佐剂和福尔马林诱发的各种痛觉过敏反应。
研究行为药理学用于研究炎性疼痛或病理性痛的模型的福尔马林模型只具有双相的自发痛表现而无热或机械痛敏发生,辣椒素、角叉菜椒模型无稳定的持续性自发痛表现[23][24]。本实验显示,高浓度MMA可引起大鼠足水肿、缩足反射和自噬等自发痛反应,低浓度MMA可引起长时程单相机械痛敏下降,而无明显的热痛敏改变。500μL/ml以上浓度可引起大鼠注射足对测量机械痛敏的刺激无反应,21d后仍不能恢复正常值。这说明,在2~50μL/ml浓度范围内MMA可逆性地引起外周神经机械痛敏下降,大于500μL/ml的MMA不可逆地损伤外周神经。
综上所述,MMA对外周感觉神经纤维的影响主要是低浓度引起机械痛敏下降,高浓度不可逆地损伤神经。