不同毒力结核分枝杆菌诱导小鼠树突状细胞凋亡差异分析
李 萍,李丛哲,吴利先
(1.河西学院医学院,甘肃张掖 734000;2.华北理工大学附属医院儿科,河北唐山 063000;3.大理大学基础医学院,云南大理 671000)
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacterium tuberculosis,Mtb)引起的传染性疾病,每年约有1 040 万新增病例,据统计至2019 年,其造成的死亡人数超过艾滋病和疟疾〔1〕。约有10%结核病发展为活动性结核,其余多处于潜伏感染状态,通过多种机制来逃避和操纵宿主的免疫应答〔2〕。Mtb逃避宿主天然免疫的机制包括胞浆逃逸、限制性抗菌肽的产生、吞噬体成熟的阻断、细胞凋亡、自噬调节等,这些方式也限制了Mtb感染过程中适应性免疫反应的发展。Mtb感染很大程度上取决于与宿主固有免疫细胞早期的相互作用,参与Mtb感染的主要免疫细胞有巨噬细胞、树突状细胞(dendritic cell,DC)等〔3〕。DC 是连接先天免疫和适应性免疫的重要桥梁细胞,在启动和调节免疫应答中发挥重要作用,参与清除Mtb。细胞凋亡是宿主抵抗病原体的重要防御机制,DC凋亡参与宿主的抗感染免疫,除了在感染早期限制Mtb的生长,在诱导获得性细胞免疫应答时,一定条件下可导致细胞死亡,有助于杀死胞内寄生Mtb〔4〕。了解在抗Mtb感染过程中DC的凋亡机制,对于控制Mtb的胞内感染具有重要意义。本实验建立了不同毒力Mtb与小鼠DC2.4混合培养模型,用流式细胞术(flow cytometry,FCM)Annexin V-FITC∕PI 双染法检测Mtb标准株H37Ra和Mtb临床分离株14-11感染DC2.4的凋亡情况,探讨不同毒力Mtb感染诱导DC2.4的细胞凋亡率。
1 材料与方法
1.1材料
1.1.1 菌株Mtb临床分离株14-11 由大理州疾病预防控制中心提供;Mtb标准株H37Ra 由大理大学基础医学院病原生物学综合实验室保存。
1.1.2 细胞株 小鼠DC2.4购自上海赛百慷生物技术股份有限公司。
1.1.3 主要试剂和仪器 RPMI Medium-1640(美国Gibco公司);胎牛血清(fetal bovine serum,FBS,兰州百灵生物技术有限公司);中性结核罗氏培养基(珠海贝索生物技术有限公司);双抗(北京Solarbio公司);磷酸盐缓冲液(phosphate buffer saline,PBS,自制);Annexin V-FITC∕PI 细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);倒置相差显微镜(日本OLYMPUS公司);流式细胞分选仪(美国BD公司)。
1.2方法
1.2.1 小鼠DC2.4的培养 将DC2.4置于37 ℃、5%CO2培养箱孵育4 h,待细胞贴壁后轻轻吸弃1∕2 培养基,补加1∕2 的RPMI-1640 完全培养基后吹打均匀,37 ℃、5%CO2培养过夜,每2~3 d 传代1 次。培养至第9 天时,收集培养皿中所有的悬浮细胞,PBS 洗 涤1~2 次,用 适 量RPMI-1640 完全培养基重悬,调整细胞浓度至终浓度为3×106个∕mL。
1.2.2Mtb的培养及菌悬液制备Mtb复苏传代,接种于罗氏固体培养基,37 ℃培养至对数生长期时(约3~4 周)刮取生长良好的H37Ra 菌落、14-11 菌落,用含有0.05%吐温-80 的无菌0.9%氯化钠溶液研磨均匀后,再用标准麦氏比浊管调整菌液浓度为3×107CFU∕mL备用。
1.2.3Mtb感染小鼠DC2.4 混合培养模型制备 将小鼠DC2.4 细胞(3.0×106个∕mL)分别接种于24 孔细胞培养板中,每孔1 mL,移至37 ℃、5%CO2培养箱孵育4 h;按照感染比10:1 每孔加入上述处理好的菌悬液3.0×107CFU∕mL,每孔1 mL;37 ℃、5%CO2细胞培养箱孵育,分别于混合培养1、3、6、12、24 h收集细胞进行检测。
1.2.4 流式细胞术检测DC2.4 凋亡率 按Annexin V-FITC 细胞凋亡检测试剂盒操作说明书操作,分别于感染后1、3、6、12、24 h 收集细胞(用不含乙二胺四乙酸的胰酶消化),1 000 r∕min 离心去上清液,PBS 洗涤2 次,各试验组样品加入100 μL Binding Buffer 重悬细胞,轻轻混匀;加入5 μL Annexin V-FITC 混匀后,再加入5 μL 碘化丙啶(PI)染色液,混匀,室温避光孵育20 min;1 000 r∕min离心10 min,弃上清液,重复洗涤1次,加入400 μL PBS重悬细胞;染色完成后1 h 内用流式细胞仪检测各组凋亡率。
1.2.5 统计学处理 应用SPSS 20.0 统计软件进行统计学分析,统计数据以(±s)表示,两组间数据比较采用方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 DC2.4形态观察倒置显微镜下观察DC2.4的形态和生长,于培养第3 天可见细胞体积增大,向四周伸展出毛刺样突起,呈树根状或多形性。小鼠DC2.4 分别与H37Ra 及14-11 混合培养1 h后,即有细菌侵入;培养3、6、12、24 h 后,倒置显微镜下可见细胞呈多形性;培养12 h 后部分细菌侵入细胞内,细胞内呈颗粒状,并出现细胞核碎裂等形态学改变。随着混合培养时间延长,此现象更加明显。见图1。

图1 倒置显微镜下细胞形态
2.2H37Ra、14-11与DC2.4混合培养凋亡率H37Ra 与14-11 均能诱导小 鼠DC2.4 凋 亡,H37Ra在感染DC2.4 1、3、6、12、24 h 后细胞凋亡率均高于14-11,差异有统计学意义(P<0.05),在混合培养1、12 h后细胞凋亡率略高于其他时间点,细胞凋亡率比较差异无统计学意义(P>0.05)。未感染Mtb的小鼠DC2.4 设为对照,对照在24 h 时细胞凋亡率较高,1、3、6、12 h 时的细胞凋亡率差异无统计学意义(P>0.05)。见表1。Mtb感染DC2.4 细胞凋亡率曲线见图2。
2.3不同毒力Mtb感染小鼠DC2.4后流式细胞术检测凋亡率采用Annexin V-FITC∕PI 标记法检测不同时间段细胞凋亡情况。见图3。使用经凋亡诱导处理的细胞,作为对照进行荧光补偿调节去除光谱重叠并设定十字门位置。左下象限(An¯,PI¯)代表正常活细胞,右下象限(An+,PI¯)代表早期凋亡细胞,左上象限(An¯,PI+)代表收集过程中的损伤细胞,右上象限(An+,PI+)代表坏死细胞和晚期凋亡细胞。右下象限(An+,PI¯)与右上象限(An+,PI+)凋亡率之和为总凋亡率。
表1 H37Ra感染、14-11感染及对照不同时间凋亡率(±s,%)

表1 H37Ra感染、14-11感染及对照不同时间凋亡率(±s,%)
注:与对照相比*P<0.05。
?
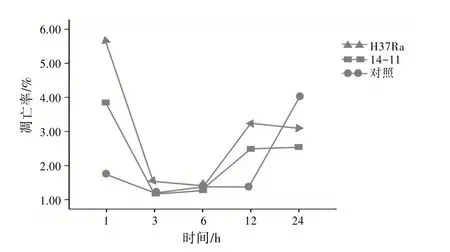
图2 不同毒力Mtb感染DC2.4不同时间凋亡率
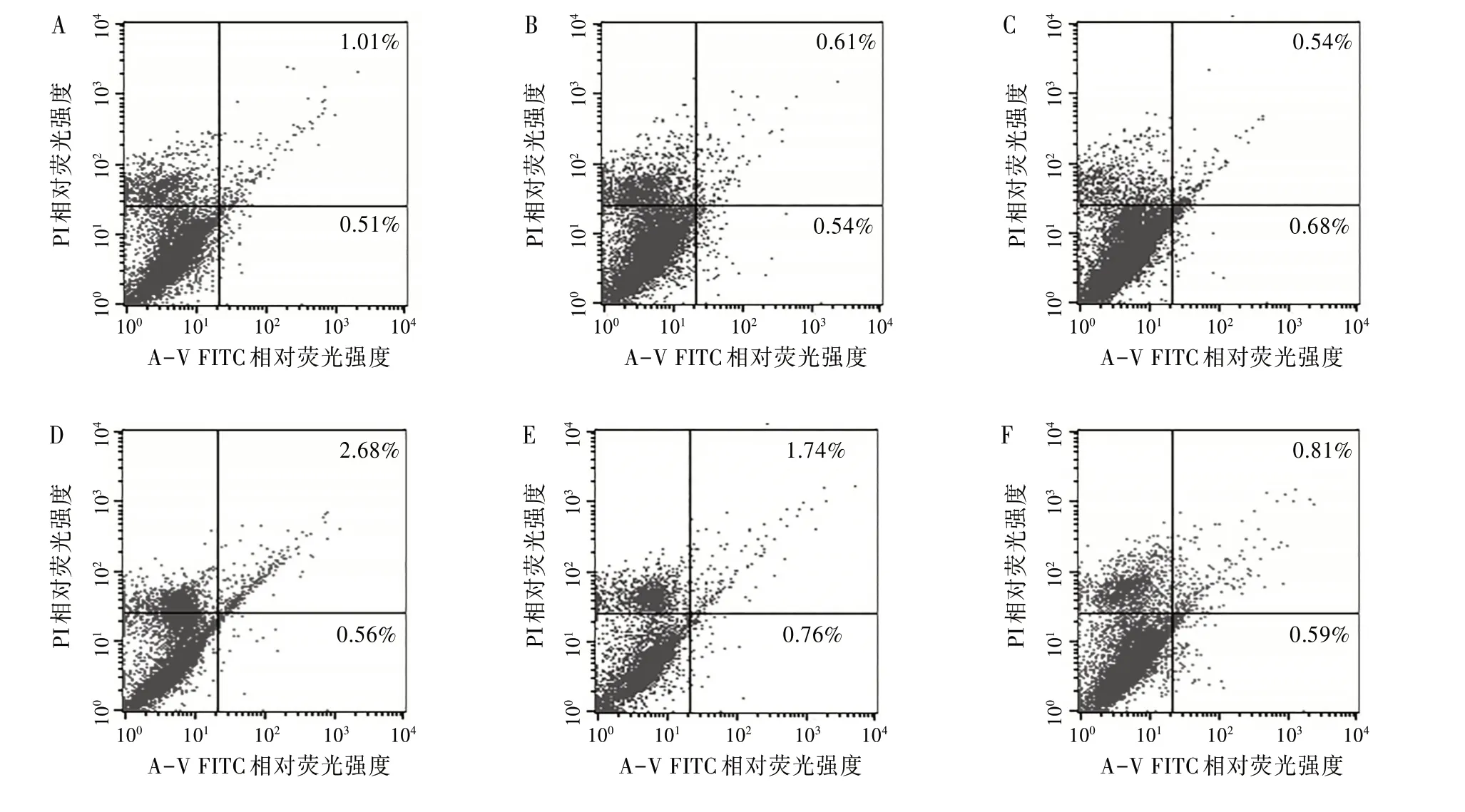
图3 流式细胞术检测Mtb感染DC2.4凋亡率
3 讨论
结核病仍然是世界范围内单一传染性病原体死亡的主要原因,是全世界所面临的难题,特别是在云南地区结核病发病率高,不同的Mtb菌株具有不同毒力及流行病学特征,为了进一步研究更好的保护策略需要确定Mtb的免疫反应机制。DC 是免疫应答中重要的免疫细胞,在递呈Mtb抗原中起着重要作用,也是连接先天免疫和适应性免疫的重要细胞。DC 表达甘露糖受体和DC 特异性非整合素,它们能够识别Mtb配体〔5〕。当Mtb入侵机体后,除调动免疫系统清除病原体外,宿主细胞还会通过细胞凋亡来抑制病原体的存活。细胞凋亡除了在感染早期限制Mtb的生长,在诱导获得性细胞免疫应答中也起着重要作用,并在一定条件下导致细胞死亡〔6〕。细胞凋亡与坏死不同,是宿主抵抗病原体的重要防御机制,涉及多种成分和复杂的信号转导途径。细胞凋亡的激活机制包括外源性途径和内源性途径。外源性途径通常由细胞外配体激活,启动细胞表面死亡受体(如肿瘤坏死因子受体和Fas 受体),形成凋亡诱导信号复合物;内源性途径被细胞内信号激活,依赖于膜间线粒体空间的蛋白质释放〔7〕。细胞内Mtb已经进化出多种有效的机制来调控宿主细胞凋亡,许多Mtb效应因子与凋亡途径有关,已报道的抗凋亡Mtb抗原包括PtpA、NuoG、PknE、SecA2、SodA、SigH、MPT64 和Rv3354 等〔8〕。Mtb已知的促凋亡抗原包括LpqH(19kda 脂蛋白)、PE_PGRS33、ESAT-6、OppD、PstS1、Rv0183、Rv0901、PE9∕PE10 和Mce4A〔9〕。Mtb感 染 机 体 后,通 过ManLAM 激 活AKt∕蛋 白 激 酶B∕BCL-2 通路抑制细胞凋亡,促进细胞坏死,利于Mtb的扩散〔10〕。细胞凋亡的阻断和坏死的诱导可能是Mtb逃避或延迟抗原递呈的主要策略之一。凋亡细胞的吞噬作用,其中一个重要的因素是通过DC 交叉递呈抗原,凋亡细胞将抗原呈递给DC 以增强获得性免疫,细胞凋亡控制了细菌的繁殖,降低了细菌在细胞中的生存能力〔11〕。研究发现,Mtb感染巨噬细胞后,通过DC 导致CD8+T淋巴细胞活化促使吞噬凋亡囊泡释放〔12〕。Ramos-Martinez 等〔13〕研究表明,DC 的凋亡与Mtb的毒力有关,Mtb菌株的毒力强弱可导致人类DC 的不同免疫反应,毒性较低的Mtb菌株可以诱导DC和巨噬细胞凋亡,并以此方式成为其他抗原提呈细胞获取和促进有效适应性免疫应答的方式。Lee 等〔14〕研究表明Mtb感染机体后主要导致细胞坏死,包括H37Ra 和BCG 减毒株在内主要诱导细胞发生凋亡,从而控制结核感染及扩散;然而Mtb强毒株如H37Rv 可抑制细胞凋亡并诱导细胞坏死,引起结核扩散。Behar等〔15〕研究表明,毒力较弱的Mtb感染机体后,TLRs 激活丝裂原活化蛋白激酶,诱导肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)等促炎因子的产生,P19 可能是弱毒株Mtb的凋亡诱导因子,可以通过TLR-2发出信号并激活caspase-8,从而导致细胞凋亡,然而这一机制依赖时间和剂量。Danelishvili 等〔16〕研究表明,强毒株Mtb分泌的一些蛋白质,如NADH-1、Rv3654c 和Rv3655c 抑制巨噬细胞凋亡,它们通过调节一氧化氮和促炎细胞因子的产生来改变与TLRs 的关系。强毒株H37Rv 抑制凋亡还可能是由于诱导ESX-1 分泌EspJ 相关蛋白磷酸化,因此推测EspJ是Mtb的毒力因子〔17〕,H37Rv还可增加microRNA-132 的表达,从而阻止人单核细胞来源的DC中促炎细胞因子的分泌〔18〕。
已有研究显示,细胞凋亡在机体免疫系统抵抗Mtb的免疫应答及免疫耐受中发挥重要作用。本实验发现不同毒力的Mtb菌株作用于小鼠DC2.4可诱导产生不同的凋亡结果,毒力较强的Mtb可抑制DC凋亡,以逃避先天免疫和延迟适应性免疫的启动;相比之下,毒力较弱的Mtb更易诱导DC 凋亡,减少细菌活力。细胞凋亡是Mtb采取的一种重要的免疫逃避策略,在凋亡过程中,Mtb与宿主细胞之间的相互作用可以被用来研究更好的预防结核病的措施。尽管目前对凋亡信号通路如何被广泛用作Mtb效应器增强细胞内生存和发病机制的靶点有所认识,但如不同的Mtb效应蛋白在体内宿主防御Mtb感染过程中如何协调和调节细胞凋亡等重要问题仍有待解决。

