Mn-BTC衍生锰酸锂的制备及其放电性能研究
任敬霞,牛永强,张妍妍,侯 华,赵宇宏
(中北大学 材料科学与工程学院,高温锂电池材料实验室,山西 太原 030051)
0 引 言
高温锂电池(工作温度为100~300 ℃)是热电池(工作温度为350~600 ℃)技术的拓展与延伸[1],旨在解决石油、天然气和地热勘探设备的高温供能问题.经过多年发展,高温锂电池负极材料和电解质的选择已逐渐趋于成熟,其中负极材料多采用锂合金,性能接近纯净金属锂,电解质采用低熔点碱金属硝酸盐共熔盐[2],而寻求与之相匹配的正极材料是提高高温锂电池电压、比容量和高温稳定性的有效途径.
传统热电池常用的二硫化物(如FeS2、CoS2)正极材料与碱金属硝酸盐在高温下会发生剧烈的化学放热反应,影响电池安全性[3],不适用于高温锂电池.可溶性金属硝酸盐[4-6]和氯化物虽然与硝酸盐电解质相容性较好,但因其在电解质中过大的溶解度而易发生自放电反应,会导致电池性能衰退.目前过渡族金属氧化物正极材料[7-10]由于相容性较好、电位高及热稳定性好而成为研究热点.为了获得更稳定的电压和更大比容量,科研人员还尝试用各种方法对其进行改性,如锂化[10]、原子掺杂[9,11-12]等.
金属有机框架化合物(Metal Organic Frameworks, MOFs)由于化学组成多样、孔洞丰富和比表面积大等优点,其自身及衍生物已广泛应用于储能领域.Liao等人[13]利用钒金属有机框架材料(MIL-101(V))作为反应钒源和碳源,通过高温固相法合成了层状结构碳包覆Li3V2(PO4)3材料,该材料作为锂离子电池正极材料在0.5 C和1 C的电流密度下循环1 000圈之后,仍能保留113.1 mAh·g-1和105.8 mAh·g-1的可逆容量.Ji等人[14]采用原位自组装方法制备3DGN/Mn-BTC复合材料,再通过煅烧制备3DGN/Mn2O3自支撑柔性多级孔材料并将其用作超级电容器电极材料,表现出较好的电化学性能.电流密度为0.2 A·g-1时3DGN/Mn2O3材料比容量可达471.05 F·g-1,1 A·g-1时循环1 800圈后比容量几乎没有衰减,5 A·g-1时比容量仍能达270 F·g-1.因此,本文将MOFs拓展至高温锂电池正极材料,制备一种Mn-BTC衍生LiMn2O4.
1 实 验
1.1 Mn-BTC前驱体的制备
使用室温自组装配位法合成Mn-BTC前驱体[15].室温下称取0.98 g Mn(CH3COO)2·4H2O(安耐吉,99%)和2 g 聚乙烯吡咯烷酮(PVP K-30)(安耐吉,AR)溶于20 mL去离子水(自制)和20 mL乙醇(凯通,≥99.7%)的混合溶剂中,得到溶液A;称取1.681 g H3BTC(安耐吉,98%)溶于20 mL 去离子水和20 mL乙醇的混合溶剂中,得到溶液B.将溶液B缓慢滴加到溶液A中,磁力搅拌30 s后,静置24 h,得到白色沉淀.用乙醇洗涤3次后将所得沉淀在60 ℃烘箱中干燥12 h,得到Mn-BTC前驱体,即Mn3(BTC)2(H2O)6.分别改变原料Mn(CH3COO)2·4H2O和H3BTC的摩尔比和PVP用量进行多组实验,具体实验条件如表 1 所示.

表 1 Mn-BTC前驱体的实验条件
1.2 Mn-BTC衍生LiMn2O4的制备
按摩尔比Li∶Mn=1∶2准确称取Mn-BTC前驱体和LiOH·H2O(麦克林,98%).首先将称量好的前驱体置于马弗炉中,在空气气氛下以10 ℃·min-1的升温速率升温至450 ℃,再在此温度下焙烧2 h后随炉冷却至室温;随后将焙烧产物、LiOH·H2O和适量的乙醇混合研磨并干燥;将均匀混合后的样品转移至坩埚中,使用高温固相反应法将其置于马弗炉中以5 ℃/min 的升温速率升温至450 ℃焙烧5 h,再升温至650 ℃焙烧5 h,最后随炉冷却至室温,得到LiMn2O4.
1.3 材料分析与表征
使用SmartLab SE X射线多晶衍射仪对材料进行晶体结构分析,使用MERLIN Compact热场发射扫描电子显微镜(FE-SEM)和JEM-2100F场发射透射电子显微镜(TEM)观察材料的形貌特征,采用ASAP 2020比表面积及孔隙吸附仪得到材料的比表面积和孔径信息,采用STA 409C同步热分析仪测试正极材料的热稳定性及相容性.
1.4 电池组装
负极片由Li-Mg-B(58 wt% Li-4 wt% Mg-38 wt% B)合金箔片直接冲裁为直径16 mm的圆片,厚度为0.4 mm.电解质采用目前研究较为成熟的二元硝酸盐电解质体系,其具体组成成分为33.2 wt% LiNO3,66.8 wt% KNO3[16].将焙烧、研磨过筛后的65 wt %共熔盐与35 wt% MgO粉末通过球磨混合均匀,在300 ℃下保温16 h,冷却后研磨过100目筛,得到单电池所用电解质材料.其中的MgO作为抑制剂来控制电解质在高温下的流动.正极材料由70 wt%正极活性物质、20 wt% 二元硝酸盐和10 wt%导电剂均匀混合后研磨过筛制得.
采用一次压制成型制得15.5 mm正极-电解质双层片,该双层片中正极材料为0.1 g,电解质材料为0.2 g.然后将负极片和双层片叠加(电解质层处于中间并分别与正负极接触)组装成“三明治”夹层结构,并在两侧加入焊接有镍条的304不锈钢集流片.使用夹具将组装好的单电池固定,然后置于箱式实验电炉中进行放电测试.上述操作均在充满氩气的手套箱中进行,其水和氧含量均小于0.1×10-6.
1.5 恒流放电测试
使用新威CT-4008测试系统对单电池进行测试,记录一定温度和放电电流下电池电压随时间的变化,并绘制电压-比容量图谱对正极材料进行分析.温度设定为200 ℃,放电电流密度分别设定为10 mA·cm-2和30 mA·cm-2,放电截止电压为0.5 V.
2 结果与讨论
2.1 Mn-BTC前驱体的制备及其影响因素
实验以Mn-BTC为前驱体制备LiMn2O4,所以Mn-BTC前驱体是后续实验的基础.为制备得到晶型良好,形貌均匀的理想目标产物,选择不同的原料比例和PVP用量进行单因素试验.
2.1.1 不同PVP用量对材料结构和形貌的影响
不同PVP用量合成的Mn-BTC的XRD衍射图谱见图 1,扫描电镜和透射电镜照片见图 2.

图 1 不同PVP用量合成的Mn-BTC前驱体的XRD衍射图谱

图 2 Mn-BTC(M1, M5)的扫描电镜照片和的透射电镜照片
观察图 1 中M1和M5特征衍射峰的位置、形状和强度,并与文献[17]相对比,发现二者基本吻合,说明采用室温自组装法成功得到了Mn3(BTC)2(H2O)6,即以锰离子为中心,均苯三甲酸为有机配体的网络骨架结构材料.此外,PVP用量不同时XRD图谱无明显变化,说明PVP量不影响反应进行.
通过对比图 2(a)M5和图 2(b)M1的SEM照片,可以看出两组实验均合成了花状微球Mn-BTC前驱体,但当PVP用量为6 g时微球十分紧密地结合在一起,而PVP用量为2 g时团聚现象明显得到改善,微球之间有明显缝隙,均匀分散在空间内.
PTV是一种常用的分散剂,它由N-乙烯吡咯烷酮聚合而成,形成其链和吡咯烷酮上的亚甲基是非极性基团,有亲油性;分子中的内酰胺是极性基团,具有亲水基和极性基团.由于PVP的加入,吡咯烷酮环基将微球包裹,减少其在溶液内的融合碰撞,但过量后,会发生多数环基“争夺”微球的现象,导致其在环基内结合成大颗粒,很容易粘结.
Mn-BTC前驱体在放大倍数下的形貌基本相同,此处以M1为例进行说明.图 2(b),(c),(d)和图 2(e),(f)分别是M1的SEM和TEM照片.由图可知,Mn-BTC前驱体的形貌比较均一,为直径 2~6 μm左右的花状微球,且表面粗糙不平.而这些微球均由数个表面光滑、大小相近的纳米多面体颗粒聚集组成,单个纳米粒的直径约为 200 nm.
2.1.2 不同原料比例对材料结构和形貌的影响
不同原料比例合成的Mn-BTC的XRD衍射图谱如图 3 所示.M1~M4所有样品主要特征峰的峰位、峰型和峰强均与文献[17]报道的Mn-BTC前驱体很好地对应,峰形尖锐,且没有任何杂质峰,可以断定所制备样品是Mn3(BTC)2(H2O)6.此外,当原料比例不同时,产物的XRD衍射峰基本相同,说明原料比例对材料晶体结构的影响不大.

图 3 不同原料比例合成的Mn-BTC前驱体的XRD衍射图谱
图 4(a)~(d)分别为前驱体M1,M2,M3和M4(原料比例分别为1.5∶3,1.5∶2,1.5∶1和2∶1)的SEM照片.通过观察可以看出,采用不同的原料比例均合成了花状微球Mn-BTC前驱体,而且随着有机配体H3BTC的增加,微球形状越来越规整,粒度分布也更均匀.当原料比例为1.5∶3时没有明显的聚集现象.这是因为Mn-BTC前驱体的成核和生长受到配体加入量的影响,而且足够量的H3BTC可以成功避免其二次成核.H3BTC是一个典型的刚性配体,其与锰离子之间具有强的配位能力.当H3BTC溶液滴加入Mn(CH3COO)2·4H2O溶液时,Mn2+和BTC3-之间会迅速螯合配位成键,导致溶液中游离的Mn2+减少,低浓度的Mn2+使得溶液过饱和度较低,从而成核较慢并且形成的晶核数较少.随着晶核的形成和生长,游离的Mn2+越来越少,两种离子间的平衡被打破,配离子发生解离反应从而释放出Mn2+,并用于晶核的继续生长.所以,当BTC3-的浓度足够大时,游离的Mn2+浓度就会处于一个较低的水平,从而避免二次成核的发生.

图 4 Mn-BTC(M1,M2,M3,M4)的扫描电镜照片
综上所述,当Mn(CH3COO)2·4H2O和H3BTC分别为0.98 g和1.681 g,PVP用量为2 g 时合成的Mn-BTC前驱体形貌最好,分散均匀,故后续实验均以此条件合成.
2.2 Mn-BTC衍生LiMn2O4的结构表征
图 5(a)是LiMn2O4的XRD衍射图谱,通过比对标准卡片,发现谱图中的主要特征峰与尖晶石锰酸锂(PDF#35-0782)的(111),(311),(222),(400),(331),(511),(400),(531),(533),(622)晶格面一一对应,都是Fd-3m空间结构.并且在谱图中未观察到其他杂峰,表明以Mn-BTC为前驱体成功合成了纯度较高的LiMn2O4.

图 5 Mn-BTC衍生LiMn2O4的XRD衍射图谱和扫描电镜照片
通过SEM照片观察LiMn2O4的形貌.从图 5(b)和(c)中可以看出,LiMn2O4基本保持了Mn-BTC前驱体的花状微球外形,且其表面出现了更多的孔洞,变得更加粗糙.从图5(c)中观察到纳米多面体颗粒的尺寸有所减小(直径约为100 nm),这与其他MOFs文献中的现象一样[18].这可能是因为在高温焙烧过程中Mn-BTC前驱体骨架坍塌,有机配体分解从而放出了大量的CO2和H2O等小分子气体.以上结果表明,通过焙烧、锂化处理Mn-BTC前驱体可以得到具有特定形貌和尺寸的锰酸锂.

图 6 Mn-BTC衍生LiMn2O4的氮气吸附-脱附等温线图和孔径分布图
图 6 是LiMn2O4花状微球在77 K时测试的吸附-脱附曲线和孔径分布图.由图可观察到等温线中出现了回滞环,同时结合孔径分布图可以得知该材料中存在着大量的介孔和大孔,平均孔径为21.551 6 nm,孔径多集中在25~70 nm范围内.采用BET方法计算,得到该样品的比表面积为6.873 2 m2·g-1.因此,Mn-BTC衍生的LiMn2O4为具有多级孔结构的微球,有利于提高离子和电子的传导率.
为评估所制备材料是否适用于高温锂电池,对其在整个工作温度范围内与LiNO3-KNO3硝酸盐电解质、石墨的相容性进行测试.从图 7 DSC曲线可知,在135.4 ℃处出现一个吸热峰,这主要是由于LiNO3-KNO3共晶电解质的熔化引起的.这与Guidotti[19]所报道124.5 ℃ 的电解质熔点有些差异,是由于所测试的样品不是纯LiNO3-KNO3而导致[20-21].此外,DSC曲线在430 ℃ 附近出现了第2个吸热峰,结合TG曲线可得,在高于400 ℃时开始出现明显的质量损失,这是因为LiNO3-KNO3电解质发生了热分解.而在室温~300 ℃范围内几乎没有发生失重,这表明该正极材料具有良好的热稳定性,可以满足在150~300 ℃温度下工作的要求.
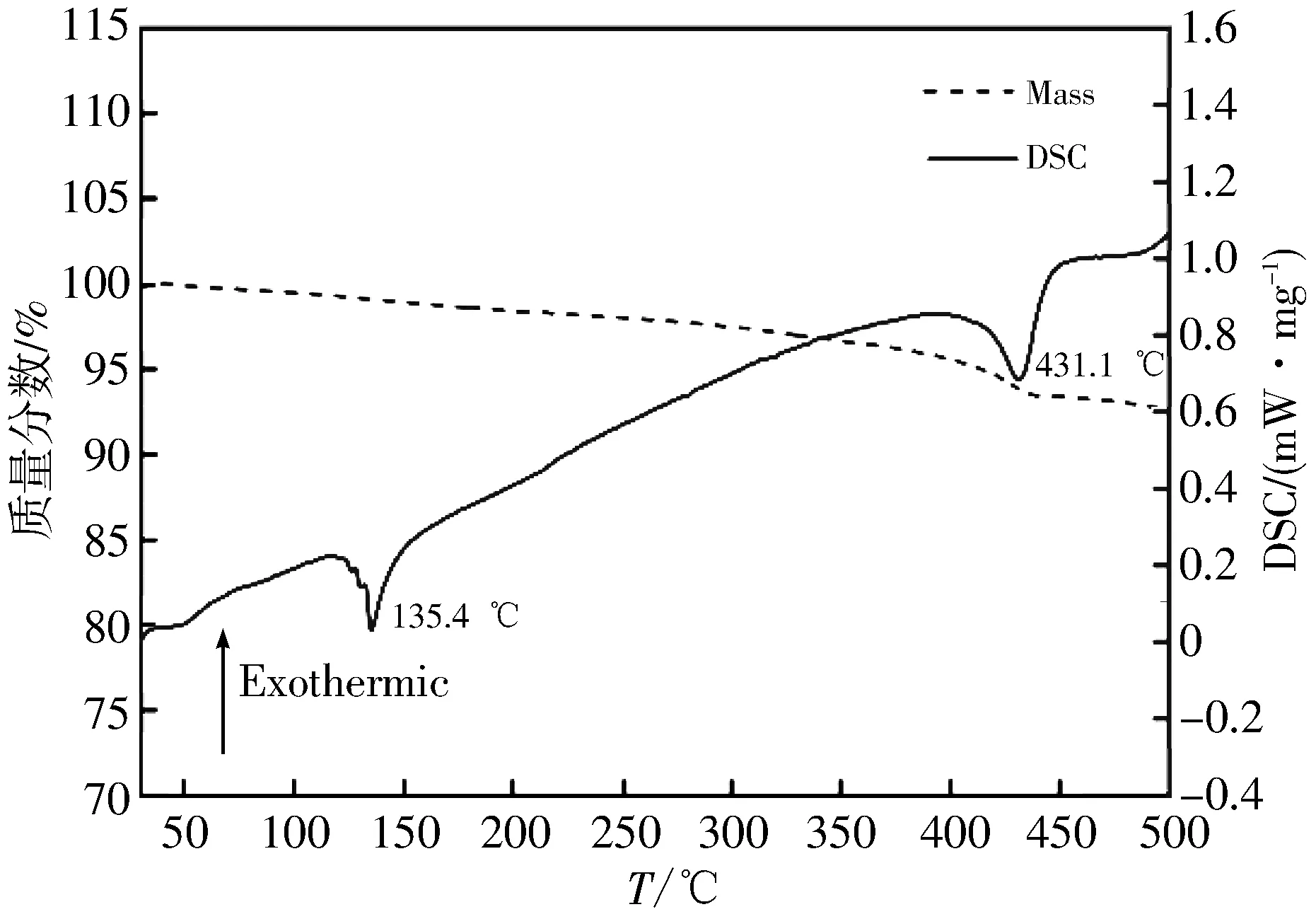
图 7 Mn-BTC衍生LiMn2O4与LiNO3-KNO3硝酸盐电解质和石墨之间的DSC和TG测试曲线
此外,负极材料与电解质的相容性也是电池安全的重要表征之一.Niu等[16]人已经证明了Li-Mg-B负极与LiNO3-KNO3电解质之间的良好热稳定性.
综上所述,该电池系统足以在200 ℃下进行放电性能测试.
2.3 Mn-BTC衍生LiMn2O4材料的高温放电性能
为了研究LiMn2O4材料在高温锂电池中的性能表现,对Li-Mg-B/LiNO3-KNO3/LiMn2O4电池系统在200 ℃下分别以不同的电流密度进行放电,放电曲线如图 8 所示.当电流密度为10 mA·cm-2和30 mA·cm-2时,电池的开路电压分别为2.89 V和3.19 V,LiMn2O4正极材料的比容量分别是 258.89 mA·h·g-1和167.12 mA·h·g-1.上述结果表明该电池在小电流或大电流下均有不错的放电性能.另一方面,在小电流密度下,Li-Mg-B/LiMn2O4电池的电压平台更稳定.这是因为电流密度的增加会导致电池极化的加剧,即加剧了电池内部的电荷分布不均匀,而材料的离子、电子电导率达不到电池快速放电的要求,所以电池在小电流密度下放电时整体性能更好.

图 8 Li-Mg-B/Mn-BTC衍生LiMn2O4电池在200 ℃下以不同电流密度放电的放电曲线
3 结 论
采用室温自组装配位法合成了Mn-BTC前驱体,并研究了原料的摩尔比和PVP的用量对产物的影响.结果表明,二者对Mn-BTC前驱体的形貌都有很大影响,当Mn(CH3COO)2·4H2O和H3BTC分别为0.98 g和1.681 g,PVP的用量为2 g时可以得到大小均一、分散均匀的花状微球.
以Mn-BTC为前驱体,通过焙烧、锂化处理制备了Mn-BTC衍生LiMn2O4.综合XRD、SEM和BET测试结果可知,本文实验中成功制备了多孔的花状微球LiMn2O4,其较好地保持了前驱体的基本形貌,并且拥有介孔和大孔的多级孔结构.DSC测试结果表明,Mn-BTC衍生LiMn2O4正极材料在室温至300 ℃ 内有良好的相容性,适用于LiNO3-KNO3电解质体系.Li-Mg-B/LiNO3-KNO3/LiMn2O4电池系统在200 ℃下分别以10 mA·cm-2,30 mA·cm-2的电流密度进行放电,放电比容量可以达到258.89 mA·h·g-1和167.12 mA·h·g-1.

