苦杏仁苷脂质体的制备及特性研究
刘瑞霞,潘 丽,丁冬有
1.郑州师范学院 生命科学学院,河南 郑州 450044 2.河南工业大学 粮油食品学院,河南 郑州 450001 3.郑州企鹅粮油机械有限公司,河南 郑州 450001
苦杏仁苷又名维生素B17,是传统中药苦杏仁、桃仁和枇杷等的有效成分,具有止咳定喘、退热和止渴的功效[1-2],同时具有抗肝细胞纤维化、调节免疫功能、抗炎及抗肿瘤等生物功能[3-6]。然而,苦杏仁苷极性大、亲水性强以及油水分配系数小,存在跨膜吸收障碍[7],极大限制了其在食品、保健品以及药品领域的应用。
脂质体是指由脂质分子构成,具有与生物膜类似的双分子层结构的囊泡[8-9]。磷脂分子是构成脂质体的膜材,属于非离子型表面活性剂,结构中含有一个亲水性的头基和两个疏水性的尾基[10]。基于脂质体的结构,其作为运输载体最显著的优势是具有既亲水又亲油的性质,不但能包埋脂溶性物质,还可以包埋水溶性物质[11]。作为最具应用潜力的载体之一,脂质体可有效促进水溶性功能因子的吸收,提高生物利用率,并且改善靶向性和缓释效果[12-15]。作者利用逆向蒸发法将苦杏仁苷包埋到脂质体中,制备苦杏仁苷脂质体,确定最优的制备工艺条件,并考察其物化性质、储藏稳定性和体外释放特性,以提高苦杏仁苷的脂溶性、稳定性、生物利用率以及缓释效果,拓宽苦杏仁苷的应用范围,并为进一步开发新型输送载体提供理论依据和新思路。
1 材料与方法
1.1 材料与试剂
苦杏仁苷(纯度98%):陕西信瑞生物科技有限公司;大豆卵磷脂(磷脂酰胆碱含量大于98%):沈阳天峰生物制药有限公司;胆固醇(纯度>95%):阿拉丁试剂(上海)有限公司;磷酸二氢钠、盐酸:洛阳昊华化学试剂有限公司;磷酸氢二钠:西陇化工股份有限公司;乙醚:洛阳市化学试剂厂;硫代巴比妥酸:广东省化学试剂工程技术研究中心;三氯乙酸:天津市凯通化学试剂有限公司。
1.2 仪器与设备
HN-50超声波材料乳化分散器:上海汗诺仪器有限公司;RE-52 A型旋转蒸发仪:上海亚荣生化仪器厂;Zetasizer Nano-ZS型纳米粒度分析仪:英国马尔文仪器有限公司;2695-2998高效液相色谱仪:美国Waters公司;超滤离心管:美国Millipore公司(MWCO为10 kDa);HT7700型透射电子显微镜:日本日立高新技术公司。
1.3 方法
1.3.1 高效液相色谱法测定苦杏仁苷含量
1.3.1.1 色谱条件
色谱柱:Agilent 5 TC-C18(2)(150 mm×4.6 mm×5 μm);流动相:V(甲醇)∶V(水)=3∶7;流速:1 mL/min;检测波长:215 nm;进样量:10 μL;柱温:30 ℃。
1.3.1.2 苦杏仁苷标准曲线的绘制
称取一定量的苦杏仁苷标准品,用流动相做溶剂,定容于100 mL容量瓶中,配制苦杏仁苷标准溶液。分别量取0、0.5、1.5、2.5、3.5、4.5 mL苦杏仁苷标准溶液,定容于5 mL容量瓶中,摇匀、静置。利用高效液相色谱法测定苦杏仁苷的含量,以苦杏仁苷浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到标准曲线方程:y=8 355 194.141 5x+13 855.178,R2=0.999 8。
1.3.2 苦杏仁苷脂质体的制备
取一定量的大豆磷脂酰胆碱和胆固醇,用一定体积的乙醚溶解,另取一定量的苦杏仁苷用磷酸盐缓冲液(PBS)充分溶解,并将苦杏仁苷溶液倒入大豆磷脂酰胆碱与胆固醇混合溶液中,利用超声波乳化分散器超声5 min(1 s开,1 s停),得到的乳液置于100 mL圆底烧瓶中旋转蒸发30 min左右,除去有机溶剂,加入5 mL含一定量吐温-80的PBS进行水合,制备得到的苦杏仁苷脂质体在4 ℃下储存。
1.3.3 苦杏仁苷脂质体包封率的测定
移取一定量的苦杏仁苷脂质体溶液于超滤离心管中,16 000 r/min 下冷冻高速离心30 min,吸取400 μL滤液备用。同时吸取 400 μL未经超滤的苦杏仁苷脂质体,加入800 μL甲醇中并超声5 min进行破乳。滤液和破乳样品用甲醇稀释至相同倍数,利用0.22 μm滤膜过滤后进行高效液相色谱检测,分别得到脂质体中游离苦杏仁苷和总苦杏仁苷的质量。苦杏仁苷脂质体的包封率计算公式如下:
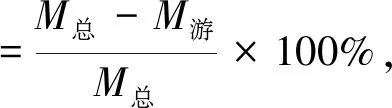
式中:M总为破乳后脂质体中苦杏仁苷的总质量(mg);M游为游离苦杏仁苷的质量(mg)。
1.3.4 苦杏仁苷脂质体粒径及分布和zeta电位的测定
利用粒度分析仪测定脂质体的粒径及分布和zeta电位,测定温度为25 ℃,准确移取400 μL样品,用蒸馏水稀释200倍,每一个样品测量3次,取平均值。
1.3.5 苦杏仁苷脂质体的微观形貌
1 mL样品用PBS(pH 7.4)稀释2倍,吸取少许溶液滴到附有碳膜的铜网上,10 min后用滤纸吸去剩余的液体,然后滴上磷钨酸(2%)进行染色,大约5 min后用滤纸吸去多余的染色液,室温下无尘风干后用透射电子显微镜进行观察。
1.3.6 苦杏仁苷脂质体膜氧化性的测定
取30 g三氯乙酸和0.75 g硫代巴比妥酸(TBA)加入200 mL盐酸溶液(0.25 mol/L),微热溶解作为TBA溶液。称取0.2 g丁基对苯二酚,用蒸馏水定容至250 mL容量瓶中待用。取5 mL TBA溶液和1 mL脂质体溶液混合于10 mL试管中,加入1 mL的丁基对苯二酚溶液(为防止脂质过氧化产物与TBA加热时分解成可与TBA反应的物质),沸水浴30 min,迅速取出在自来水中冷却,然后5 000 r/min下离心10 min,取上清液在532 nm处测定吸光值。
1.3.7 苦杏仁苷脂质体储藏稳定性的研究
将制备好的苦杏仁苷脂质体等质量分装在带有螺旋盖的棕色样品瓶中,分别于4 ℃、25 ℃条件下,避光、充氮气保存25 d,每5 d测定其粒径及分布、保留率以及脂质体膜氧化性的变化,按下式计算保留率。
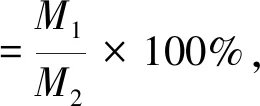
式中:M1为储藏一段时间后脂质体包埋苦杏仁苷的质量(mg);M2为脂质体初始包埋苦杏仁苷的质量(mg)。
1.3.8 苦杏仁苷脂质体体外释放特性的研究
以PBS (pH 7.4)作为释放介质,考察苦杏仁苷脂质体的释放特性。10 mL 苦杏仁苷脂质体或苦杏仁苷溶液加入分子质量为10 kDa透析袋中,然后将密封的透析袋浸没在50 mL 的释放介质中(温度为 37 ℃±0.5 ℃,搅拌速度为 100 r/min),在预先设定的时间 (0.5、1、2、4、6、8、10、12、24 h)分别取1 mL透析袋外样品,并补充等量预热到37 ℃的新鲜缓冲溶液,通过上述方法测定苦杏仁苷的质量,每个样品平行测定3次,苦杏仁苷累积释放率按下式计算:
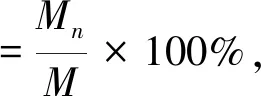
式中:Mn为某一时刻n释放的苦杏仁苷质量(mg);M为总苦杏仁苷的质量(mg)。
1.4 数据统计与分析
每个试验平行测定3次,结果取平均值。采用Origin 8.0软件作图,SPSS 23.0软件进行方差分析, Duncan 法(P<0.05)进行差异显著性分析。
2 结果与分析
2.1 单因素试验
pH值、磷脂与胆固醇质量比、有机相与水相体积比、苦杏仁苷与磷脂质量比对包封率的影响见图1。
2.1.1 PBS的pH值对脂质体包封率的影响
固定其他因素,分别以PBS的pH值为6.2、6.6、7.0、7.4、7.8制备苦杏仁苷脂质体,研究pH值对包封率的影响。由图1a可知,pH值从6.2增加到6.6时,包封率从16.78%增加到27.82%。另外,当pH值继续增大到7.8时,包封率降低。这可能是由于磷脂的水解常数与环境的pH值密切相关,在强酸或者强碱环境中,磷脂的水解常数增加,水解速率增大,从而影响脂质体的包封率。pH值接近中性时,磷脂的水解速率降低,利于脂质体体系的稳定。因此,pH值为6.6时脂质膜的渗漏率最低,包封率最大,达到27.82%。
2.1.2 磷脂与胆固醇质量比对脂质体包封率的影响
固定其他因素,分别以磷脂与胆固醇的质量比(脂胆比)为2∶1、3∶1、4∶1、5∶1和6∶1制备苦杏仁苷脂质体,研究脂胆比对包封率的影响。由图1b可知,随着脂胆比的增大,包封率先增大后减小,当脂胆比为4∶1时,包封率最大,达到23.96%。胆固醇可以嵌入到脂质双分子层膜中,通过对膜流动性的调节提高脂质体的稳定性。当胆固醇浓度较低时,脂质双分子层膜致密度小,流动性大,包埋的芯材容易渗漏;然而,胆固醇浓度过高时,嵌入磷脂双分子层膜的胆固醇量增加,导致空间较小,膜刚性增大,故包封率降低[16]。
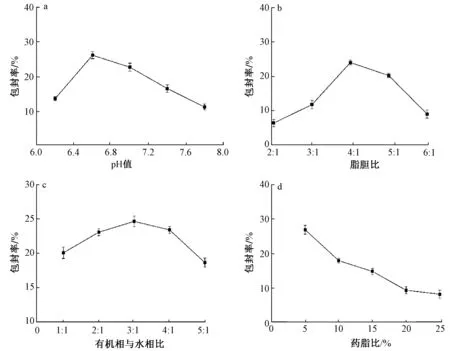
注:a、b、c、d分别为pH值、脂胆比、有机相与水相比、药脂比对包封率的影响。图1 单因素对脂质体包封率的影响Fig.1 Effect of single factor on encapsulation efficiency
2.1.3 有机相与水相体积比对脂质体包封率的影响
固定其他因素,分别以有机相与水相体积比(有机相与水相比)为1∶1、2∶1、3∶1、4∶1和5∶1制备苦杏仁苷脂质体,研究有机相与水相比对包封率的影响。由图1c可知,随着有机相与水相比的增大,包封率先增大后减小,当有机相与水相比为3∶1时,包封率最大,达到24.65%。这可能是因为有机相的量过小时,不能完全将磷脂等膜材全部溶解,导致包封率不高;而当大量的有机相存在时,会对脂质体的膜结构造成一定的破坏,包封率降低。
2.1.4 苦杏仁苷与磷脂质量比对脂质体包封率的影响
固定其他因素,分别以苦杏仁苷与磷脂质量比(药脂比)为5%、10%、15%、20%和25%制备苦杏仁苷脂质体,考察药脂比对包封率的影响。由图1d可知,药脂比为5%时,苦杏仁苷脂质体的包封率最大,达到28.51%。随着药脂比的增加,包封率逐渐减小。当药脂比大于20%时,包封率基本不再变化。这说明脂质体囊泡空间是有限的,对芯材的包埋具有饱和性。随着芯材加入量的增大,包封率会减小,当芯材总量超过磷脂双分子层膜的饱和值后,包封率将不再变化。
2.2 正交试验
根据单因素试验,选择药脂比为5%,通过正交试验考察脂胆比、有机相与水相比及PBS的pH值3个因素对脂质体包封率的影响,以确定制备苦杏仁苷脂质体的最佳工艺条件,结果见表1。
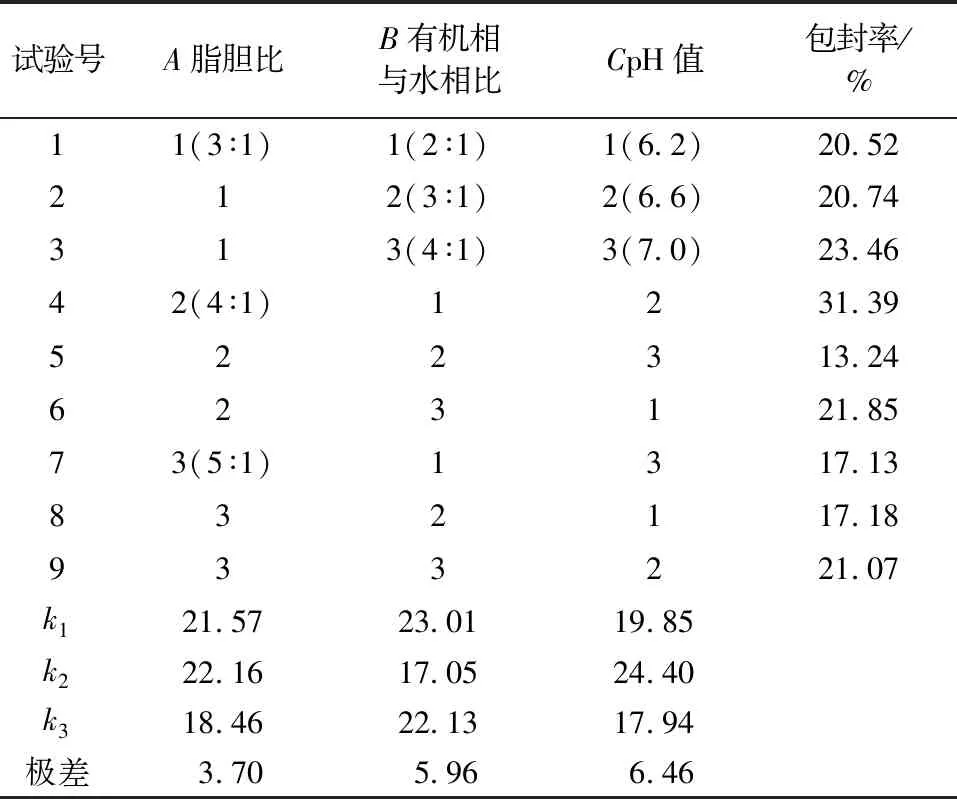
表1 正交试验设计及结果Table 1 Orthogonal test design and results
由表1可知,各因素对包封率的影响主次顺序:pH值>有机相与水相比>脂胆比,最佳工艺条件为A2B1C2,即脂胆比为4∶1,有机相与水相比为2∶1,pH值为6.6。
采用优化后的工艺条件进行验证试验,平行制备3个样品,平均包封率为(33.42±1.76)%,优于正交试验中的任何一个组合,因此确定最优制备工艺条件:脂胆比4∶1,有机相与水相比2∶1,pH值6.6,药脂比5%。
2.3 苦杏仁苷脂质体物化性质的研究
制备的苦杏仁苷脂质体在最优工艺条件下的包封率为(33.42±1.76)%,平均粒径为(189.7±1.3) nm,多相分散指数(polyphase dispersion index,PDI)为0.16±0.02,粒径分布如图2所示,苦杏仁苷脂质体粒径分布相对较窄,表现为均一的分散。这可能归因于超声处理的强器械作用有效减小了苦杏仁苷脂质体的粒径,同时使得苦杏仁苷脂质体囊泡具有更好的分散性。苦杏仁苷脂质体的zeta电位为(-31.2±2.41) mV,表明构建的脂质体具有足够的表面电荷抑制粒子间的聚集。这可能由于苦杏仁苷分子的极性羟基与磷脂极性头基的胆碱相互作用,产生的偶极子取向增加了脂质体的表面负电荷[17]。
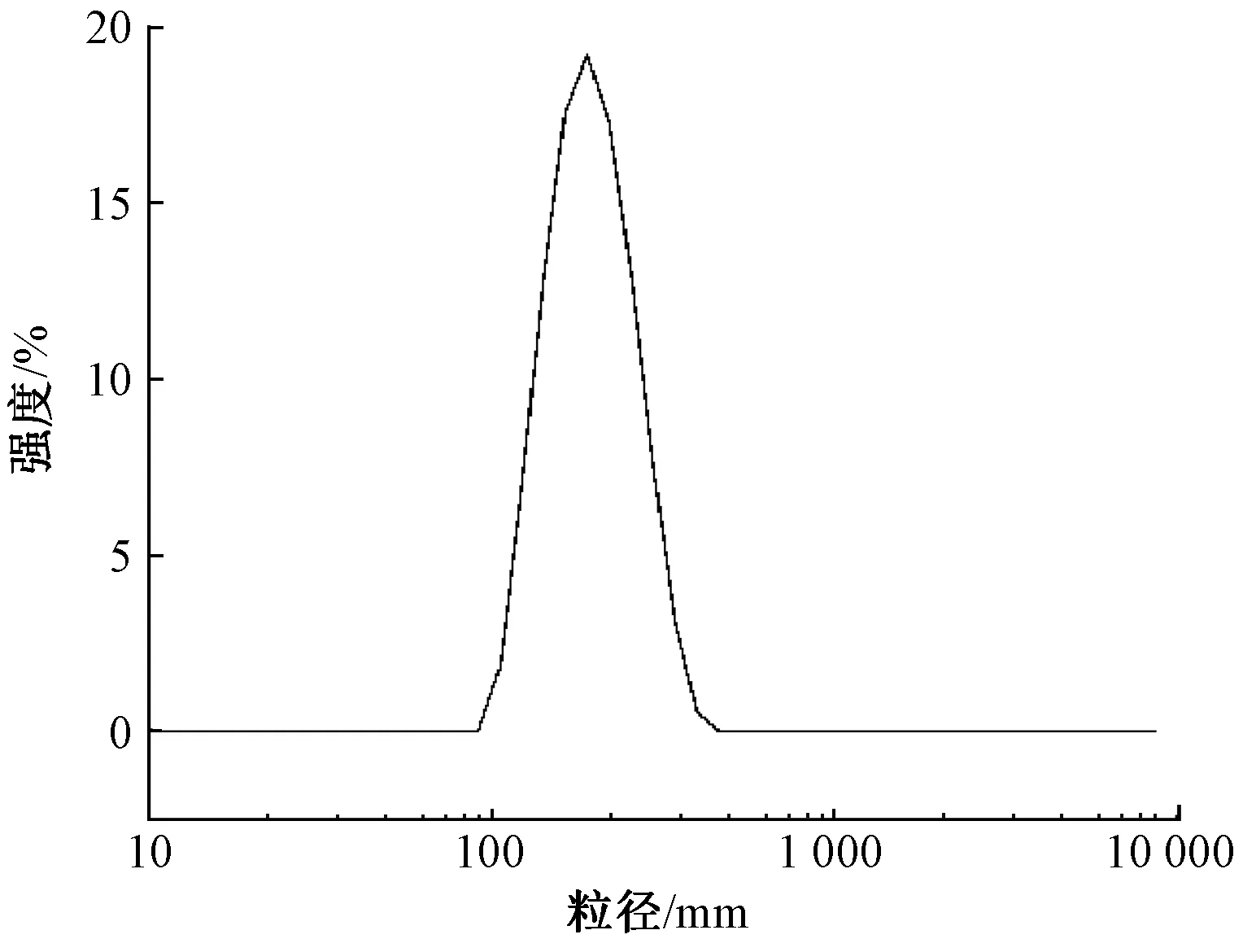
图2 苦杏仁苷脂质体粒径分布Fig.2 Particle size distribution of amygdalin-loaded liposomes

图3 苦杏仁苷脂质体透射电子显微镜图Fig.3 Transmission electron micrograph of amygdalin-loaded liposomes
采用透射电子显微镜观察苦杏仁苷脂质体微观形貌,结果见图3,苦杏仁苷脂质体囊泡外观形貌呈较规则球状,分散性好,粒径大约为190 nm,与粒度分析仪测定结果是一致的。
2.4 苦杏仁苷脂质体储藏稳定性的研究
苦杏仁苷脂质体分别在4 ℃、25 ℃条件下避光、充氮气储藏,研究储藏过程中脂质体的粒径大小及分布、保留率、膜氧化性的变化,结果见图4。
由图4a可知,不同储藏条件下脂质体的粒径均随着储藏时间的延长不同程度地增大,4 ℃储藏25 d后脂质体的粒径只有较小的变化,而25 ℃储藏25 d后脂质体的粒径增加到669 nm。由图4b可知,4 ℃和25 ℃储藏条件下苦杏仁苷脂质体的多相分散指数均随着储藏时间的延长而增大,同时可以看出脂质体的多相分散指数在4 ℃储藏25 d后只增加了1倍,而25 ℃条件下快速增加了近3倍。相比25 ℃,4℃条件下储藏的脂质体表现出更小的多相分散指数。
保留率直接反映了脂质体中芯材的有效含量随储藏时间的变化,是评价脂质体对包埋的芯材保护能力的重要指标之一。从图4c可以看出,不同储藏条件下脂质体中的苦杏仁苷的保留率均随着储藏时间的延长而减小。在4 ℃和25 ℃条件下储藏25 d后脂质体的保留率分别下降至73.01% 和50.22%。由此可见,脂质体具有较强的保护包埋苦杏仁苷的能力,并且4 ℃比25 ℃条件下储藏保留能力更强。这是由于储藏温度的升高促进磷脂的水解,而磷脂的水解和氧化作用会改变脂质体的结构,从而导致包埋的苦杏仁苷渗漏。
脂质在储藏过程中会氧化生成丙二醛,然后与硫代巴比妥酸发生成色反应,测定丙二醛相对含量的变化,可间接了解脂质体氧化的程度。脂质体被氧化程度越大,丙二醛含量越高,颜色越深,利用紫外分光光度仪在532 nm处测定的吸光度越大[18]。由图4d可知,4 ℃条件下储藏的苦杏仁苷脂质体吸光度在储藏期内变化不大,而25 ℃条件下吸光度呈上升趋势。说明苦杏仁苷脂质体低温下保持较好的氧化稳定性,而储藏温度较高会加速磷脂氧化,吸光度升高。
2.5 苦杏仁苷脂质体体外释放特性的研究
以苦杏仁苷溶液作为对照,PBS为释放介质,考察苦杏仁苷脂质体的体外释放特性,结果见图5。前2 h内苦杏仁苷溶液快速释放,释放率超过65%,12 h时的释放率达到90%以上。与苦杏仁苷溶液相比,脂质体包埋能够显著地减小苦杏仁苷的释放速率,前2 h苦杏仁苷的释放率仅为5.94%,12 h内脂质体包埋的苦杏仁苷释放率小于22%,后期进入一个缓慢释放的过程,24 h苦杏仁苷释放率也仅为23.55%。由此可见,苦杏仁苷脂质体表现出持续的释放特性,原因可能是很大一部分的苦杏仁苷被包裹在脂质体的水相里,构成脂质体的磷脂双分子层的阻碍,抑制了苦杏仁苷从磷脂双分子层爆发性地释放出来,使得苦杏仁苷缓慢释放。同时,脂质体不同的缓释性是由于不同的包封率与膜结构所致。因此,脂质体的包封率和膜结构都是影响其缓释效果的重要因素[19]。
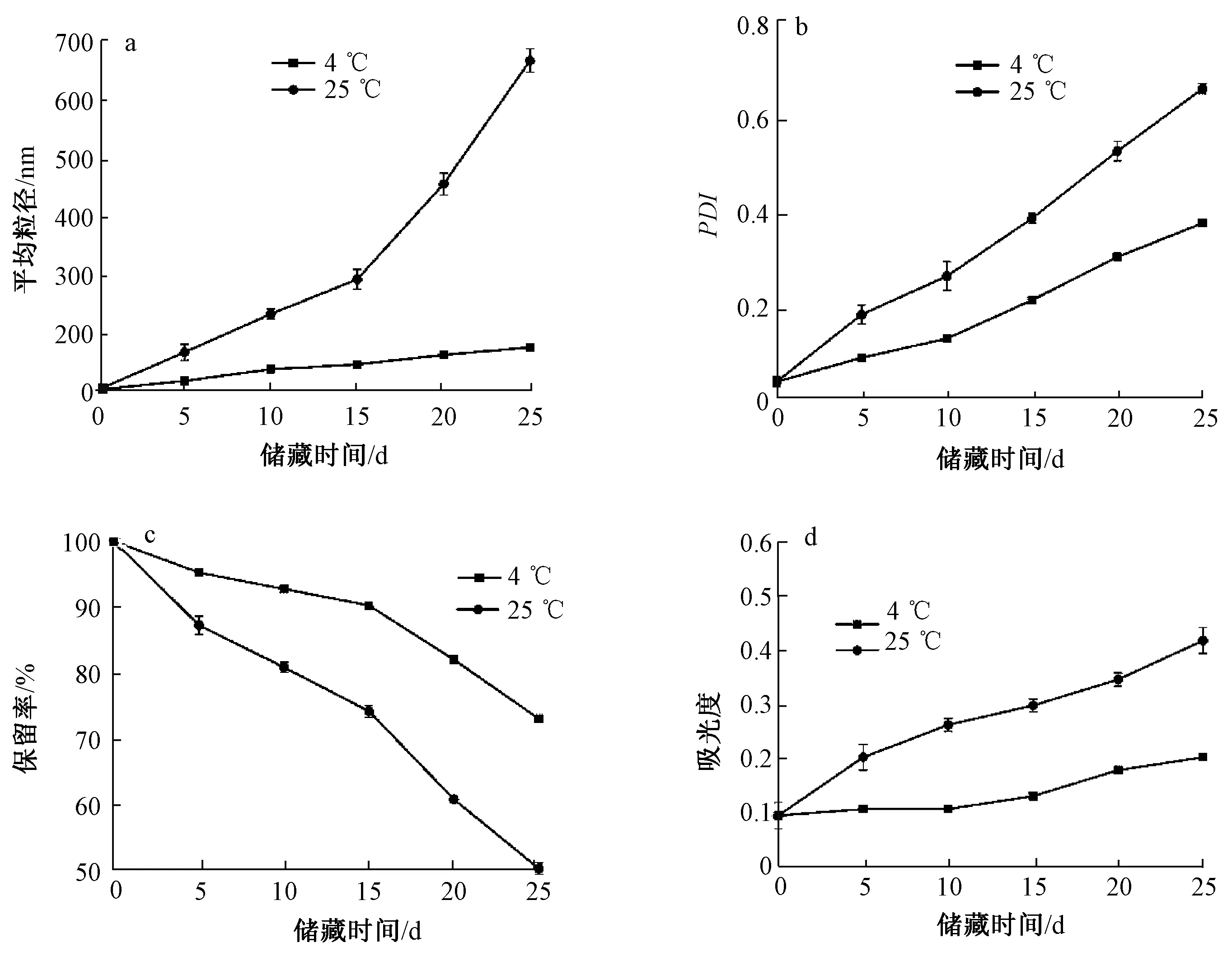
注:a、b、c、d分别为粒径、PDI、保留率和膜氧化性的变化。图4 4 ℃和25 ℃条件下储藏苦杏仁苷脂质体粒径、多相分散指数、保留率和膜氧化性的变化Fig.4 Changes of particle size, PDI, retention rate, and membrane oxidability of amygdalin-loaded liposomes stored at 4 ℃ and 25 ℃
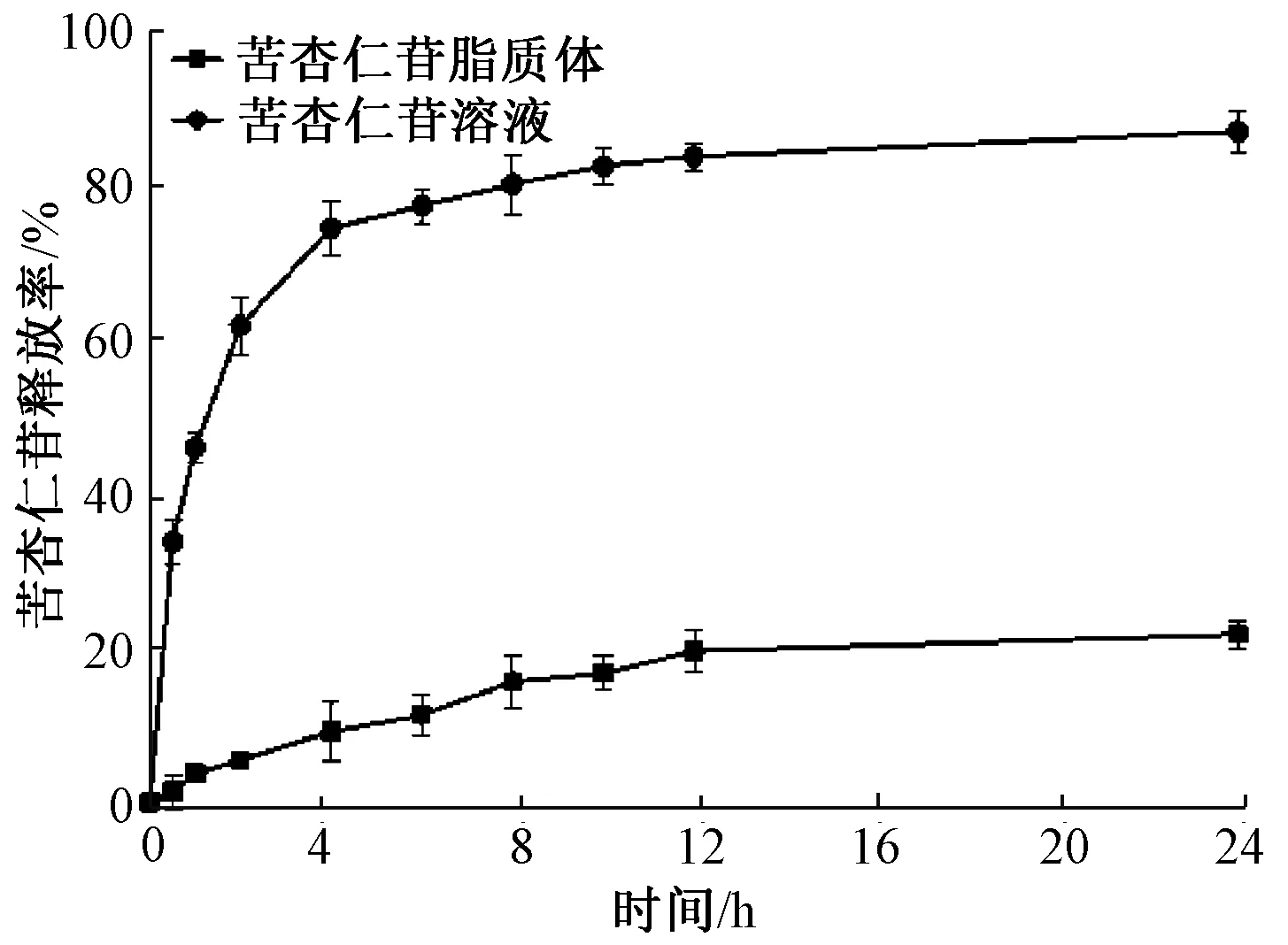
图5 苦杏仁苷脂质体和苦杏仁苷溶液在释放介质中的体外释放曲线Fig.5 In vitro release profiles of amygdalin-loaded liposomes and amygdalin solution in release media
3 结论
利用逆向蒸发法制备苦杏仁苷脂质体,通过单因素试验,考察PBS的pH值、脂胆比、有机相与水相比及药脂比对脂质体包封率的影响,然后进行正交试验。确定最优制备工艺条件:脂胆比4∶1,有机相与水相比2∶1,PBS的pH值6.6,药脂比5%。在此条件下,得出包封率为(33.42±1.76)%。通过动态光散射法测定,苦杏仁苷脂质体平均粒径为(189.7±1.3) nm,多相分散指数为0.16±0.02,zeta电位为(-31.20±2.41) mV。通过透射电子显微镜观察苦杏仁苷脂质体的微观形貌,苦杏仁苷脂质体囊泡呈规则的球体,分布均匀。研究了苦杏仁苷脂质体在储藏期的粒径大小及分布、保留率、膜氧化程度的变化,结果表明温度影响较大,苦杏仁苷脂质体具有较好的储藏稳定性。另外,体外释放试验结果表明,脂质体包埋可有效降低苦杏仁苷的释放速率,具有良好的缓释性。本研究制备了高效和稳定的苦杏仁苷脂质体,拓宽了苦杏仁苷的应用范围,并为进一步开发苦杏仁苷新剂型提供理论指导。

