肝细胞癌组织中程序性死亡受体1和T淋巴细胞免疫球蛋白黏蛋白3的表达及意义
周 舸, 谢丽平, 林涛发, 卢友光, 王少扬
蚌埠医学院福总教学医院(解放军联勤保障部队第九〇〇医院) 感染科, 福州 350025
原发性肝癌是全球第六大常见的恶性肿瘤,也是第四大癌症相关死亡原因[1]。肝细胞癌(HCC)是原发性肝癌中最常见的病理组织类型(85%~90%)[2]。大部分HCC患者在诊断时已属晚期,生存预后差,随着HCC药物开发的停滞,HCC免疫治疗, 特别是免疫检查点抑制剂的临床试验效果及临床应用有望成为不能手术切除或不适合局部治疗患者的一线治疗方案[3]。
免疫系统对肿瘤的作用是一个交织复杂的过程,它在杀伤肿瘤细胞的同时,也通过其他机制促使肿瘤细胞的免疫逃逸[4]。失调的免疫系统[包括免疫细胞在功能和(或)数量上的改变,细胞因子水平以及抑制性受体或其配体表达的改变]促成了HCC的发生发展[5]。有研究[6-7]显示,程序性死亡蛋白1(programmed death-1,PD-1)主要表达于T、B淋巴细胞上,其与配体PD-L1参与形成了肿瘤微环境,可抑制T淋巴细胞的活性和减少细胞因子产生,从而促使肿瘤细胞逃避机体免疫系统的监视和杀伤。T淋巴细胞免疫球蛋白黏蛋白3(T lymphocyte immunoglobulin mucin molecule 3,TIM-3)最初在活化的辅助性T淋巴细胞(Th)1表面发现[8],随后在树突状细胞(DC)、单核细胞、巨噬细胞[8-9]和自然杀伤细胞(NK细胞)[10]等天然免疫细胞表面均发现有TIM-3的表达,TIM-3在这些先天性免疫细胞上的表达上调导致了临床疾病恶化[10-13]。本研究分析HCC组织中PD-1和TIM-3阳性表达与患者临床病理参数和预后的关系,旨在探讨PD-1、TIM-3在HCC发生、发展中的作用。
1 资料与方法
1.1 临床资料 选择性收集2013年1月-2015年12月于中国人民解放军联勤保障部队第九〇〇医院接受手术治疗的HCC患者的癌组织及癌旁组织(距肿瘤组织切缘>1 cm)石蜡标本。纳入标准:(1)符合原发性肝癌临床诊断,术后病理证实为HCC;(2)手术初治患者,术前未接受过放化疗或其他任何治疗;(3)术后生存期≥3个月;(4)临床病理资料和随访资料完整。排除标准:(1)合并严重心、脑、肺、肾等基础疾病;(2)合并严重感染性疾病;(3)合并自身免疫性疾病;(4)合并其他肿瘤;(5)接受肝移植治疗。
1.2 随访资料 从术后开始随访,在门诊及住院记录中收集所有患者的随访信息,配合电话随访,随访日期截至2019年6月30日,共随访1~78个月,直至患者死亡或随访截止。统计患者无病生存期(disease free survival,DFS)、总生存期(overall survival,OS),计算1、3及5年存活率。
1.3 PD-1、TIM-3表达的检测 应用免疫组化检测HCC组织及癌旁组织中PD-1、TIM-3的表达情况。所有标本常规石蜡包埋,4 μm厚连续切片;切片60 ℃烤箱过夜后,依次放入二甲苯Ⅰ、Ⅱ、Ⅲ中各5 min脱蜡,梯度酒精(100%→90%→80%→70%)水化;使用EDTA法修复抗原;画圈标注,PBS洗涤3次,3%H2O2浸泡10 min后PBS洗涤3次,滴加山羊血清封闭10 min;滴加一抗(PD-1、TIM-3的最佳稀释浓度分别为1∶50、1∶500)37 ℃孵育1 h;PBS洗涤3次,滴加反应增强液(20 min)后滴加二抗室温孵育30 min;PBS洗涤3次,DAB显色5 min,自来水终止显色,苏木素复染;酒精盐酸溶液分化5 s,自来水中冲洗20 min蓝化;无水酒精脱水,中性树脂封片。随机选取5个200倍视野,每个视野均进行染色强度计分与阳性百分比计分,根据阳性细胞所占比例和染色强度综合判断PD-1、TIM-3阳性表达。染色强度以多数细胞呈现的染色特性(染色深浅需与背景着色相对比)计分:无着色0分,淡黄色1分,棕黄色2分,棕褐色3分;阳性细胞百分比即某类细胞5个视野的阳性细胞平均数:0~5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;两项评分乘积0分为阴性(-)、1~4分为弱阳性(+)、5~8分为中度阳性(++)、9~12分为强阳性(+++)。所有切片结果均由两名病理科医师独立双盲下完成结果判读。分析二者表达水平与患者临床病理参数的关系。
1.4 伦理学审查 本研究经中国人民解放军联勤保障部队第九〇〇医院伦理委员会审核(批号:2018-019),患者或家属均知情同意。
1.5 统计学方法 采用SPSS 21.0软件进行统计学分析,配对等级资料的比较采用Wilcoxon检验,等级资料的相关性分析采用Spearman法,采用Kaplan-Meier法进行生存分析,log-rank检验比较组间生存率差异,采用Cox回归分析模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 共收集HCC患者46例,HBsAg均为阳性;其中男39例,女7例;年龄26~71岁,平均(48.50±13.42)岁,其中<50岁者22例,≥50岁者24例;肿瘤直径<5 cm者23例,≥5 cm者23例;肿瘤单发病灶39例,多发病灶7例;有门静脉癌栓者18例,无门静脉癌栓者28例;病理分化程度:高分化5例,中分化30例,低分化11例;TNM分期:Ⅰ期25例,Ⅱ期16例,Ⅲ期5例;临床分期:Ⅰ期38例,Ⅱ期8例。所有患者的OS为5~78个月,1、3及5年总生存率分别为89.1%、56.5%和34.4%,平均OS(45.36±3.87)个月;所有患者的DFS为0~78个月,1、3及5年无病生存率分别为52.2%、21.7%和10.9%,平均DFS为(23.41±3.52)个月。其中30例(65.22%)死亡,其OS为5~56个月,平均OS为40.69个月;41例(89.13%)复发或转移,其DFS为0~54个月,平均DFS为21.78个月。
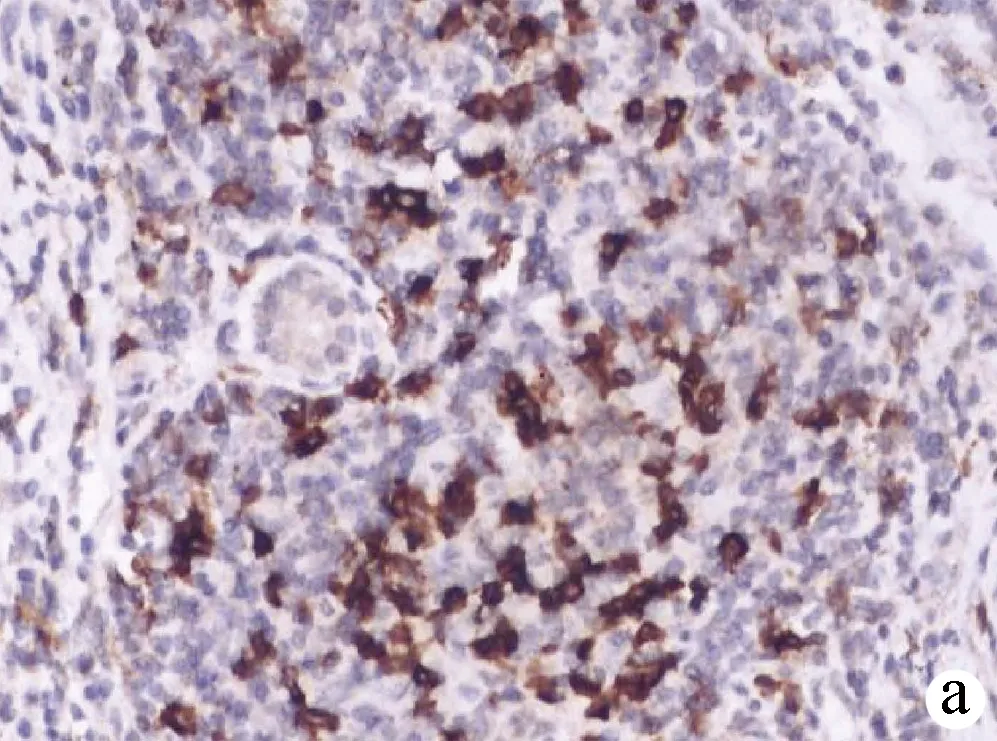
2.2 PD-1和TIM-3在HCC组织及癌旁组织中的表达情况 PD-1阳性表达主要定位于淋巴细胞的细胞膜或细胞质,呈浅黄色至棕褐色颗粒状(图1、2);TIM-3阳性表达主要定位于肝窦内Kupffer细胞的细胞膜或细胞间质,呈浅黄色至棕褐色(图3、4)。HCC组织中PD-1阴性、弱阳性、中度阳性、强阳性表达率分别为26.09%(12/46)、26.09%(12/46)、41.30%(19/46)、6.52%(3/46),癌旁组织中PD-Ⅰ阴性、弱阳性、中度阳性、强阳性表达率分别为60.87%(28/46)、34.78%(16/46)、4.35%(2/46)、0(0/46),二者比较差异有统计学意义(Z=-4.612,P<0.01);HCC组织中TIM-3阴性、弱阳性、中度阳性、强阳性表达率分别为8.70%(4/46)、39.13%(18/46)、39.13%(18/46)、13.04%(6/46),癌旁组织中TIM-3阴性、弱阳性、中度阳性、强阳性表达率分别为15.22%(7/46)、60.87%(28/46)、21.74%(10/46)、2.17%(1/46),二者比较差异有统计学意义(Z=-3.203,P<0.01)。HCC组织中PD-1和TIM-3的表达水平具有相关性(rs=0.397,P=0.006)。
2.3 HCC组织PD-1、TIM-3表达与患者临床病理参数的关系 HCC组织中PD-1表达强弱与肿瘤大小、门静脉癌栓和TNM分期有关(P值均<0.05);与患者性别、年龄、肿瘤数目、病理分化程度和临床分期无关(P值均>0.05)。 HCC组织中TIM-3的表达强弱与门静脉癌栓、病理分化程度和TNM分期有关(P值均<0.05);与患者性别、年龄、肿瘤直径、肿瘤数目和临床分期无关(P值均>0.05)(表1)。
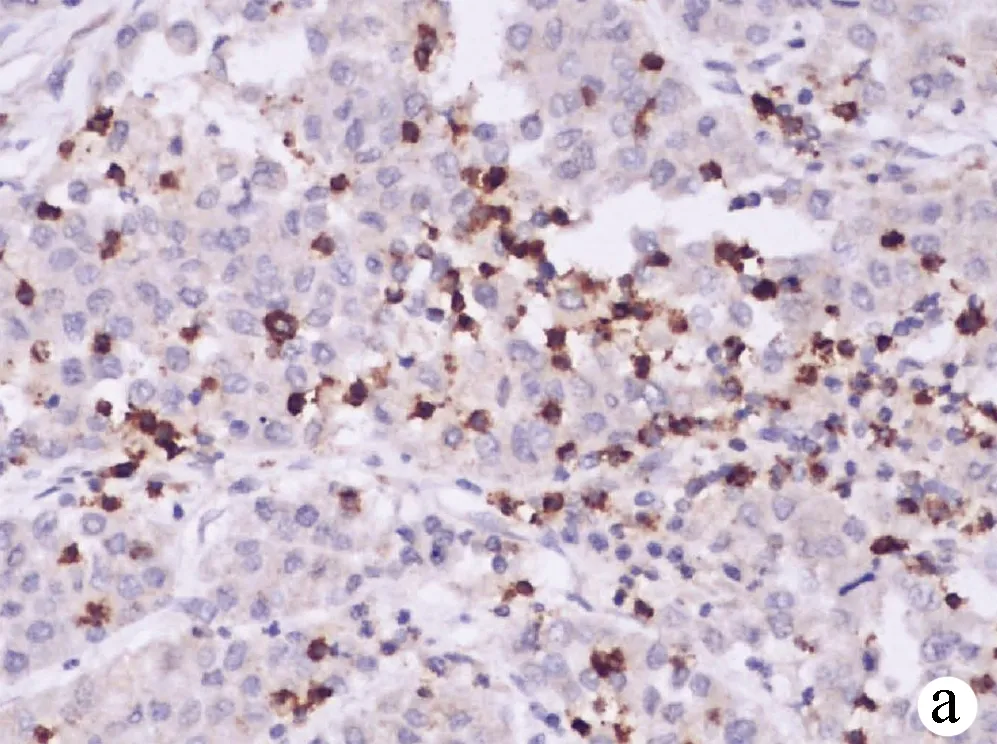
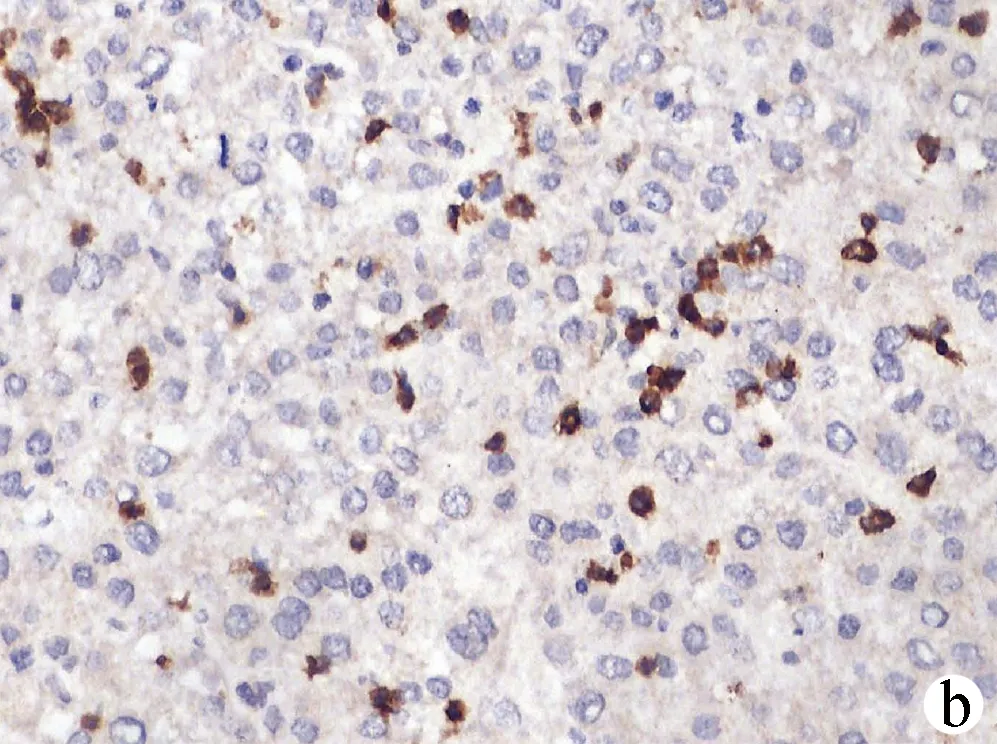


注:a,中度阳性;b,弱阳性;c,阴性。未见强阳性表达。




注:a,强阳性;b,中度阳性;c,弱阳性;d,阴性。
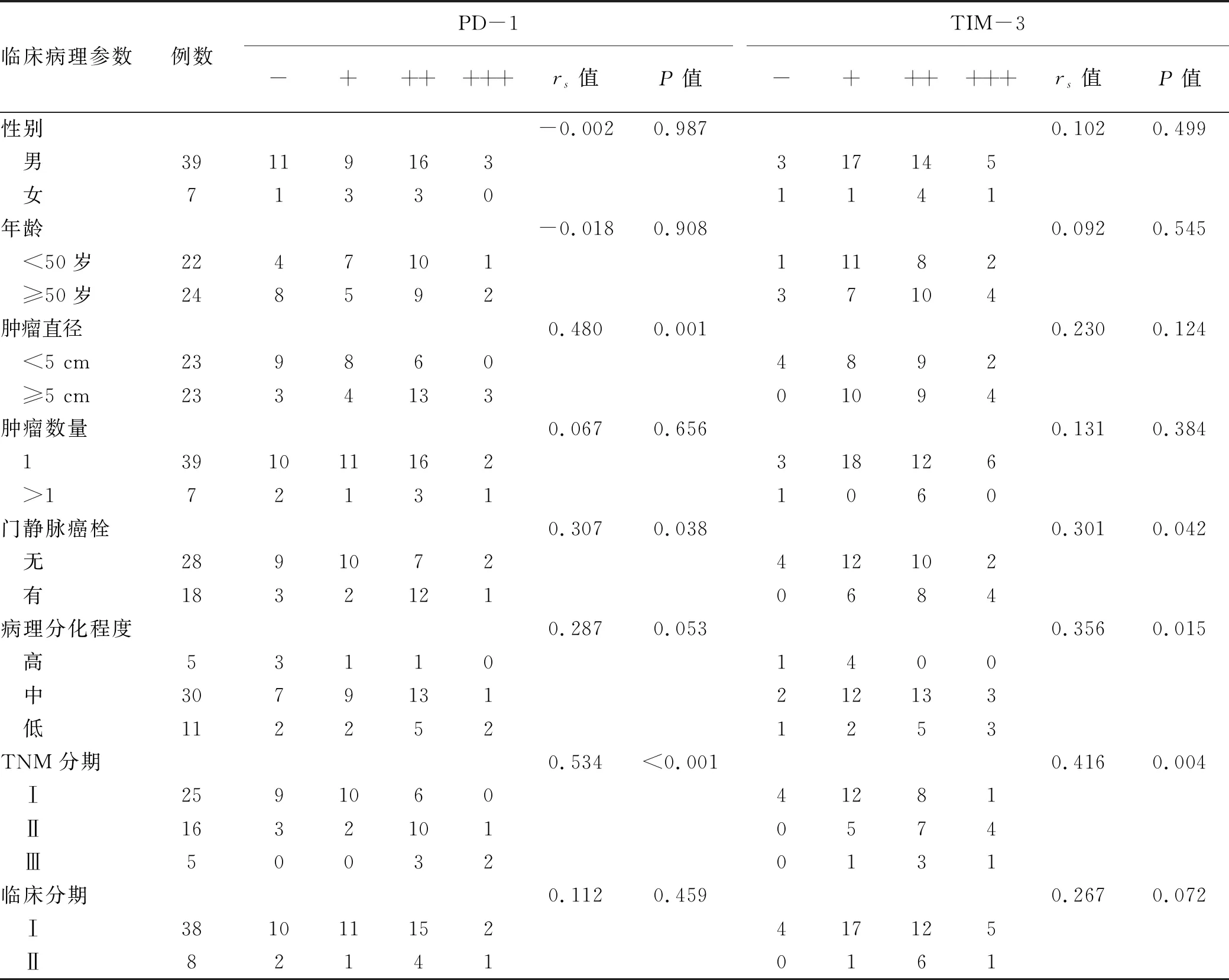
表1 PD-1、TIM-3表达与HCC患者临床病理参数的关系
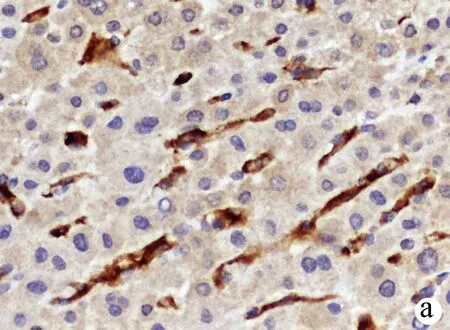
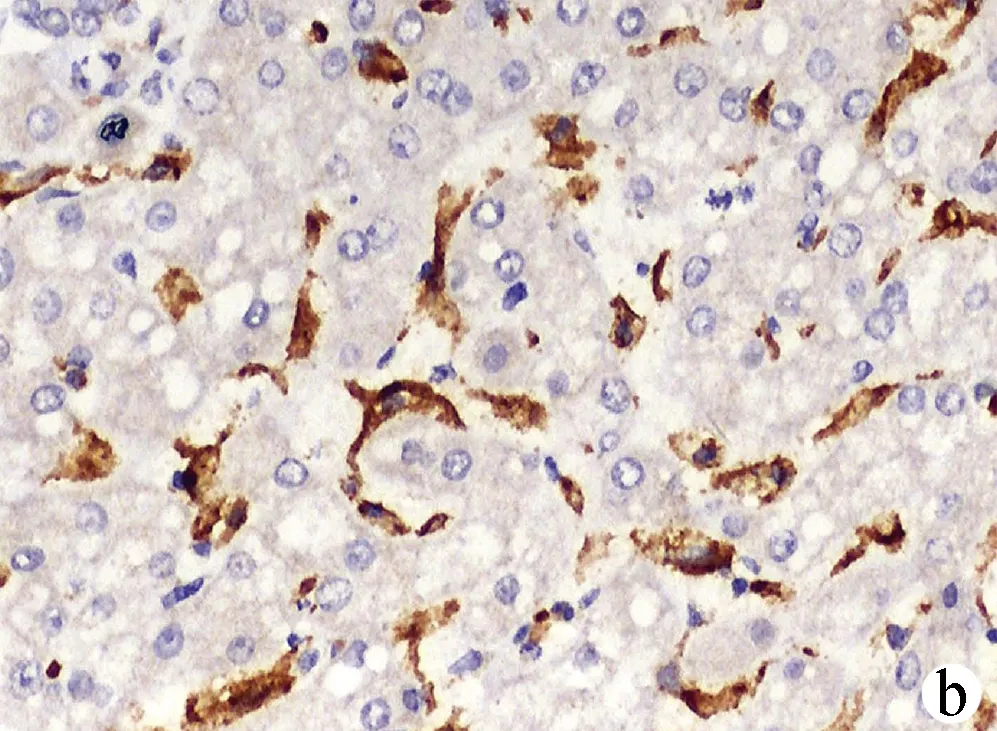


注:a,强阳性;b,中度阳性;c,弱阳性;d,阴性。
2.4 HCC组织中PD-1、TIM-3的表达与患者预后的关系 截至最终随访日,46例患者中无1例失访,随访率100%。HCC组织中PD-1不同表达水平组的OS比较差异有统计学意义(χ2=8.132,P=0.043);TIM-3不同表达水平组的OS比较,差异无统计学意义(χ2=2.077,P=0.557),PD-1、TIM-3不同表达水平组的DFS比较,差异均无统计学意义(χ2值分别为4.491、2.072,P值均>0.05)。
单因素分析显示肿瘤大小(χ2=10.238,P=0.001)、病理分化程度(χ2=13.939,P=0.001)、TNM分期(χ2=27.929,P<0.001)是影响患者术后OS的预后因素;病理分化程度(χ2=14.764,P=0.001)、TNM分期(χ2=18.137,P<0.001)是影响患者DFS的预后因素。多因素分析结果显示,病理分化程度(HR=4.723,95%CI:1.618~7.684,P=0.001)、肿瘤大小(HR=3.234,95%CI:1.327~7.883,P=0.010)、TNM分期(HR=3.254,95%CI:1.076~9.835,P=0.037)、TIM-3的表达水平(HR=0.572,95%CI:0.329~0.995,P=0.048)均是HCC患者OS的独立预后因素;病理分化程度(HR=2.945,95%CI;1.527~5.682,P=0.001)、TNM分期(HR=2.074,95%CI:1.259~9.793,P=0.016)均是HCC患者DFS的独立预后因素。
3 讨论
HCC是一类由多种因素导致的恶性肿瘤,其免疫学发病机制十分复杂。这些机制包括肝癌免疫微环境中抗原呈递和免疫效应功能的紊乱,免疫检查点分子的改变,以及细胞因子谱的紊乱[14]。免疫系统在发挥抗肿瘤免疫的同时,也通过免疫编辑对肿瘤细胞的一些生物学特性(如肿瘤表面分子表达、肿瘤的抗原性等)进行了重塑,促进了肿瘤细胞的恶性生长、转移、扩散[4]。由于独特的双重脉管系统,肝脏大量接触肠道病原体和外源性非致病分子,为防止自身免疫性肝损伤的发生,肝脏形成了强大的免疫耐受微环境[14]。在肝脏的免疫耐受微环境中,肿瘤通过免疫系统的负调节因子,抑制机体免疫系统及其效应因子,从而逃避T淋巴细胞免疫应答和宿主免疫反应[15-17]。
PD-1是B7/CD28家族的成员[18],在正常生理条件下,PD-1的主要功能是通过与其配体结合,抑制效应T淋巴细胞的功能,促进调节性T淋巴细胞(Treg)的功能和发育,进而防止外周组织中免疫反应的过度激活,从而保护宿主免于自身免疫应答[19-20]。HCC组织中肿瘤浸润淋巴细胞上的PD-1与其在肿瘤细胞表面的配体结合,参与形成了肿瘤抑制微环境,可抑制T淋巴细胞对癌细胞的杀伤作用,减少细胞毒性分子和细胞因子的产生,促进Treg的功能,改变了T淋巴细胞与DC或靶细胞接触范围,从而促使肿瘤细胞逃避机体免疫系统的监视和杀伤,而抑制PD-1信号通路则可增强内源性抗肿瘤免疫效应,减少肿瘤浸润和转移[6-7,21]。TIM-3属于TIM家族,是TIM-3家族的典型成员[22],TIM-3被认为与CD8+T淋巴细胞功能障碍和衰竭有关,近年来巨噬细胞上表达TIM-3的机制也受到了关注。肿瘤相关巨噬细胞(TAMs)代表着与癌症炎症相关的主要炎症细胞[23]。在浸润性肿瘤中,TAMs朝着一个以表达免疫调节因子(如IL-10和TGFβ)和弱抗原递呈能力为特征的M2表型分化[24]。2007年Science报道,TIM-3高表达于巨噬细胞,并通过NF-κB促进巨噬细胞的炎症反应。肿瘤微环境中的TGFβ能促使巨噬细胞表达TIM-3[25]。有研究[26]结果显示,在HCC中,TIM-3能促使TAMs向M2型分化,TIM-3通过NF-κB/IL-6通路促使TAMs产生适宜肿瘤生长的IL-6,干扰TIM-3能显著抑制TGFβ诱导的巨噬细胞M2极化,此时的巨噬细胞表现为IL-10分泌降低、IL-12生成增多。
Li等[27]发现HCC组织中PD-1和TIM-3的表达呈正相关,肿瘤邻近组织中PD-1和TIM-3的表达也呈正相关,而肝硬化组织中PD-1和TIM-3表达没有相关性。本研究发现,HCC组织中同时存在PD-1和TIM-3的高表达,两者的表达水平呈正相关,这与Li等[27]的结论相似。TIM-3在TAMs中表达较多,在HCC组织中的表达水平高于癌旁组织。这与阎文江等[26]报道的结果类似。HCC组织中PD-1的表达水平与肿瘤大小、有无门静脉癌栓和TNM分期有关,而与患者性别、年龄、肿瘤数目、病理分化程度和临床分期无关;TIM-3的表达水平与门静脉癌栓、病理分化程度和TNM分期有关,与患者性别、年龄、肿瘤直径、肿瘤数目和临床分期无关。
本研究还发现,PD-1不同表达水平组之间的OS有差异,TIM-3不同表达水平组之间的OS无明显差异。TIM-3是HCC患者OS的独立预后因素,但不是DFS的独立预后因素,而PD-1均不是HCC患者OS和DFS的独立预后因素,这可能与样本量小,患者基线特征的差异性等因素有关。
综上所述,HCC癌组织中PD-1、TIM-3的高表达与疾病的进展和不良预后有关。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:周舸负责课题设计,资料分析,撰写论文;王少扬对文章知识性内容作出批评性审阅并修改论文;林涛发参与收集数据;谢丽平、卢友光给予技术及材料指导。

