肿瘤相关巨噬细胞与长链非编码RNA在肿瘤发展中的研究进展*
葛将 李文坤 李倩 王芸 王亚丹 综述 吴静② 审校
1 长链非编码RNA
2003年人类基因组测序完成后,发现仅有20 000个基因参与蛋白质编码,然而超过98%的基因不进行蛋白质翻译,称为非编码RNA(non-coding RNAs,ncRNAs)[1]。传统意义上的ncRNAs分为两大类。第一大类根据长度的不同分为:长度<200个核苷酸的短链非编码RNA,如microRNA(miRNA)、转运RNA(tRNA);长度超过200个核苷酸达到10万个碱基对的长链非编码RNA(long non-coding RNA,lncRNA)。第二大类组成包括:在X染色体失活中发挥重要作用的X染色体失活特异转录物(X-inactive-specific transcript,Xist)、同源框基因反义基因间RNA(homeobox gene antisense intergenic RNA,HOTAIR)、H19[2]。
1.1 lncRNA分类和结构
lncRNA构成了非编码基因组大部分空间,根据其在基因组上相对于蛋白质编码基因的位置,lncRNA分类为正义lncRNA、反义lncRNA、双向lncRNA、基因间lncRNA、内含子lncRNA。这些非编码转录本通常与相应的mRNA编码序列存在部分重叠,可能具有mRNA相同的功能。lncRNA包括一类不同转录本,其结构类似于mRNA,但不编码蛋白质[3]。与mRNA相同,大多数lncRNA也是由RNA聚合酶Ⅱ转录,进行可选择性剪切,可能携带有单核苷酸多态性(SNPs),进行5’端加帽和聚腺苷酸化[4]。结构上,lncRNA可以形成复杂二级结构及复杂高级结构,增强识别蛋白质的能力[5]。
1.2 lncRNA调控机制
lncRNA在转录和转录后水平调控基因表达[6]。在转录水平,lncRNA通过顺式或者反式作用以与染色质修饰酶相互作用、诱捕转录因子和直接与启动子结合等方式导致基因的激活或沉默[7-9]。lncRNA LNAPPCC与EZH2结合,抑制EZH2与PCDH7启动子结合,下调PCDH7启动子中组蛋白H3K27me3水平,激活PCDH7的表达[10]。lncRNA HAND2-AS1将转录因子E2F4募集到C16orf74启动子区域,并下调C16orf74表达。有报道表明,HAND2-AS1通过募集转录因子E2F4抑制C16orf74表达而抑制宫颈癌发生发展[11]。在转录后水平,lncRNA通过介导翻译和增强部分互补mRNA的稳定性调控基因表达;lncRNA干涉RNA结合蛋白,影响剪切和翻译过程以及调节蛋白质的活性和位置;lncRNAs作为竞争性内源性RNA(ceRNA)吸附micRNA[12]。lncRNA RPPH1通过与β-Ⅲ微管蛋白(TUBB3)相互作用,阻止其泛素化,从而诱导大肠癌细胞上皮-间充质转化[13]。lncRNA CASC19作为ceRNA通过CASC19/miR-130b-3p/ZBR2轴调控非小细胞肺癌进展[14]。lncRNA功能与其亚细胞定位有关[15],细胞核内的lncRNA主要参与指导和招募组蛋白蛋白修饰酶、转录因子到达特定基因位点,最终引起转录抑制因子失活和致癌基因激活[16]。细胞质中lncRNA通常作为ceRNA调控mRNA蛋白稳定性参与细胞生物学进程[7]。多项数据表明,lncRNA在不同疾病的基因表达,尤其是恶性肿瘤中发挥重要调节作用[17]。在癌症中异常表达的lncRNA可以作为诊断、预后的分子标记,以及癌症治疗潜在靶点[18]。
2 肿瘤相关巨噬细胞
肿瘤是一个多基因多因素疾病,除肿瘤细胞之外,肿瘤微环境(tumor microenvironment,TME)其他组成部分也介入到肿瘤发展过程中。TME与肿瘤细胞之间相互关系对肿瘤发生发展起重要作用。除了肿瘤细胞,TME由许多不同的非癌细胞类型组成,包括内皮细胞、脂肪细胞、成纤维细胞、肌成纤维细胞、周细胞、平滑肌细胞以及不同的免疫细胞[19]。来源于骨髓的单核细胞随着血液循环迁移到组织和器官,之后分化为巨噬细胞[20]。巨噬细胞是不同的群体,不断改变其功能表型应对不同压力条件[21]。在TME当中,巨噬细胞受到不同刺激极化成两种不同亚型巨噬细胞:传统激活型M1巨噬细胞亚型和交替激活型M2巨噬细胞亚型[22]。在非恶性肿瘤中,大多数巨噬细胞是M1亚型,主要发挥促炎作用,以抗原呈递和促进肿瘤消亡为特征。恶性肿瘤中的巨噬细胞,通常被称为肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs),主要是M2亚型,产生细胞因子和下调抗炎免疫反应促进肿瘤进展[21]。巨噬细胞从M1亚型转变成M2亚型是可逆过程,取决于微环境中的信号[23]。
实体TME中,外周血单核细胞通过血管浸润到肿瘤组织中极化为TAMs,肿瘤发展不同时期有不同亚型[24]。肿瘤发展早期阶段,TAMs发挥促炎表型作用,启动抗肿瘤I型炎症反应,通过释放TNF-α、ROS或者吞噬作用抑制肿瘤细胞生长[25-26]。肿瘤进展期,TME刺激巨噬细胞分泌IL-10、TGF-β限制细胞毒性T淋巴细胞和自然杀伤细胞的活性。大多数肿瘤中,巨噬细胞大量浸润与临床预后不良相关[27]。TAMs占据肿瘤实体50%以上,大多数为M2亚型。高密度的TAMs与多种肿瘤预后不良有极大相关性[28]。TAMs是TME主要的免疫抑制细胞,被认为是肿瘤干性和药物抵抗主要促进因素[29]。有研究表明,lncRNA在癌症免疫方面发挥重要作用,包括免疫激活、免疫细胞迁移和抗癌细胞毒性[30]。肿瘤发展过程中,TAMs在TME中发挥不同作用,lncRNA与TAMs在肿瘤发展过程中存在调控关系。
3 肿瘤组织内lncRNA通过TAM对肿瘤细胞作用
lncRNA是免疫细胞激活和分化的重要调控者[31]。肝癌细胞中高表达的lnc LINC00662 与miRNA-16、miRNA-107、miRNA-15a结合调控WNT3A表达水平发挥ceRNA的机制,高表达的WNT3A激活肿瘤细胞内Wnt/β-catenin信号通路促进肝癌细胞增殖、迁移和侵袭,同时高表达的WNT3A激活TME中TAMs内Wnt/β-catenin信号通路,使其表现为M2型功能巨噬细胞[32]。
lncRNA RP11-361F15.2在骨肉瘤组织中表达显著增加,其表达与CPEB4的表达呈正相关,与miRNA-30c-5p表达呈负相关。过表达RP11-361F15.2在体外增加了骨肉瘤细胞迁移/侵袭和TAMs M2样极化,并促进了体内移植瘤生长。RP11-361F15.2通过miRNA-30c-5p促进CPEB4介导肿瘤发生和TAM M2样极化,RP11-361F15.2/miRNA-30c-5p/CPEB4环可作为治疗内肉瘤潜在策略[33]。在结直肠癌癌细胞中,高表达的lncRNA RPPH1被TME中巨噬细胞摄取,促使巨噬细胞分化为M2型TAMs,肿瘤细胞中的RPPH1既可对自身作用发挥促进肿瘤侵袭和迁移作用,又可通过促使M2型极化,间接促进肿瘤侵袭和迁移[34]。目前,M1型巨噬细胞抑制肿瘤进展,M2型巨噬细胞促进肿瘤进展被广泛接受,如CASC2c[35]、GNAS-AS1[36]通过一定机制调控TME中巨噬细胞浸润、极化,lncRNAs通过调控M1或者M2极化对肿瘤进展产生不同作用。异常表达的lncRNAs可作为肿瘤早期诊断分子或潜在治疗靶点和未来研究的治疗方向。
4 TAMs中lncRNA对肿瘤细胞的作用
有报道显示,TAMs中lncRNA通过调控巨噬细胞极化亚型,对肿瘤细胞产生不同作用。在乳腺癌中,敲降TME中TAMs内linc-p21逆转TAMs功能亚型,同时增加抗乳腺癌能力,促进肿瘤细胞凋亡,抑制肿瘤细胞迁移和侵袭。linc-p21可以直接作用于p53,去除MDM2对p53的降解作用,促进乳腺癌微环境TAMs亚型维持作用。敲降TAMs中linc-p21,p53与linc-21之间的作用关系减弱,增强p53与MDM2之间的作用关系,激活NF-κB和STAT3信号通路,逆转TAMs的亚型,产生大量的TNF-α杀伤肿瘤细胞发挥抗肿瘤作用[37]。lncRNA ANCR在TAMs中高表达,使TAMs不表现为M1功能亚型,ANCR在诱导M1型巨噬细胞中呈现低表达,过表达M1中ANCR后,通过下调FoxO1蛋白,抑制M1功能亚型巨噬细胞极化,胃癌发生侵袭和迁移的能力增强[38]。在肝细胞癌中,lncRNA cox-2在M1型巨噬细胞中高表达,敲降lncRNA 后,M1 型巨噬细胞分子标记IL-12、iNOS、TNF-α表达下降,而M2型分子标记IL-10、Arg1、Fizz-1表达增加,逆转巨噬细胞M1表型为M2亚型。敲降lncRNA cox-2的M1型巨噬细胞与肝癌细胞共培养,抑制肝癌细胞增殖、侵袭、迁移和上皮间充质转化(epithelial-mesenchymal transition,EMT)。lncRNA cox-2通过促进M1型巨噬细胞极化抑制肝癌细胞的免疫侵袭和迁移,同时抑制M2型巨噬细胞极化[39]。相关的疾病中lncRNAs与TAM极化相互作用的相关机制见表1。
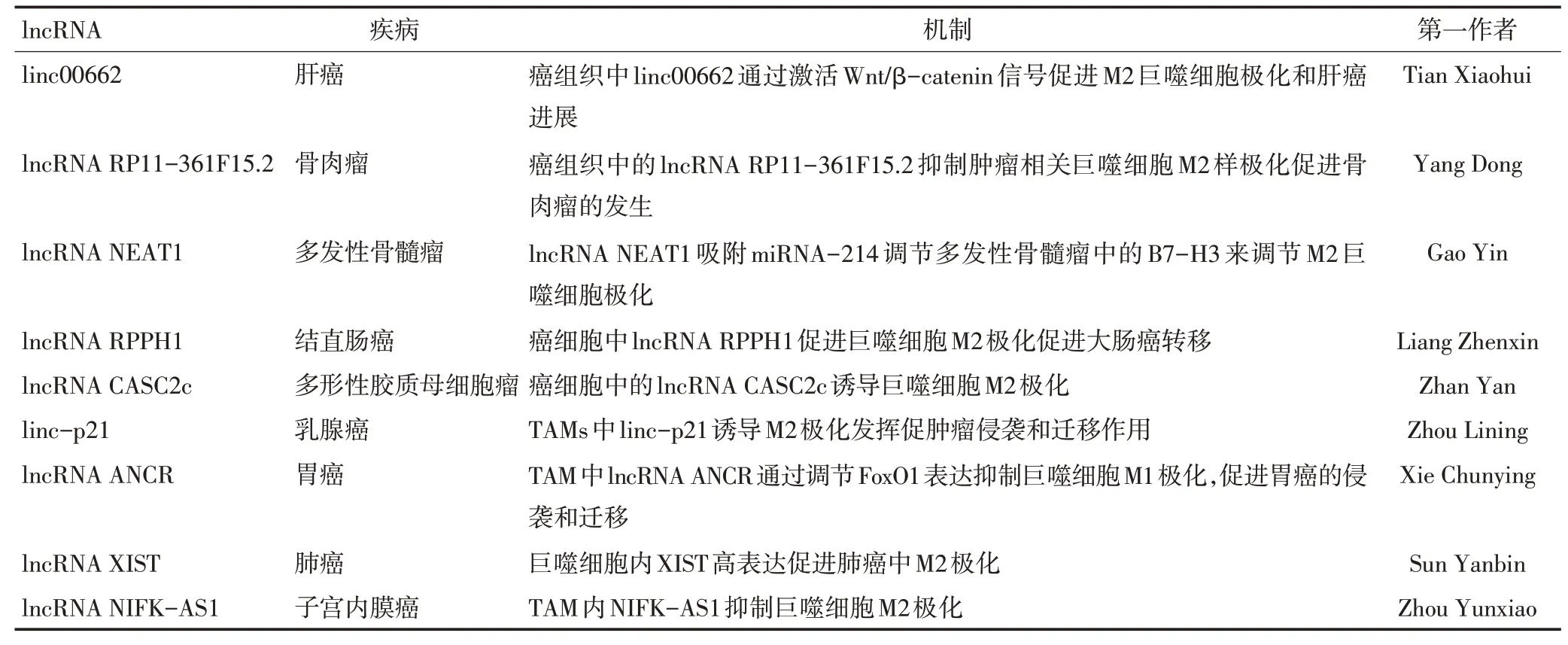
表1 不同肿瘤中lncRNA与TAMs极化
目前,临床上已采取针对TAMs作为靶点的临床治疗方式,肿瘤常规治疗方式主要包括手术、放疗、化疗,存在一定不良反应,动员和加强免疫系统,以识别和消除癌细胞。这些治疗方法之一就是以单核细胞和巨噬细胞作为免疫治疗靶点。主要是从以下几个方面进行干预:阻止巨噬细胞聚集到肿瘤组织中;消除在肿瘤组织中已经存在的TAMs;将TAMs重编程为抑癌的M1型巨噬细胞;中和TAMs产生的促肿瘤产物;利用TAMs传递杀肿瘤药物进入到微环境中[23]。
TAMs内lncRNA调控TME中巨噬细胞极化,进而影响肿瘤进展。lncRNA还影响肿瘤血管生成,lncRNA MALAT1抑制了VEGF-A的产生,损害了HUVECs血管生成[40]。TAMs通过局部降解细胞外基质,释放内皮细胞生长刺激因子FGF-2、VEGF、GM-CSF等刺激内皮细胞增殖和迁移,影响血管成熟,进而促进肿瘤血管生成[41]。在M2中高表达,M1中低表达的LncRNA-MM2P,增强M2巨噬细胞促血管生成功能,进而促进肿瘤进展[42]。
5 结语
了解lncRNA结构和功能,可进行以lncRNA为基础的肿瘤治疗。根据lncRNA 与TAMs 之间的关系及对肿瘤产生的作用,未来临床上可为肿瘤新的诊断分子及治疗靶点提供线索。

