食管癌免疫检查点抑制剂单药及联合治疗的研究进展
钟懋晰 综述 朱宇熹② 审校
食管癌是一种常见的消化道恶性肿瘤,在全球范围内,其发病率和死亡率分别位居恶性肿瘤的第八位和第六位[1]。由于发病隐匿、侵袭性强,食管癌的预后极差,大多数国家的患者5年生存率为15%~30%[2]。食管癌患者确诊时往往已进展至中晚期,失去最佳手术时机。对于晚期食管癌,治疗仍以化疗为主,但疗效十分有限。对于不能切除的晚期、复发或转移性食管鳞癌(esophageal squamous cell carcinoma,ESCC)或腺癌(esophageal adenocarcinoma,EAC)患者,以5-氟尿嘧啶和铂类为基础的双联化疗被各指南推荐为一线治疗选择。一线化疗出现进展的患者,后线治疗以多西他赛、紫杉醇或伊立替康等姑息性化疗为主,由于化疗不良反应大、易出现耐药,生存获益十分有限。多项临床试验证明了晚期患者接受标准化疗的有效性为20%~35%,中位生存期仅6~10 个月[3]。以血管内皮生长因子(vascular endothelial growth factor,VEGF)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)为代表的靶向药物有一定疗效,但仅限于部分腺癌患者。近年来,随着免疫检查点信号通路研究的不断发展,化疗难治性患者有了更多的治疗选择。现将食管癌免疫治疗的最新进展综述如下。
1 免疫检查点抑制剂
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是一种针对T 细胞表面共抑制信号的癌症治疗方法,通过使免疫系统中的制动机制失效而激活宿主长期的抗肿瘤反应[4]。常见的免疫检查点有细胞毒性T 淋巴细胞抗原-4(cytotoxic T lymphocyteassociated protein-4,CTLA-4)、程序性细胞死亡因子-1(programmed death-1,PD-1)及其配体(programmed death-ligand 1,PD-L1)。PD-1 广泛表达于免疫细胞,组织细胞表面的PD-L1是其主要配体,两者的结合可通过阻止T细胞激活减弱自身免疫,从而实现自身免疫耐受[5]。此外,这种免疫抑制作用部分是通过促进淋巴结中抗原特异性T细胞(antigen-specific T cells,AST)的凋亡和抑制调节性T细胞(regulatory T cells,Treg)的凋亡来实现的[6]。然而,许多肿瘤细胞表面也表达PD-L1,并凭借PD-1/PD-L1通路的激活发生免疫逃逸。研究发现,抑制两者结合可以解除免疫抑制状态,使T细胞完全活化建立免疫应答,增强临床前模型的抗肿瘤活性[6-7]。近年来,大量临床研究也证实,ICIs可以提高缓解率并带来生存获益。针对PD-1/PD-L1和CTLA-4的单克隆抗体在部分瘤种取得了较好的疗效。目前,已成为转移性黑色素瘤、非小细胞肺癌、肾细胞癌和膀胱/尿路上皮癌的一线治疗手段。随着临床试验的开展,ICIs在进展期食管癌的后线治疗中也崭露头角,以PD-1/PD-L1抑制剂为代表。此外,在一线治疗上,ICIs联合放疗、化疗、靶向及双重免疫等综合治疗模式也有了初期的试验结果。
2 ICIs单药的治疗进展
2.1 食管鳞癌的ICIs单药治疗
2.1.1 三线治疗 国内、外的PD-1 抑制剂在晚期ESCC的后线(≥3线)治疗中均显示出一定的疗效,各研究报告的客观缓解率(objective response rate,ORR)为14.3%~33.3%[8-11]。部分研究发现,中位无进展生存期(median progression free-survival,mPFS)为1.8~3.6 个月,中位总生存期(median overall survival,mOS)为7.0~10.8个月。3~5级治疗相关不良事件(adverse events,AE)的发生率为10.0%~17.0%,最常见的是肺炎、皮疹、糖代谢异常和心脏损伤。免疫后线应用总体呈现出较好的抗肿瘤活性和安全性(表1),为早线免疫治疗奠定了基础。
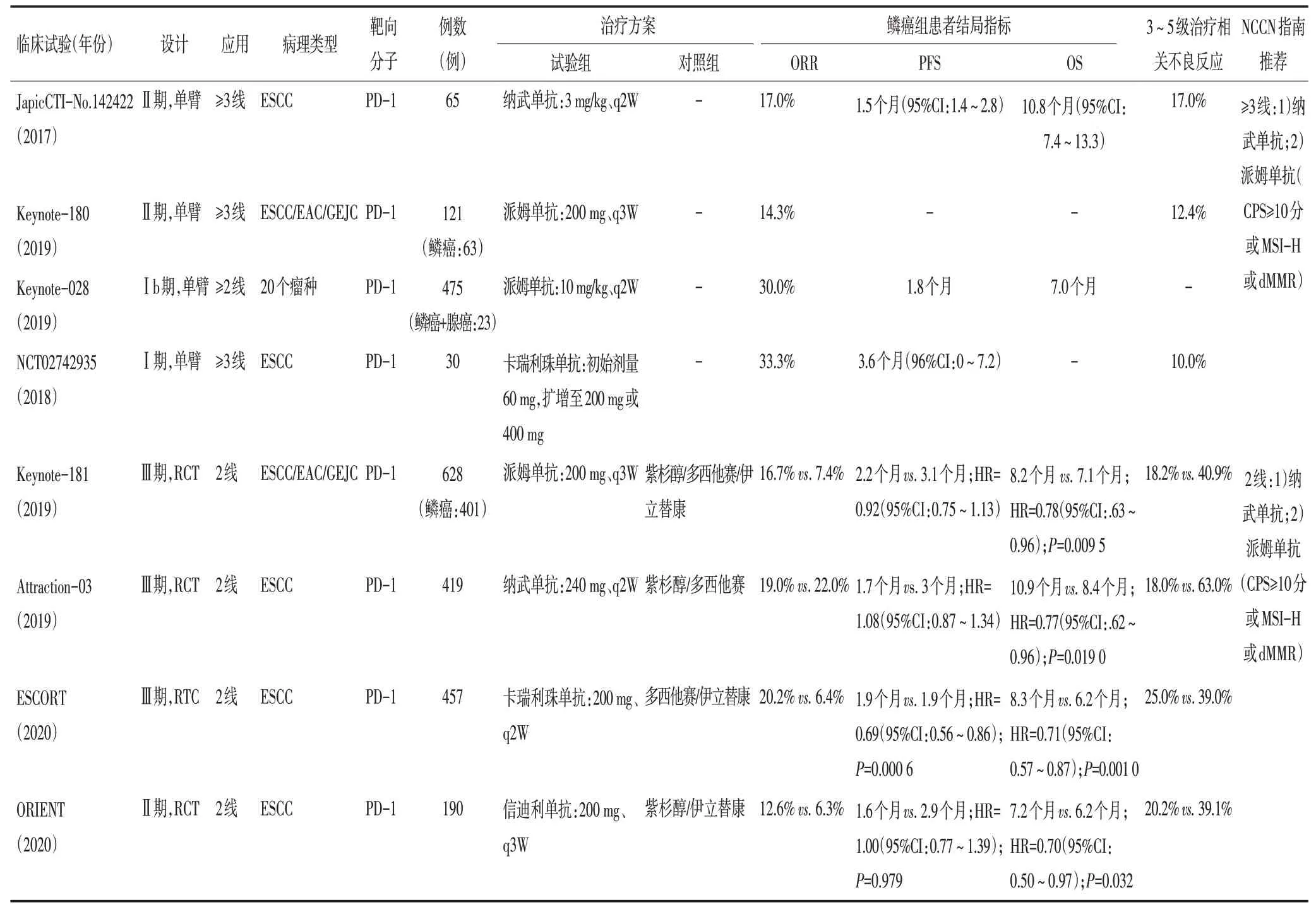
表1 ESCC单药ICIs治疗的相关性研究
2.1.2 二线治疗 免疫在鳞癌的二线应用以Keynote-181[12]研究为代表,在全球队列中,与化疗相比,鳞癌患者经派姆单抗(pembrolizumab)治疗后ORR更高(16.7%vs.7.4%),OS 有获益但差异无统计学意义(8.2 个月vs. 7.1 个月,HR=0.78,95%CI:0.63~0.96,P>0.007 7),而PFS 无明显获益。但在中国队列中ORR(16.7%vs.3.4%)及OS(HR=0.55,95%CI:0.36~0.82)均有明显改善,特别是PD-L1 联合阳性评分(combined positive score,CPS)≥10 分者OS 获益尤为显著(12.0 个月vs. 5.3 个月,HR=0.34,95%CI:0.17~0.69)。安全性方面,派姆单抗组的3~5 级AE 仅为化疗组的50%。因此,派姆单抗被纳入各指南对PDL1 CPS≥10 分晚期鳞癌的二线治疗推荐。针对亚裔人群的Ⅲ期研究(Attraction-03)[13]显示,纳武单抗组与化疗组比,PFS 相当(HR=1.08),OS 明显改善(10.9个月vs. 8.4 个月,HR=0.77,95%CI:0.62~0.96,P=0.019),且3/4级AE明显减少(18%vs.63%)。在最新的美国国家综合癌症网络(NCCN)指南(2020年V3版)中,纳武单抗(nivolumab)已被纳入晚期ESCC 二线治疗的标准选择之一。同时,国产PD-1抑制剂取得重要进展。ESCORT研究显示,鳞癌患者接受卡瑞利珠单抗(camrelizumab)或化疗二线治疗后,两组ORR 分别为20.2%和6.4%,mPFS 均为1.9 个月,卡瑞利珠单抗组的mOS 比化疗组延长2.1 个月(8.3 个月vs.6.2 个月,HR=0.71,95%CI:0.57~0.87)[14]。因此,2020年中国临床肿瘤学会(CSCO)指南将卡瑞利珠单抗纳入晚期食管癌二线治疗的Ⅰ级专家推荐。2020年美国临床肿瘤学会(ASCO)会议上最新公布的一项Ⅱ期临床试验(ORIENT-2)显示,PD-1抗体信迪利单抗(sintilimab)也具有良好的抗肿瘤活性,有待其Ⅲ期临床试验(NCT03748134)进一步证实。
2.1.3 一线治疗 对于失去手术机会的局部晚期或转移性ESCC患者,化疗/同步放化疗是标准治疗模式。目前,尚无ICIs单药挑战化疗/同步放化疗一线地位的研究报道。
2.2 EAC的ICIs单药治疗
2.2.1 三线治疗 单药PD-1/PD-L1 抑制剂在晚期EAC 的研究主要针对胃食管结合部癌(gastroesophageal junction cancer,GEJC)。GEJC 解剖位置特殊,兼具食管癌和胃癌(gastric cancer,GC)的特点,由于病因、病理类型及治疗方式上与GC 关系密切,许多临床试验将两者一并纳入分析。Ⅲ期临床试验Attraction-02率先在晚期GC/GEJC的三线及以后的治疗中取得较好疗效。该研究显示,纳武单抗对比安慰剂使患者1年OS 率成倍提高(26.2%vs.10.9%)。长期随访显示纳武单抗组2年OS 率明显增加(10.6% vs.3.2%),PD-L1 阴性者同样有OS 获益(HR=0.70,95%CI:0.50~0.99),且安全性较好[15]。随后报道的Ⅱ期临床试验Keynote-059 队列1 临床试验中,接受派姆单抗三线治疗的PD-L1 阳性(CPS≥1)患者ORR 为22.7%,中位缓解持续时间(duration of response,DOR)达8.1个月[16]。此外,PD-L1抑制剂阿维鲁单抗(avelumab)在Ⅲ期临床试验试验JAVELIN Gastric 300 的GEJC 亚组中未得到比化疗更好的生存获益(4.2个月vs.4.3个月),但3~5级AE发生率降低70%(9.2% vs. 31.6%),耐受性良好[17]。基于上述研究,PD-1/PD-L1 抑制剂在晚期GEJC 的三线应用中获得认可(表2)。
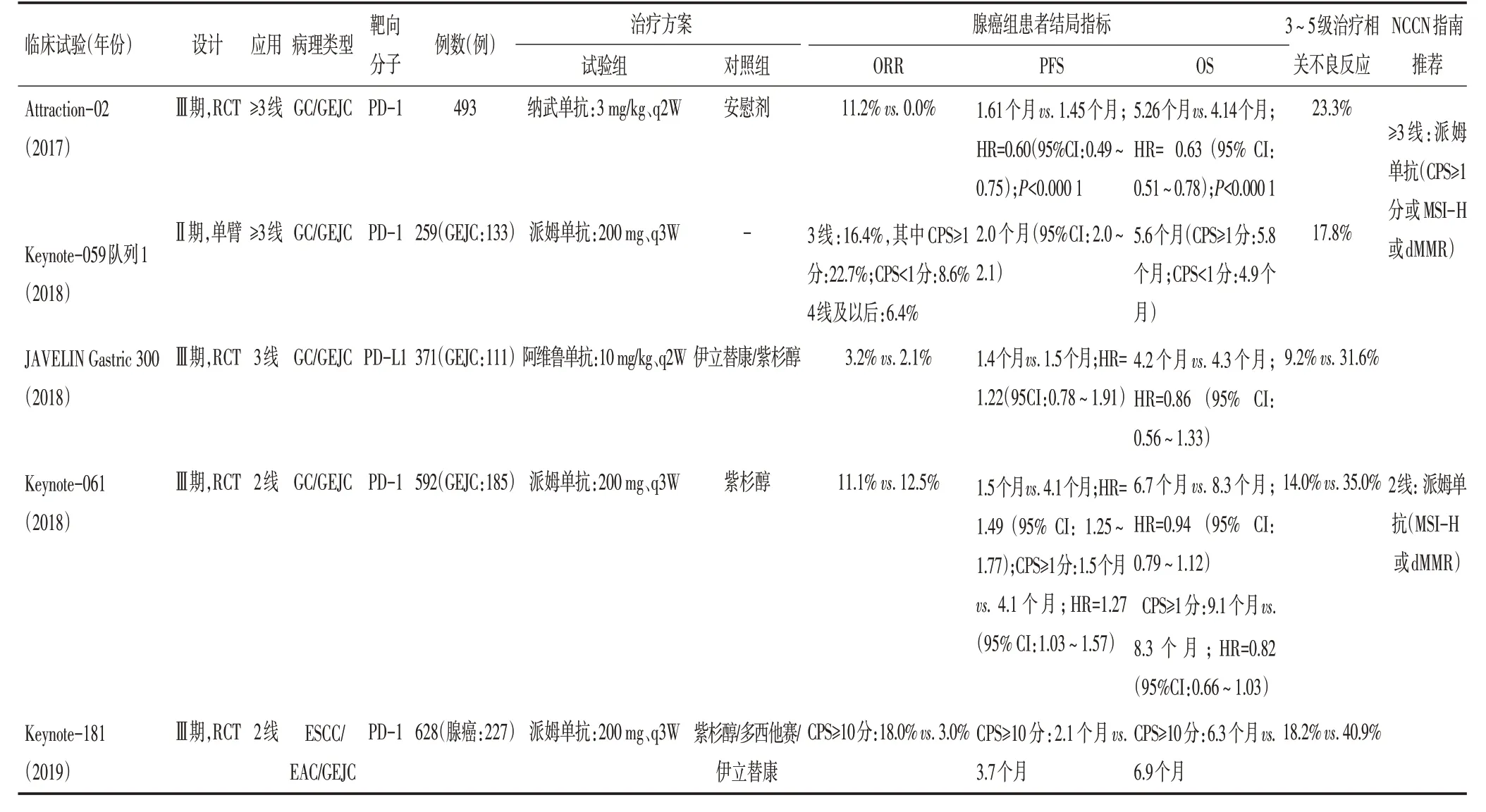
表2 EAC单药ICIs治疗的相关性研究

表2 EAC单药ICIs治疗的相关性研究(续表2)
2.2.2 二线治疗 对晚期EAC 二线治疗中Keynote-061临床试验发现,GC/GEJC 患者接受派姆单抗对比紫杉醇未得到阳性结果,但亚组分析可见PD-L1 阳性(CPS≥1)的GEJC患者有OS获益的趋势(HR=0.61,95%CI:0.41~0.90)[18]。而在Keynote-181 临床试验中,CPS≥10分的腺癌患者接受派姆单抗治疗,与单药化疗相比,尽管mOS 相近(6.3 个月vs.6.9 个月),但1年OS率有明显提高(23%vs.15%)[12]。
2.2.3 一线治疗 基于后线可观的疗效,免疫治疗在晚期GEJC 的一线治疗也有了探索研究,主要是HER-2阴性、PD-L1阳性(CPS≥1)的晚期GC/GEJC患者。在Ⅱ期临床试验Keynote-059 队列3 中,派姆单抗组的ORR 为25.8%,1年和2年OS 率分别为63.6%和40.1%[19]。在Ⅲ期临床试验Keynote-062 中,派姆单抗组ORR远低于标准化疗组(14.5%vs.36.8%),但OS获益处于非劣势[20]。该研究中CPS≥10的亚组,接受派姆单抗的ORR 有所提高但仍低于化疗(25%vs.36.7%),mPFS 不足化疗组的1/2(2.9 个月vs. 6.1 个月),但mOS 却达到反超效果,分别为17.4 个月和10.8 个月(HR=0.69)。由此可见,PD-L1 表达状态仍然是影响派姆单抗一线应用的重要因素。同时,评估免疫治疗疗效时,ORR、PFS与OS之间的关系值得思考,病灶短期内的缓解和控制率不一定与远期生存呈正相关。免疫治疗的疗效表现形式存在延迟效应,从T细胞抑制解除开始活化,到肿瘤局部的T 细胞浸润,再到临床抗肿瘤效应的产生,需要几周乃至数月时间[7]。因此,疗效评价的时间点和方法需要不断完善,新的实体瘤免疫相关疗效评价标准(immune-related response evaluation criteria in solid tumors,irRECIST)将有助于更合理的评价免疫治疗的获益程度。
3 免疫联合治疗的初步探索
基于ICIs在晚期食管癌后线治疗的良好获益,进行了免疫联合放疗、化疗、靶向以及双重免疫等综合治疗模式的初期试验。
3.1 免疫联合放疗
有研究表明,放疗可促进肿瘤抗原的提呈,上调PD-L1 的表达和CD8+淋巴细胞的比例,重塑肿瘤微环境,使“冷”肿瘤向“热”肿瘤转变,从而提高免疫治疗疗效[21]。因此,免疫联合或序贯放疗/放化疗可能起到更好的抗肿瘤作用。这种治疗模式在手术患者的新辅助及辅助治疗阶段有了初期试验结果,并在2019年ASCO 会议进行了报道。一项韩国的单臂Ⅱ期临床试验,评估术前放化疗联合派姆单抗治疗局部晚期ESCC 的疗效。该研究中28例患者接受以紫杉醇+卡铂(q1W),联合放疗(44.1 Gy/21 F)以及派姆单抗(200 mg、q3W)为主的新辅助治疗后,26 例完成手术治疗,结果病理完全缓解(pathological complate response,pCR)率达46.1%,1年OS为82.1%。对于不可手术切除的局部晚期ESCC患者,根治性放化疗后易复发转移导致失败。放化疗后能否通过免疫巩固治疗提高疗效,在非小细胞肺癌中已有阳性结果。目前,日本正在进行的TENERGY临床试验,也将在ESCC 进行免疫巩固治疗评估,该研究纳入不适合手术的局部晚期ESCC患者,在接受根治性放化疗后予以PD-L1 抑制剂阿特珠单抗(atezolizumab)进行巩固治疗,希望后续结果能为不可手术患者带来福音。
荷兰的PERFECT临床试验显示,阿特珠单抗联合术前PC化疗[卡铂(AUC=2)+紫杉醇50 mg/m2,q1W×5)]及放疗(44.1 Gy/21 F)可使EAC患者术后pCR达到39%,明显高于CROSS临床试验(23%)[22]。在术后辅助治疗阶段,一项美国的多中心临床研究对PD-L1抑制剂度伐单抗(durvalumab)进行了评估,共入组24例局部晚期EAC/GEJC患者,接受含铂方案化疗及同步放疗(41 Gy)后行R0切除,术后予以度伐单抗维持治疗1年。该研究的1年无复发生存率(recurrence-free survival,RFS)为79.2%,1年和2年OS达95%和59.2%,3级AE共3例,分别为肺炎、肝炎和结肠炎。
3.2 免疫联合化疗
细胞毒性药物通常被认为具有免疫抑制作用,而临床前研究发现,某些化疗药物能够消除或调节肿瘤微环境中的免疫抑制细胞。如氟尿嘧啶和顺铂可有效消除骨髓源抑制细胞,从而发挥免疫刺激功能[23-24]。而在免疫检查点被抑制的情况下,肿瘤细胞遭到T 细胞攻击后对细胞毒性药物可能更加敏感[24]。已有研究表明,免疫治疗联合化疗可触发宿主产生持久有效的肿瘤抗原特异性T淋巴细胞,并协同优化抗肿瘤作用[25]。但在Ⅲ期临床试验Keynote-062 中派姆单抗与含铂双药化疗(顺铂80 mg/m2d1+氟尿嘧啶800 mg/m2d1~5、q3W)的结合并未达到预期的效果[20]。该研究结果显示,联合治疗可使GC/GEJC 的ORR 达到最大化(联合48.6%vs.化疗36.8%vs.免疫14.5%),PFS 也有显著延长。而这种优势并未转化成OS 的绝对获益。有关PD-1 抑制剂替雷利珠单抗(tislelizumab)的一项Ⅱ期临床试验纳入30 例患者,结果表明免疫联合化疗(顺铂+氟尿嘧啶/奥沙利铂)一线治疗ESCC 和GC/GEJC 患者,ORR 均达到46.7%,mPFS 分别为10.4 个月和6.1 个月,长期生存尚待报道。临床也将探索进展期ESCC 和EAC 患者一线免疫联合化学治疗的有效性。值得关注的是,化疗药物的剂量和方案对免疫调节活性有很大影响,有研究者提出了中剂量间歇化疗(medium-dose intermittent chemotherapy,MEDIC),旨在通过持续激活免疫反应达到抗肿瘤活性的最大化[24]。未来,节律化疗可能作为免疫诱导方案,在食管癌的免疫联合治疗中进行更多尝试。
3.3 免疫联合靶向治疗
促血管生成因子在大多数实体瘤中过度表达,而适当的抗血管生成治疗可在一定的时间窗内使异常的肿瘤血管正常化,增加免疫效应细胞对肿瘤的浸润,并将固有的免疫抑制的肿瘤微环境(tumor microenvironment,TME)转变为免疫促进的微环境[26]。研究表明,抗血管治疗和免疫联合将通过调节肿瘤血管系统和肿瘤免疫微环境提高治疗反应[27],这为两者的联合治疗提供了理论基础。一项度伐单抗联合VEGFR-2 抗体雷莫芦单抗的Ⅰb 期临床试验显示,GC/GEJC患者二线使用联合治疗获得较好的长期生存(mOS为12.4个月)[28]。对于ESCC患者,黄镜研究团队报道了30 例患者一线使用卡瑞利珠单抗(200 mg、q2W)联合小分子VEGFR-2 酪氨酸激酶抑制剂阿帕替尼(250 mg、qd)和化疗(脂质体紫杉醇150 mg/m2+奈达铂50 mg/m2、q2W)的初期结 果(NCT03603756),ORR 和DCR 分别达80%和96.7%,3/4级AE 主要是白细胞减少(83.3%),生存情况有待后续报道。此外,免疫联合表皮生长因子受体(epidermal growth factor receptor,EGFR)靶向药物的研究也正在进行中,如卡瑞利珠单抗联合尼妥珠单抗二线治疗晚期ESCC 的Ⅱ期临床试验(NCT03766178),以及派姆单抗联合曲妥珠单抗及化疗一线治疗HER-2阳性EAC的Ⅲ期临床试验Keynote-811,结果值得关注。
3.4 双重免疫治疗
在转移性黑色素瘤、肾细胞癌和NSCLC中,纳武单抗和抗CTLA-4药物依匹单抗(ipilimumab)的协同T 细胞抗肿瘤活性得到验证[29]。而针对进展期EC/GC/GEJC 的Ⅰ/Ⅱ期临床试验Checkmate-032 并未观察到明显的OS 差异,且3~4 级AE 较免疫单药组显著增加(47% vs. 17%)[30]。目前,Ⅲ期临床试验Checkmate-649 将对纳武单抗联合依匹单抗在GC/GEJC 的疗效进行进一步评估。Checkmate-648 研究将对其在ESCC 的一线治疗进行评估。双重免疫治疗在食管癌的前景尚未明确,不同剂量的组合以及预测性生物标志物治疗值得探索,希望更多的Ⅲ期临床试验结果能为临床提供指导。
4 结语
ICIs 在进展期食管癌患者的治疗显示出较好的疗效,为食管癌的后线治疗带来希望,指南已经推荐部分药物作为二线及以上治疗的选择。值得关注的是,ICIs 治疗存在延迟效应,部分患者可能出现假性进展,疗效评价的时间点和方法需要不断优化。目前,如何优化不同治疗方式的协同作用亟待研究。关于最佳组合方式、序列效应和最佳药物浓度时间特征等问题,将成为今后探索的重点。

