G蛋白信号转导调节因子通过抑制MAPK和NF-κB通路缓解脂多糖诱导的人膝骨关节软骨细胞炎症反应实验研究*
赵 宇,李 洺,赵 江,董炳辰,马 丁
1.西安市第九医院骨科(西安 710054);2.西安市第九医院老年病科(西安 710054)
骨性关节炎(Osteoarthritis,OA)是一种退行性疾病,年龄是诱发OA最重要的诱因[1]。OA的特征是关节的逐渐退化,导致关节活动能力和功能丧失,并伴有慢性疼痛[2]。近年来,随着对OA发病机制的深入探究,人们发现软骨细胞炎症损伤在OA疾病的进展中具有重要作用,并且软骨细胞炎症损伤的研究对了解OA的治疗具有重要意义[3]。RGS1是G蛋白耦联受体(G protein-coupled receptor,GPCR)的调节因子,负调控GPCR,从而影响下游的细胞通路[4]。RGS1参与了绝大多数炎症反应,并在免疫细胞包括B淋巴细胞、T淋巴细胞、树突状细胞和单核细胞中强烈表达[5-6]。研究发现RGS1在类风湿关节炎和未分化型脊椎关节炎中具有重要作用[7-8]。在之前的一项研究报道RGS1在膝关节骨性关节炎(Knee osteoarthritis,KOA)的软骨中表达水平高于正常软骨细胞[9],然而,RGS1在KOA疾病中的具体功能鲜少研究。本文主要探讨RGS1对脂多糖(LPS)刺激介导的人KOA软骨细胞炎症的影响和潜在的机制,以期为KOA的治疗提供一定的理论依据。
材料与方法
1 主要试剂 LPS(L6529-1MG,Sigma,美国);正常人膝关节软骨细胞(NHAC-kn,CC-2550,Lonza Walkersville,美国);胎牛血清(SV30087.02)、DEME(C11885500BT,Gibco,美国),Trizol试剂(15596018,Invitrogen,美国);细胞计数试剂盒(CCK-8,DJDB4000X,Dojindo Molecular Technologies,日本);基质金属蛋白酶(MMP)-2 ELISA试剂盒(MMP200)、MMP-9 ELISA试剂盒(DMP900,R&D Systems,美国);RNA反转录试剂盒与cDNA合成试剂盒(RR047A)、qPCR定量试剂盒(DRR820A,Takara,日本);BCA蛋白浓度测定试剂盒(P0010)、SDS-PAGE凝胶配制试剂盒(P0012A,碧云天生物技术,中国);聚偏氟乙烯(PVDF)膜(GVWP04700,Millipore,美国);抗RGS1抗体(ab154973)、抗一氧化氮合酶(i-NOS)抗体(ab178945)、抗环氧化酶(COX-2)抗体(ab16701)、抗p-ERK1/2抗体(ab214036)、抗ERK1/2抗体(ab54230))、抗p-p38抗体(ab38238)、抗p38抗体(ab31828)、抗p-JNK抗体(ab76572)、抗JNK抗体(ab179461)、抗NF-κB p-p65抗体(ab194726)和抗NF-κB p65抗体(ab16502,Abcam,英国);抗GADPH抗体(ab8245)、辣根过氧化物酶(HRP)二抗(9003-99-0,美国Sigma公司);Lipofectamine 3000(L3000-015,Invitrogen,美国)。
2 研究方法
2.1 人膝关节软骨细胞培养:NHAC-kn细胞培养于含10%胎牛血清的DEME培养基中,将培养基置于含5% CO2培养箱中培养,培养箱温度为37℃。
2.2 LPS刺激和细胞活性检测:NHAC-kn细胞接种于24孔板(1×105/孔)。待软骨细胞长至80%融合后,不同浓度的LPS(10、100、500、1000 ng/ml)分别处理软骨细胞。此外,空白对照软骨细胞不做任何处理。6 h后,CCK-8检测细胞活性。
2.3 细胞转染:RGS1-shRNA1和RGS1-shRNA2及其阴性对照组合成于上海吉玛制药技术有限公司。Lipofectamine 3000转染试剂盒将这些载体转染入软骨细胞。
2.4 RT-qPCR:未处理组、LPS、LPS+shRNA、LPS+shRGS1 NHAC-kn细胞接种于96孔板,于37℃培养24 h。随后,收集各组细胞,Trizol 法用于分离RNA,检测RNA浓度和片段的完整性。取2 μg总RNA进行反转录实验,然后NHAC-kn细胞RGS1、TNF-α、IL-1β、MMP-2和MMP-9转录水平根据qPCR试剂盒说明书进行检测。GADPH作为内参基因。2-ΔΔCT法计算基因的相对表达量。
2.5 Western blot:未处理组、LPS、LPS+shRNA、LPS+shRGS1细胞接种于96孔板,于37℃培养24 h。收集并裂解细胞,BCA法用于检测蛋白的总浓度,12% SDS-PAGE凝胶分离蛋白并转移到PVDF膜上,室温封闭3 h。初抗抗体RGS1、i-NOS、COX-2、p-ERK1/2、ERK1/2、p-p38、p38、p-JNK、JNK、NF-κB p-p65、NF-κB p65和GADPH低温下孵育过夜。随后,室温下用HRP二抗孵育1 h。
2.6 ELISA检测:未处理组、LPS、LPS+shRNA、LPS+shRGS1细胞均匀接种于96孔板,37℃条件下培养24 h。培养液中NO水平采用NO定量ELISA试剂盒检测;MMP-2和MMP-9水平分别使用MMP-2 ELISA试剂盒和MMP-9 ELISA试剂盒。
3 统计学方法 使用SPSS 22.0统计学软件进行统计学分析。三个独立实验的所有结果均显示为平均值±标准差。采用t检验评价两组间的统计学差异,单因素方差分析(One-way ANOVA)用于两组以上比较。以P<0.05为差异有统计学意义。
结 果
1 LPS处理促使NHAC-kn细胞中RGS1水平升高 首先,将软骨细胞与LPS孵育,诱导细胞损伤。实验结果表明,100、500、1000 ng/ml LSP处理软骨细胞6 h可以显著降低细胞活性(P<0.05,图1A)。另外,LPS可以诱导RGS1 mRNA和蛋白表达水平显著升高(P<0.05,图1B)。因此,在后续的实验中选择100 ng/ml LPS诱导体外软骨细胞损伤。
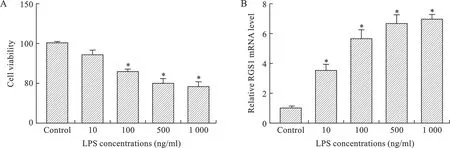
图1 LPS对软骨细胞活性和RGS1 mRNA表达的影响
2 抑制RGS1减轻LPS介导的NHAC-kn细胞炎症 为了研究RGS1对LPS刺激引发的软骨细胞炎症的作用,实验选择两个特异性的干扰质粒转染NHAC-kn细胞。结果表明,RGS1-shRNA1和RGS1-shRNA2均可使RGS1转录水平显著下调,并且RGS1-shRNA1的沉默效率高于RGS1-shRNA2(P<0.05,图2A)。因此,后续实验选用RGS1-shRNA1作为干扰片段。LSP处理6 h显著提高NO含量、i-NOS和COX-2蛋白水平,以及TNF-α和IL-1β转录水平;然而RGS1沉默显著缓解了由LPS诱导的NO含量,i-NOS和COX-2蛋白水平以及TNF-α和IL-1β转录水平的升高(P<0.05,图2B~F)。
3 RGS1-shRNA减弱LPS诱导的MMP-2和MMP-9表达量 见图3,LPS和LPS+shRNA两组中MMP-2和MMP-9水平均显著高于未处理组,而LPS+shRGS1组MMP-2和MMP-9水平显著低于LPS+shRNA组(P<0.05,图3A~D)。
4 RGS1-shRNA抑制MAPK和NF-κB信号的激活 本研究中,为了进一步研究沉默RGS1对LPS介导软骨细胞炎症的缓解作用的潜在机制,我们选择了MAPK和NF-κB两个炎症相关的信号通路进行研究。结果表明抑制RGS1表达可显著缓解由LPS诱导的p-ERK1/2和NF-κB p-p65磷酸化水平上调(P<0.05,图4A、D),然而抑制RGS1对LPS诱导的p-p38和p-JNK磷酸化水平的升高无显著影响(P>0.05,图4B、C)。
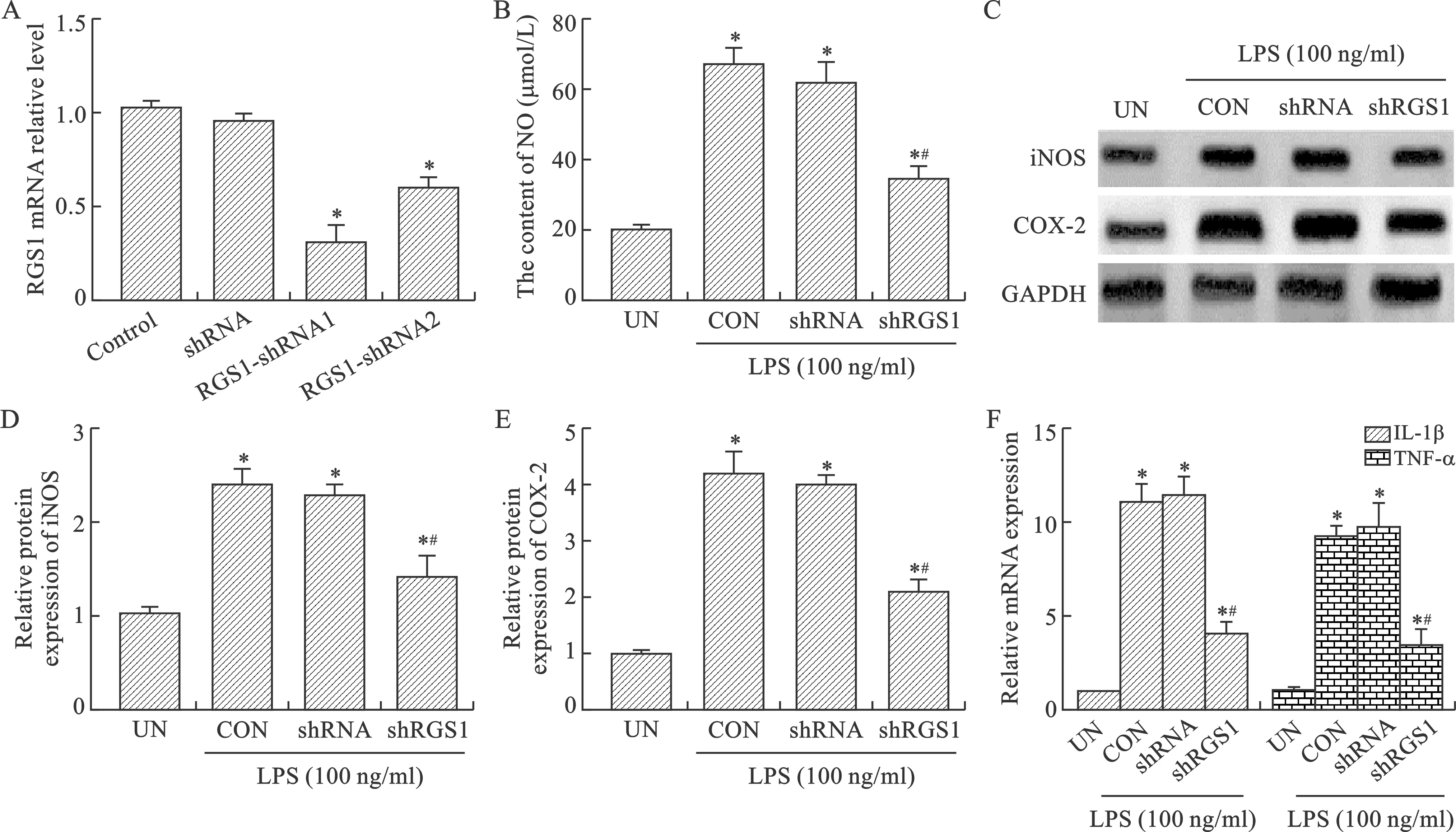
图2 RGS1敲除对软骨细胞炎症反应的影响
讨 论
本实验探究了RGS1在LPS刺激引发的软骨细胞炎症损伤中的效果和可能的机制。实验结果发现LPS(100,500和1000 ng/ml)处理软骨细胞可有效地抑制细胞活性,表明LPS能有效地诱导炎性损伤关节软骨细胞的体外模型。此外,LPS处理软骨细胞可以改变细胞中RGS1的表达量,且其表达量的变化与LPS处理的浓度有关,这与Riekenberg等的研究发现LPS刺激诱导巨噬细胞RGS1的表达量变化是浓度依赖性的结果相似[10]。因此,我们选用100 ng/ml LPS作为体外诱导软骨细胞炎症反应的浓度。
越来越多的证据指出,细胞因子和炎性介质在骨关节炎的发生发展病理过程中扮演着重要的角色,其中炎性介质NO和细胞因子IL-1β和TNF-α为主[11]。有学者研究表明,NO能够抑制蛋白多糖和胶原蛋白的合成,促进软骨细胞凋亡,介导IL-1β和TNF-α参与调节骨关节炎的发生发展[12]。骨关节炎中NO的产生主要由i-NOS来决定[13]。LPS能够刺激软骨细胞i-NOS的表达以及NO的产生,和各种细胞因子如IL-1β共同增加对软骨细胞的伤害[14]。
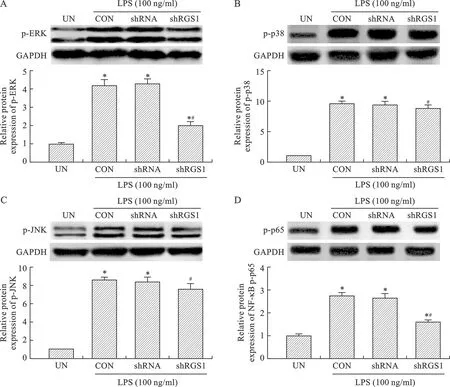
图4 RGS1敲除对软骨细胞MAPK和NF-κB通路蛋白表达的影响
Xu等[7]在类风湿性关节炎中的研究发现,RGS1沉默可抑制炎症反应和血管生产。TNF-α和IL-17诱导的RGS1高度抑制脊柱关节炎的分化[8]。在本研究中,RGS1敲除可以缓解LPS诱导上调的NO含量和i-NOS和COX-2蛋白表达以及细胞因子IL-1β和TNF-α表达水平。
软骨退变在骨关节炎的发生发展中起着重要作用。正常关节中软骨基质的合成和降解是动态平衡的。研究发现,MMPs的过量表达致使关节软骨合成与代谢的失衡,导致软骨细胞外基质分解多于合成,因此提高关节软骨退变的速度[15-16]。MMP-2和MMP-9可以诱导软骨基质成分的分解,在骨性关节炎相关的软骨降解中起关键作用。我们发现RGS1沉默可以显著抑制的MMP-2和MMP-9蛋白表达。这与Hu等研究发现RGS1缺失的类风湿性关节炎小鼠MMP-2和MMP-9蛋白表达显著下降的结果相一致[7]。
MAPK和NF-κB通路在软骨细胞炎症,软骨退化和基质金属蛋白酶调节中发挥着重要作用[17-18]。研究发现,RGS1是许多信号通路的上游效应器包括MAPK信号通路,其主要是通过调节Ga蛋白水平影响信号通路[19]。我们发现沉默RGS1抑制LPS诱导的ERK的磷酸化,但是对p38和JNK的磷酸化却没有抑制作用。Sun等[20]在黑色素瘤中的研究发现RGS1过表达明显促进了ERK的磷酸化,并且RGS1沉默显著降低了EKR的磷酸化水平。此外,Patel等研究发现在小鼠血管平滑肌细胞系中转染RGS1对p38和JNK的磷酸化不起作用[19]。在静止状态下,p65与其抑制因子IκB一起存在于细胞质中。当受到炎症因子刺激LPS,p65磷酸化水平增加并从细胞质转移到细胞核。随后p56促进炎性基因的表达如MMPs,i-NOS和COX-2。本研究结果发现RGS1敲除可抑制NF-κB通路,这与刘星等在小鼠巨噬细胞RAW264.7上的研究结果一致[21]。因此,RGS1缺失抑制LPS诱导的软骨细胞炎症的机制可能是RGS1沉默抑制了ERK和NF-κB信号通路。
综上所述,沉默RGS1减轻LPS刺激介导的软骨细胞炎症损伤,延缓关节软骨退变。其机制可能是沉默RGS1抑制ERK和NF-κB通路的活化。因此,本研究的发现可以为OA的治疗提供理论基础。

