绞股蓝总皂苷预处理对大鼠蛛网膜下腔出血后脑水肿和神经炎症反应的影响*
常 江,张晓乐,余 华,陈 杰,李俊玲
1.陕西省中医医院脑病科 (西安710003) ;2.西安市中医医院妇科(西安710021)
蛛网膜下腔出血(Subarachnoid hemorrhage,SAH)是脑卒中的一种重要类型,大大增加了患者死亡和致残的风险[1-3]。研究证实,早期脑水肿可能是SAH患者脑神经功能症状加剧或死亡的关键因素[4]。研究表明,抗炎可以减轻实验性SAH后的早期脑水肿[5-7],提示抑制SAH后炎症反应可能是缓解SAH后脑水肿及脑损伤的重要策略。绞股蓝总皂苷(Gypenosides)是从葫芦科植物绞股蓝中提得的达玛烷型皂苷,为绞股蓝的重要成分[8-9]。绞股蓝总皂苷具有显著的抗炎效果,可缓解脂多糖诱导的神经炎症反应和认知功能障碍[10-11]。在局灶性脑中风模型中,绞股蓝总皂苷可减轻大鼠神经元的DNA损伤并促进脑室下区的神经干细胞增殖[12]。因此,本研究拟采用血管内穿刺法建立大鼠SAH模型,探讨绞股蓝总皂苷对蛛网膜下腔出血后脑水肿和神经炎症反应的影响。
材料与方法
1 主要材料及设备 绞股蓝总皂苷购自中国医药集团上海化学试剂公司;蛋白提取试剂盒购自武汉博士德生物工程有限公司;Nrf2抗体购自美国Abcam公司;β-actin内参抗体购自美国Santa Cruz公司;大鼠促炎因子TNF-α、IL-6、IL-1β ELISA检测试剂盒由武汉博士德生物工程有限公司提供;TUNEL凋亡检测试剂盒由美国Roche公司提供;Evans blue染色试剂购自美国Sigma公司。
2 SAH模型的建立 正常大鼠用10%水合氯醛(2.5 ml/kg)腹腔注射后,做一正中颈部切口。按顺序清晰显露右侧颈总动脉、颈内动脉、颈外动脉后,4-0尼龙线头经颈外动脉置入右颈内动脉,刺破大脑前动脉和大脑中动脉的分叉处,形成蛛网膜下出血[13-14]。
3 实验分组 体重230~250 g雄性SD大鼠总计96只,购自西安交通大学医学院实验动物中心。将其分为四组(n=24),包括假手术对照组(Sham组)、蛛网膜下腔出血组(SAH组)、绞股蓝总皂苷200 mg/(kg·d)组(GP1组)、绞股蓝总皂苷400 mg/(kg·d)组(GP2组)。Sham组尼龙线不损伤血管壁;SAH组大鼠按照上述方法建立SAH模型;GP1和GP2组大鼠每日口饲绞股蓝总皂苷溶液(溶于无菌生理盐水)200或400 mg/kg共7 d[15],之后建立SAH模型。
4 脑组织水含量和Evans blue外渗率检测 参照文献[13]测量大脑组织水含量。每组取大鼠6只,模型建立后24 h用过量戊巴比妥钠(150 mg/kg)处死大鼠取脑,即刻称得湿重。后再把标本放于100℃的烘箱中,72 h后称重(干重)。脑组织水含量=([湿重-干重] /湿重)×100%。参照文献[16]行Evans blue染色以评估血脑屏障损坏的程度。模型建立后24 h将2%Evans blue溶液(4 ml/kg)注入腹腔,3 h后用100 ml冰PBS液灌注大鼠,之后取出受损大脑右半球。把这些大脑半球样本在PBS中匀浆并离心(30 min,15000 g,4℃),回收上清液。取0.5 ml样本与等量50%三氯乙酸混匀,在4℃下过夜反应后离心(30 min,15000 g,4℃)。最后,Evans blue染色值于分光光度计的610 nm处测得,单位以μg/g表示。
5 Western blot检测和ELISA检测 每组取大鼠6只,模型建立后24 h,过量戊巴比妥钠(150 mg/kg)处死大鼠取脑,加入RIPA裂解液充分裂解。离心后将样本上清均分,一份用于Western blot检测Nrf2蛋白表达水平,另一份用于ELISA法检测脑组织肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)和白细胞介素1β(IL-1β)含量。Western blot检测:10%凝胶电泳后将蛋白电转至PVDF膜上,5%BSA封闭后,加入抗β-actin抗体(1∶500)或抗Nrf2抗体(1∶1000),4 ℃孵育过夜。第2天,使用HRP标记二抗室温孵育PVDF膜0.5 h,用ECL显影液反应并曝光,用Quantity one软件分析条带灰度值。ELISA检测:根据厂家说明书,先后加入生物素化抗体工作液、酶结合工作液、显色剂及终止液,用分光光度计在450 nm处测得吸光度值,并根据标准曲线定量。
6 TUNEL凋亡检测 每组大鼠6只,模型建立24 h后用心脏灌注大鼠,取大脑组织于4%多聚甲醛溶液中固定24 h,常规石蜡包埋后使用切片机将脑组织切成5 μm厚的切片。使用TUNEL凋亡染色试剂盒检测脑组织石蜡包埋切片的凋亡细胞数。用PBS洗涤后,加入rTdT反应混合物于4℃过夜。PBS中漂洗后将切片与辣根过氧化物酶(稀释比例1∶500)室温下反应0.5 h。之后于室温下加入DAB溶液处理10 min。最后,切片在乙醇分级脱水和二甲苯透明后于光镜下(200×)计数,TUNEL阳性细胞细胞核呈现暗褐色。
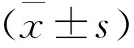
结 果
1 四组大鼠SAH后脑组织水含量及Evans blue外渗率比较 见表1。SAH组大鼠脑水含量明显高于Sham组(P<0.05),而GP1和GP2组大鼠脑水含量明显降低(P<0.05);同时,GP2组大鼠脑含水量低于GP1组(P<0.05)。SAH组损伤半球Evans blue外渗率明显高于Sham组(P<0.05),而GP1和GP2组大鼠的外渗率明显降低(P<0.05);与GP1组比较,GP2组受损脑半球Evans blue外渗率明显降低(P>0.05)。
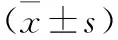
表1 蛛网膜下腔出血后脑水含量和Evans blue外渗率比较
2 四组大鼠SAH后脑组织TNF-α、IL-6、IL-1β含量比较 见表2。SAH组大鼠脑组织炎症因子TNF-α、IL-6、IL-1β含量明显较Sham组增加(P<0.05);而GP1和GP2组大鼠脑组织TNF-α、IL-6、IL-1β含量较SAH组减低(P<0.05);GP2组脑组织IL-6含量较GP1组减低(P<0.05)。

表2 四组大鼠SAH后脑组织TNF-α、IL-6、IL-1β含量比较(ng/mg)
3 四组大鼠SAH后脑凋亡细胞数量和Nrf2蛋白表达水平比较 见表3(图1、2)。
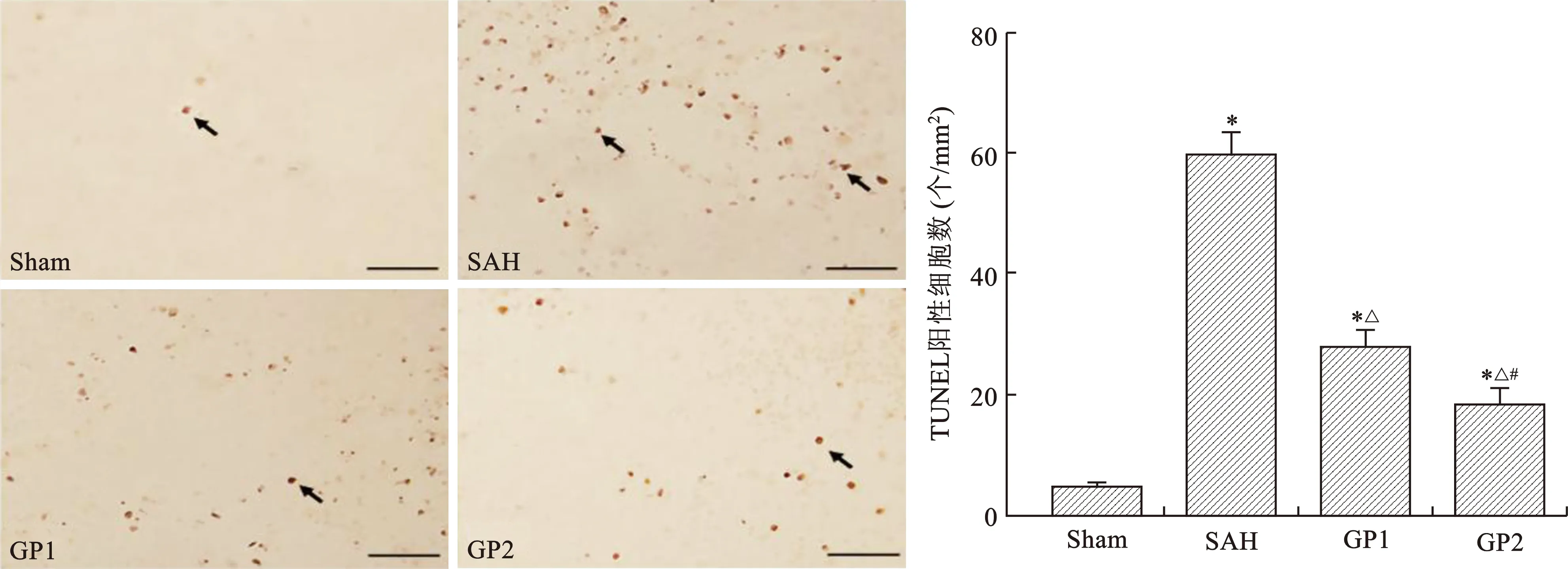
注:与Sham组比较,*P<0.05;与SAH组比较,△P<0.05;与GP1组比较,#P<0.05

注:与Sham组比较,*P<0.05;与SAH组比较,△P<0.05;与GP1组比较,#P<0.05
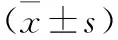
表3 蛛网膜下腔出血后脑组织凋亡细胞数量和Nrf2蛋白表达水平比较
可见,SAH组大鼠脑TUNEL阳性细胞数比Sham组明显增加(P<0.05);而GP1和GP2组大鼠脑TUNEL阳性细胞数显著较少(P<0.05);与GP1组比较,GP2组脑TUNEL阳性凋亡细胞更少(P<0.05)。SAH组大鼠脑Nrf2蛋白比Sham组明显下调(P<0.05);与SAH组比较,GP1和GP2组脑Nrf2蛋白明显增加(P<0.05)。
讨 论
本研究探讨了绞股蓝总皂苷在SAH后早期脑损伤中的抗脑水肿和抗炎作用。结果显示,不同剂量的外源性绞股蓝总皂苷可减轻SAH大鼠的脑水肿,保持血脑屏障完整性,显著下调炎症因子含量并减少细胞凋亡。这就提示,绞股蓝总皂苷预处理可能是预防或缓解SAH患者早期脑损伤的有效替代疗法。
脑水肿是蛛网膜下腔出血后的重要早期病理生理改变,也是导致SAH患者神经功能障碍的重要因素[4]。而神经炎症反应可导致神经元细胞功能损伤和线粒体功能异常,是SAH后脑水肿发生发展的关键机制[17]。本研究采用经典血管内穿刺法建立了大鼠SAH模型,结果显示,SAH后大鼠脑水含量和Evans blue外渗率显著增加,细胞凋亡加重,受损脑皮质中促炎因子TNF-α、IL-6、IL-1β含量明显增加,验证了SAH后脑水肿、血脑屏障破坏、细胞凋亡及神经炎症反应加重的病理生理过程。
已有研究表明,绞股蓝总皂苷在中枢神经系统中具有抗炎作用[10]。本研究进一步证实,绞股蓝总皂苷预处理可显著缓解SAH后促炎因子TNF-α、IL-6、IL-1β等促炎因子的表达。而SAH后这些促炎因子可加重血脑屏障的破坏、细胞凋亡及血管损伤,进而诱发脑水肿和神经功能损伤[18]。本研究结果显示,绞股蓝总皂苷预处理可减轻SAH后大鼠血脑屏障破坏和细胞凋亡。这就提示,绞股蓝总皂苷对SAH大鼠的神经保护作用可能与其抗神经炎症反应作用密切相关。
体外细胞研究已表明,绞股蓝总皂苷预处理比后处理具有更强的神经保护作用[19]。在急性全脑缺血模型中,绞股蓝总皂苷预处理已被证实可减少大鼠神经元DNA损伤[20]。在局灶性脑缺血模型中发现,绞股蓝总皂苷预处理不仅可缓解脑急性缺血再灌注损伤,还能促进脑室下区的神经再生[12]。与之一致,本研究结果表明,绞股蓝总皂苷预处理能有效缓解SAH后出现的脑水肿和神经炎症反应,说明绞股蓝总皂苷对于SAH具有潜在的预防作用。
转录因子Nrf2激活可有效减轻SAH后出现的脑损伤[21]。其作用机制可能与有效阻断细胞氧化应激及炎症相关信号通路相关[22]。已有研究证实,绞股蓝总皂苷的脑保护和抗凋亡作用与Nrf2的激活密切相关。而本研究结果显示绞股蓝总皂苷预处理可显著上调SAH后脑Nrf2的表达,提示SAH后绞股蓝总皂苷的神经保护作用可能与Nrf2激活相关。
综上所述,绞股蓝总皂苷预处理可通过激活Nrf2信号通路减轻蛛网膜下腔出血造成的脑损伤和神经炎症反应。

