鼻用葛根素脂质体温敏凝胶剂的制备与质量评价*
陈 函,廉 婷,2,杜远东,陈 程**,马 宝
(1.西安医学院 药学院,陕西 西安 710021;2.陕西省呼吸病预防及诊治工程研究中心,陕西 西安 710021;3.汉中市食品药品检验检测中心,陕西 汉中 723000)
葛根素(Puerarin)是从豆科植物野葛的干燥根中得到的一种黄酮类化合物,化学名为8-β-D葡萄吡喃糖-4′,7二羟基异黄酮[1]。葛根素具有较为广泛的药理活性,包括降血糖、降血脂、增强免疫力、抗氧化、抗血小板聚集、扩张冠状动脉和脑血管等[2-4]。目前临床葛根素注射液常用于辅助治疗脑血管疾病[5-8],但药动学和组织分布研究表明[9],注射给药后在脑部分布很少,亟待研究一种新型给药途径。药物经鼻黏膜给药,具有吸收迅速、生物利用度高、避免肝脏首过效应等优势,且鼻腔与脑存在生理上独特的联系使其能够实现无创性递药入脑,即脑靶向性好,因此鼻腔给药已成为中枢系统疾病的理想给药途径[10]。近几年,脂质体温敏凝胶应用于黏膜给药的研究报道较多[11-14],其兼具脂质体和凝胶剂双重特性,优势在于药物包封于纸质双分子层内,避免凝胶突释现象,双重缓释特性,且稳定性提高,温敏性凝胶的相变特征使其黏附于鼻黏膜,提高药物滞留时间。基于此,作者以葛根素为研究对象,将其制备成鼻用脂质体温敏凝胶并评价其质量,为葛根素新型制剂开发提供实验依据。
1 实验部分
1.1 原料、试剂与仪器
葛根素:批号201812011,纯度>98%,西安沣禾生物科技有限公司;葛根素对照品:批号S02M9B54875,纯度≥98%,大豆卵磷脂:批号T30M10F84483,胆固醇:批号L27J9F66501,硫酸鱼精蛋白:批号Z05M9H54987,上海源叶生物有限公司。
其他试剂:分析纯,天津市科密欧化学试剂有限公司。
高效液相色谱仪:1260,美国Agilent公司;黏度计:SNB-1,上海方瑞仪器有限公司;马尔文激光粒度仪:ZEN-3600,英国马尔文仪器有限公司;pH计:STARTER2100,奥豪斯仪器有限公司;电子天平:BT125D,赛多利斯科学仪器有限公司;数控超声波清洗器:SB-5200DT,宁波新芝生物科技有限公司;集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 HPLC定量分析
采用HPLC法,色谱柱:Agilent HC-C18柱(250 mm×4.6 nm,5 μm);流动相为V(甲醇)∶V(水)=25∶75;检测波长为250 nm;柱温为(30±0.5)℃;进样量10 μL;流速1 mL/min。
称取葛根素对照品适量,加甲醇溶解并稀释成质量浓度分别为0.1、0.2、1.0、2.0、5.0、20.0 μg/mL的溶液,分别按照上述色谱条件方法进样分析,以峰面积(A)为纵坐标,对照品质量浓度(ρ)为横坐标,绘制标准曲线,并进行线性回归。
1.2.2 供试品溶液、空白供试品溶液的配制
精密移取葛根素脂质体1.0 mL,置于100 mL容量瓶中,加入甲醇超声破囊,过0.45 μm微孔滤膜,取续滤液,备用。除不加药外,在相同条件下得空白供试品溶液,备用。
1.2.3 脂质体包封率和载药量测定
在文献[15]和预实验结果基础上,选择鱼精蛋白凝聚法测定葛根素脂质体的包封率,具体操作为精密移取0.1 mL脂质体溶液,加入ρ(鱼精蛋白)=10 mg/mL的溶液0.2 mL,搅匀,再加生理盐水2 mL,n=3 500 r/min,高速离心15 min,精密移取上清液0.8 mL于1 mL生理盐水中,再加甲醇稀释至10 mL,过0.45 μm微孔滤膜,取续滤液,按照色谱条件进样分析。另取0.1 mL脂质体溶液,加入50倍甲醇进行超声破囊,然后按照色谱条件进样分析。按照公式(1)和(2)计算脂质体包封率和载药量。
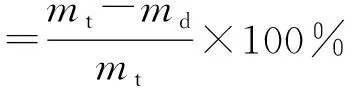
(1)
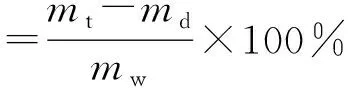
(2)
式中:mt为投入葛根素质量,mg;md为未包封进入脂质体(游离)葛根素质量,mg;mw为载药脂质体总质量,mg。
1.2.4 葛根素脂质体制备工艺筛选
(1)薄膜分散法
精密称取葛根素0.08 g、卵磷脂0.80 g、胆固醇0.20 g,溶于60 mL无水乙醇中,置于茄形瓶中35 ℃恒温水浴减压蒸馏除去乙醇,形成均匀透明的薄膜,将磷酸盐缓冲液(PBS)(pH=7.0)30 mL缓慢注入茄形瓶中旋转水合60 min,转移至具塞三角瓶中,于250 W、34 kHz条件下冰浴超声15 min,得到乳状半透明脂质体溶液,4 ℃下密封保存,备用。
(2)逆向蒸发法
称取卵磷脂0.80 g、胆固醇0.20 g,加入56 mL三氯甲烷和4 mL异丙醇超声溶解,作为油相;称取葛根素0.08 g加入PBS(pH=7.0)溶解并定容至10 mL,作为水相;将水相缓慢加入油相中并超声(60 ℃、90 min)乳化,再减压除去有机溶剂,滴加PBS(pH=7.0)30 mL水化,继续减压蒸发,再超声处理15 min,得到乳状半透明脂质体溶液,4 ℃下密封保存,备用。
(3)乙醇注入法
称取卵磷脂0.80 g、胆固醇0.20 g,用无水乙醇15 mL充分溶解,作为油相;称取0.08 g葛根素,加入PBS(pH=7.0)溶解并定容至10 mL,作为水相;于55 ℃条件下将油相缓慢注入水相中(30 r/min、90 min),得到乳状半透明脂质体溶液,4 ℃下密封保存,备用。
1.2.5 葛根素脂质体质量评价
(1)形态
取脂质体适量,加纯化水稀释,再用w(磷钨酸)=1%的溶液负染色,滴于铜网上,挥干,用透射电镜观察形态。
(2)粒径、电位、PDI
取脂质体适量,加入适量纯化水稀释,置于马尔文激光粒度仪中测定指标。
1.2.6 脂质体凝胶剂的制备
采用冷溶法制备葛根素脂质体温敏凝胶,处方量为w(泊洛沙姆407)=18%和w(泊洛沙姆188)=4%,溶于蒸馏水中,搅拌使其完全溶胀24 h,另取葛根素脂质体混悬液,低速搅拌加入温敏凝胶中,置于4 ℃条件下冷藏,即得。
1.2.7 脂质体凝胶剂的质量评价
(1)pH值
取样品适量,以pH计测定其pH值,平行测定3份样品。
(2)胶凝温度
采用试管倒置法测定胶凝温度,精密移取凝胶溶液2 mL于试管中,将试管置于恒温水浴锅中(试管内液面低于水面),升温速率0.5 ℃/min,测试温度为25~35 ℃,倒置后溶液不流动时温度记为胶凝温度,平行3份样品。
(3)黏度
取样品适量置于SNB-1型旋转型黏度计中测定,平行3份样品。
(4)体外释药行为考察
人工鼻液配制[16]:精密称取磷酸二氢钾13.6 g于纯化水中溶解,加入c(氢氧化钠)=0.1 mol/L的溶液调节pH=6.40,加水至1 000 mL,即得。采用透析袋法考察体外释药特性,分别取葛根素温敏凝胶和葛根素脂质体温敏凝胶2 g置于透析袋中,并放置具塞锥形瓶中,分别加人工鼻液250 mL作为释放介质,锥形瓶置于恒温磁力搅拌器中,条件为t=(33±0.5)℃、n=150 r/min,于0.5、1、2、4、6、8、12、24、36、48 h分别取样5 mL,同时补充同温度同体积介质,样品经0.45 μm过滤,按照1.2.1方法进样分析,计算累积释放度,以时间为横坐标,累积释放度为纵坐标绘制累积释放曲线。
2 结果与讨论
2.1 HPLC定量分析
(1)专属性实验
分别将葛根素对照品、葛根素脂质体供试品、空白脂质体供试品溶液按照1.2.1方法进样分析,结果见图1。
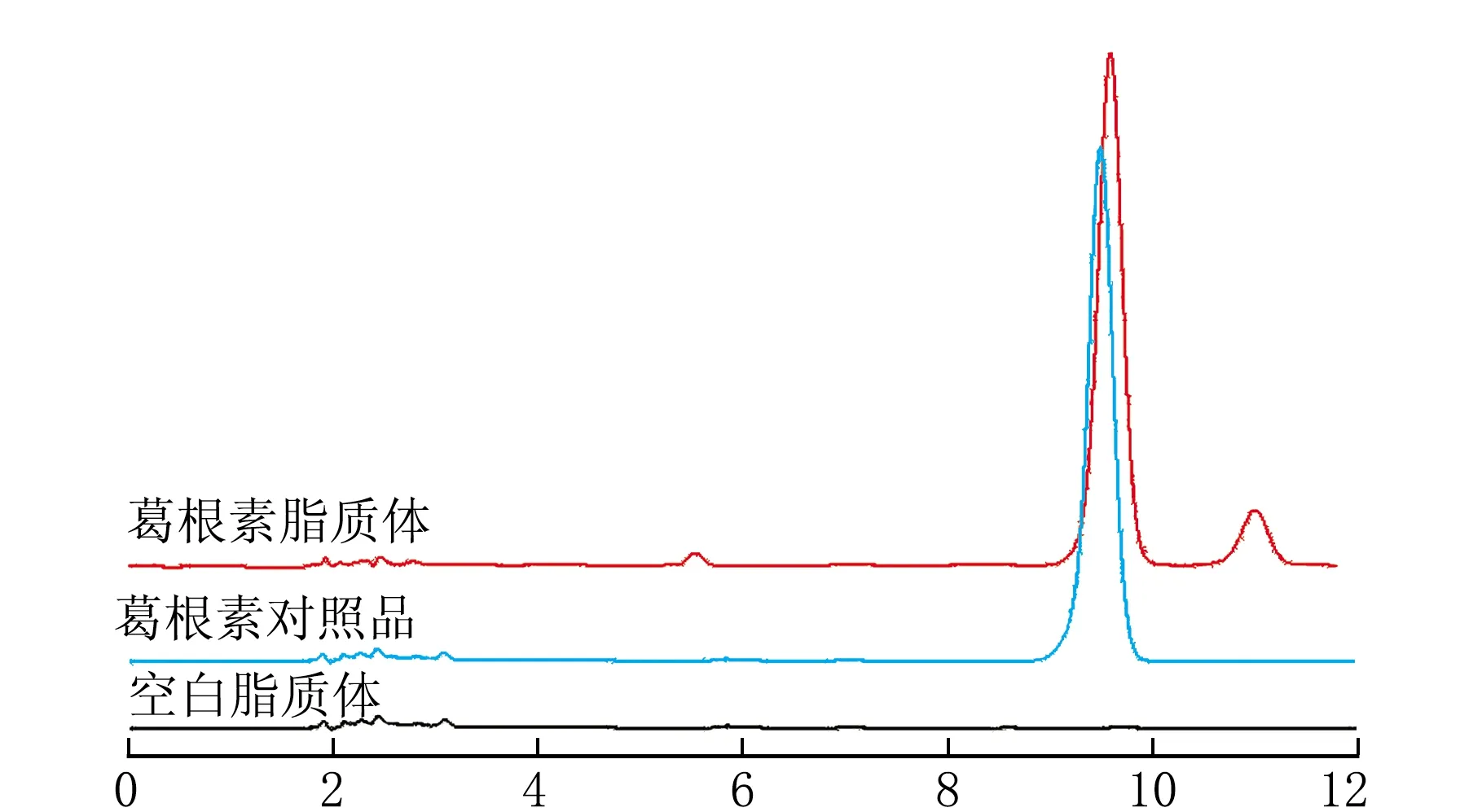
t/min图1 高效液相色谱图
由图1可知,在上述色谱条件下,葛根素色谱峰与杂质峰能够很好分离,且辅料对含量测定无干扰,方法专属性良好。
(2)标准曲线绘制
分别将对照品系列溶液按照1.2.1方法进样分析,以峰面积(A)为纵坐标,对照品质量浓度(ρ)为横坐标,绘制标准曲线,得回归方程为A=1 588.4ρ+113.92,r=0.999 9,结果表明ρ(葛根素)=0.1~20 μg/mL线性关系良好。
(3)精密度实验
精密移取ρ(对照品)=20.0 μg/mL的溶液,按照色谱条件进样6次,且连续测定6 d,测定峰面积,结果日内和日间峰面积RSD分别为0.65%、1.22%,表明仪器精密度良好。
(4)稳定性实验
取葛根素脂质体按照1.2.3方法制样,分别于0、2、4、6、8、24 h按照色谱条件进样分析,结果峰面积的RSD为1.63%,表明样品稳定性良好。
(5)重复性实验
取葛根素脂质体6份分别按照1.2.3方法制样,再按照色谱条件进样分析,结果峰面积的RSD为1.87%,表明该方法重复性良好。
(6)加样回收率实验
取葛根素脂质体9份,每3份1组,按照高中低3个浓度加入对照品溶液,再按照1.2.3方法制样并进样分析,结果平均加样回收率为95.06%,RSD为0.43%。
2.2 葛根素脂质体制备工艺筛选
2.2.1 制备方法筛选结果
分别取脂质体适量,过0.45 μm微孔滤膜,加入PBS(pH=7.0)溶液稀释,置于激光粒度仪测定粒径;采用1.2.3方法测定包封率和载药量,结果见表1。
由表1可知,采用乙醇注入法得到脂质体粒径较小,包封率和载药量2个关键性指标均优于其他2种制备方法。
2.2.2 脂质体处方与工艺参数筛选
根据上述实验结果,初步确定采用乙醇注入法制备葛根素脂质体,但在上述处方与工艺参数条件下脂质体包封率略低,需进一步优化,结合文献资料设定优化方案,采用单因素实验分别考察m(卵磷脂)∶m(胆固醇)、m(葛根素)∶m(卵磷脂)、水化液pH、水化温度对脂质体粒径和包封率的影响,见表2。

表2 葛根素脂质体处方与工艺筛选
由表2可知,单因素实验结果初步筛选出不同因素最佳水平,即m(卵磷脂)∶m(胆固醇)=8∶1、m(葛根素)∶m(卵磷脂)=1∶15、水化液pH=7.0、水化温度55 ℃。
2.2.3 脂质体制备工艺验证
按照上述各因素最佳水平进行验证实验,最优处方为m(卵磷脂)∶m(胆固醇)=8∶1、m(葛根素)∶m(卵磷脂)=1∶15、水化液pH=7.0、水化温度55 ℃;制备3批样品,测得包封率依次为80.07%、79.96%、79.45%,粒径依次为190.0、191.4、191.8 nm,同处方与工艺参数筛选结果基本一致,包封率和粒径数值符合要求,表明该工艺合理可行。
2.3 葛根素脂质体质量评价
2.3.1 形态
葛根素脂质体透射电镜观察形态,结果见图2。

图2 葛根素脂质体透射电镜图
由图2可知,脂质体呈圆形或类圆形,结构完整,分散性良好。
2.3.2 粒径、电位、PDI
经马尔文激光粒度仪测定粒径、电位和PDI的结果见图3和图4。
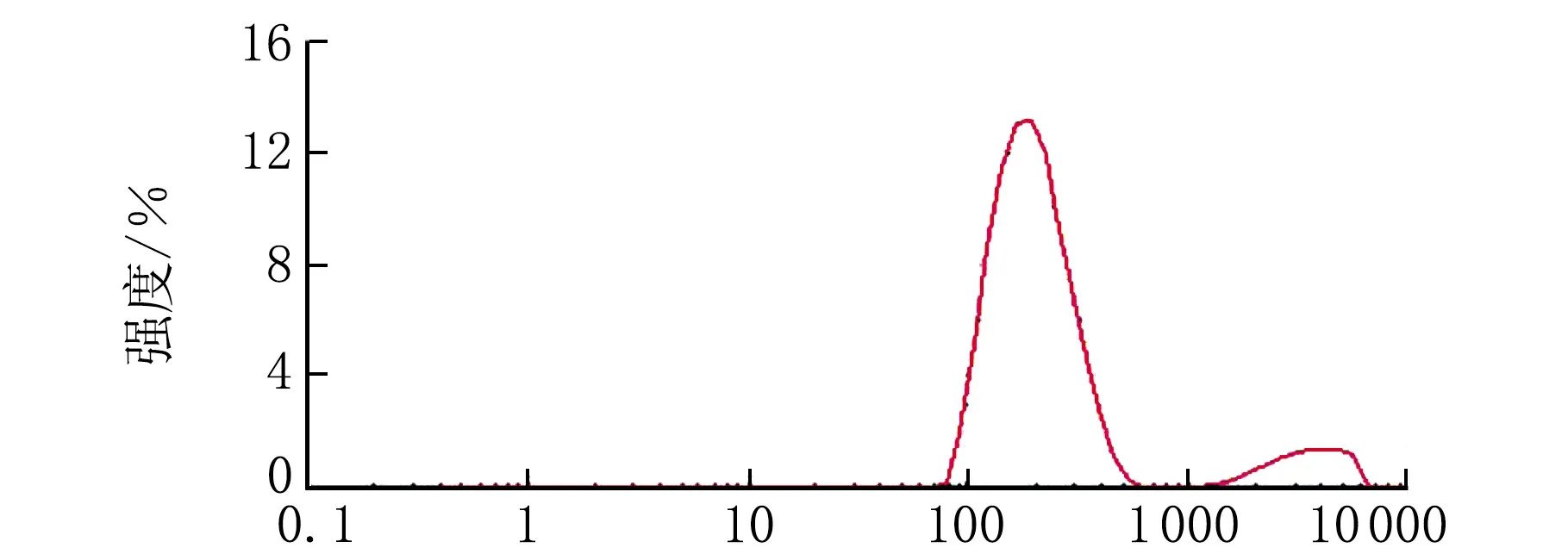
d/nm图3 葛根素脂质体粒度分布
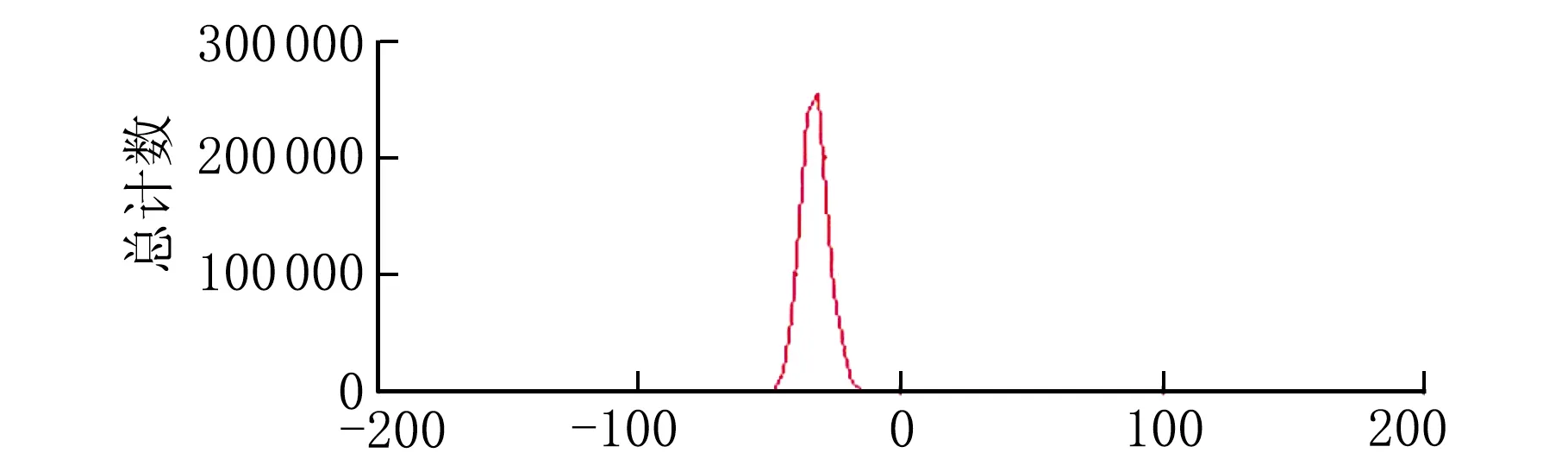
U/mV图4 葛根素脂质体电位图
由图3和图4可知,平均粒径为191.1 nm,PDI为0.202,粒径成正态分布,平均电位为-33.1 mV,说明脂质体稳定性良好。
2.4 脂质体凝胶剂的质量评价
2.4.1 外观
葛根素脂质体温敏凝胶在相变前为质地均匀细腻的淡白色液体,待其达相变温度时为半固体胶状。
2.4.2 pH值测定结果
采用pH计平行测定3份脂质体凝胶剂的pH,结果见表3。

表3 pH测定结果
由表3可知,葛根素脂质温敏凝胶的pH=6.57。
2.4.3 胶凝温度测定结果
采用试管倒置法平行测定3份脂质体凝胶剂的胶凝温度,结果见表4。

表4 胶凝温度测定结果
由表4可知,葛根素脂质温敏凝胶的胶凝温度为32.5 ℃。
2.4.4 黏度测定结果
采用黏度计平行测定3份脂质体凝胶剂的黏度,结果见表5。

表5 黏度测定结果
由表5可知,葛根素脂质温敏凝胶的黏度为52 436 mPa·s。
2.4.5 体外释药行为考察结果
葛根素温敏凝胶和葛根素脂质体温敏凝胶体外累积释放曲线见图5。

t/h图5 葛根素温敏凝胶和葛根素脂质体温敏凝胶体外释药曲线
由图5可知,葛根素温敏凝胶在t=0~6 h处于突释阶段,t≈6 h药物基本释放完成,t≈8 h药物释放达到平衡,累积释放度可达86.34%;葛根素脂质体温敏凝胶释放速度较平缓,36 h累积释放度为78.50%,具有良好缓释效果。
3 结 论
血脑屏障的存在,药物吸收后进入脑实质的量很少,给中枢神经系统疾病的治疗带来很大困难,亟待研究一种新型给药途径,鼻腔给药具有吸收迅速、脑靶向性等优势。基于此,作者选择葛根素为研究对象,将其制备成鼻用脂质体温敏凝胶并评价其质量,处方组成合理,制备工艺简便可行,形态、粒径、电位、包封率、载药量、胶凝温度和体外释药等指标符合要求。葛根素脂质体温敏凝胶利用脂质体药物传递特点与鼻腔给药的便捷性,具有良好的温度敏感性,其达相变温度时为半固体胶状,36 h累积释放度为78.50%,缓释效果明显,但其体内吸收及生物利用度等情况,有待进一步完成体内药动学实验验证。

