安罗替尼联合多西他赛二线治疗驱动基因阴性非小细胞肺癌的疗效和安全性*
臧焕平, 谢 强, 钟爱虹, 朱金秀, 林 恒, 乐雨银
福建医科大学教学医院福州肺科医院肿瘤科,福州 350008
肺癌的发病率在全球恶性肿瘤中位于前列,其中非小细胞肺癌(NSCLC)占80%以上[1]。随着靶向及免疫治疗的发展,晚期肺癌患者的生存期较传统化疗时代明显延长,但是由于肿瘤的异质性及肿瘤微环境的复杂性,仍不可避免会发生耐药。
根据2020年中国临床肿瘤学会(CSCO)原发性肺癌诊疗指南,驱动基因阴性晚期NSCLC患者的一线治疗选择较前增多,包括以铂类为基础的双药化疗联合或不联合抗血管生成或免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗,患者生存质量及生存期较前均有获益;二线可选择多西他赛化疗或ICIs治疗[2]。由于免疫治疗药物的费用高昂及有可能发生危及生命的免疫相关不良反应[3],仍有患者二线选择多西他赛化疗。但多西他赛单药二线治疗的有效率不足10%,患者中位总生存期仅5~8个月[4]。如何提高多西他赛二线治疗的疗效,延长患者生存期为当前临床研究方向之一。
多项临床研究表明,抗血管生成药物联合化疗可产生协同抗肿瘤作用,延缓肿瘤耐药[5],可能与抗血管生成药物可使肿瘤血管消退、密度降低、通透性增强,使化疗药物更易渗透至肿瘤病灶有关。安罗替尼(anlotinib)是新型小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),作用靶点多,可抗肿瘤血管生成、抑制肿瘤细胞增殖、促进肿瘤细胞凋亡,其为口服剂型,用药方便,已在我国获批用于晚期NSCLC的三线治疗[6]。在联合化疗方面已有报道,安罗替尼联合吉西他滨、顺铂一线治疗晚期NSCLC可提高疗效,降低胸腔积液中血管内皮生长因子(VEGF)水平,不良反应无明显增多[7]。有关安罗替尼联合多西他赛二线治疗驱动基因阴性晚期NSCLC的报道较少,本研究进行了小样本探索,现将结果报道如下。
1 资料与方法
1.1 一般资料
本研究为单中心、开放性、随机、对照研究,选取2019年5月至2020年3月由福建省福州肺科医院肿瘤科收治的晚期NSCLC患者60例,按随机数字表法随机进入研究组和对照组,每组30例。纳入标准:①年龄18~75岁,ECOG 0~1分;②经病理学确诊为NSCLC;③根据RESIST 1.1标准,具有可测量病灶,对于既往接受过放疗的病灶,只有当放疗结束3个月后出现过明确的疾病进展,才可被选为靶病灶;④EGFR、ALK、ROS1基因阴性;⑤经过一线治疗后发生疾病进展,分期为晚期或局部晚期;⑥预计生存期≥3个月;⑦主要器官功能及实验室指标符合要求。排除标准:①小细胞肺癌,包括小细胞与非小细胞复合型肺癌;②中央型、伴有空洞的肺鳞癌或伴有咯血(大于50 mL/d)的NSCLC患者;③有症状或症状控制时间少于2个月的脑转移患者;④入组前4周内接受肺野胸部放疗或尚未从放疗相关毒性中恢复的患者;⑤存在栓塞或活动性出血;⑥一线应用过多西他赛或安罗替尼;⑦高血压未控制;⑧妊娠及哺乳期女性;⑨具有不适合入组的其他情况,如伴有精神疾病、依从性差等。本研究通过医院伦理委员会审查批准,所有患者和/或家属治疗前均被告知目前标准治疗方案、替代治疗方案及可能产生的不良事件,签署知情同意书。
1.2 治疗方案
研究组:多西他赛75 mg/m2,静脉滴注1 h,d1,每21天为1个周期,4~6周期,联合安罗替尼,12 mg/d,早餐前口服,用药2周停1周,每21天为1个周期,至疾病进展或发生不可耐受的毒性反应,如出现漏服,确认距下次用药时间<12 h时,不再补服;对照组:多西他赛75 mg/m2,静脉滴注1 h,d1,每21天为1个周期,4~6周期。疾病进展后对照组可口服安罗替尼,两组患者疾病进展后均可行其他抗肿瘤方案,所有患者均随访至疾病进展或死亡。治疗药物分别为多西他赛注射液(江苏恒瑞医药股份有限公司,0.5 mL∶20 mg/支,国药准字H20020543),盐酸安罗替尼胶囊(正大天晴药业集团,12 mg/粒,或10 mg/粒,或8 mg/粒,国药准字H20180002)。两组患者化疗前1 d开始每天口服地塞米松16 mg,连服3 d,并给予最佳支持治疗。出现不良反应者,予以对症或降剂量或停药处理。
1.3 疗效及不良反应评价
采用RECIST 1.1标准[8]进行疗效评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。其中CR为所有靶病灶消失,全部病理淋巴结(包括靶和非靶)短直径必须缩小至<10 mm,4周后确认;PR为靶灶最长径之和(SLD)较基线缩小≥30%,4周后确认;SD为介于部分缓解与疾病进展之间;PD为以最小靶灶SLD为标准,靶灶SLD增大≥20%,且绝对值增加≥5 mm,出现新的靶病灶或非靶灶持续明确的进展。客观缓解率(objective response rate,ORR)为(CR+PR病例数)/可评价病例数×100%,疾病控制率(disease control rate,DCR)为(CR+PR+SD病例数)/可评价病例数×100%。无进展生存期(PFS)指由开始用药至有客观证据证实的疾病进展,或任何原因引起死亡的时间,若在随访截止时患者未发生疾病进展或死亡,以最后一次评估的日期计算。总生存期(OS)指由开始用药至患者死亡或最后一次随访或失访日期。不良反应采用CTCAE v4.03进行评价。全分析集(full analysis set,FAS)指所有经随机化分组、至少应用了1次研究药物的受试者。符合方案集(perprotocol set,PPS)指严格按照方案执行试验过程的受试者。研究中每2个周期复查胸部CT、腹部彩超、脑MRI、体表淋巴结彩超进行疗效评价,每个周期完善血尿粪常规、粪隐血及血生化、肿瘤标志物、甲状腺功能、心肌酶、心电图等相关检查,必要时行心脏彩超、骨ECT、24 h尿蛋白测定,并进行体格检查。本研究的主要观察指标为客观缓解率(ORR)、疾病控制率(DCR),次要观察指标为无进展生存期(PFS)、总生存期(OS)及安全性。
1.4 统计学方法
采用SPSS 20.0进行统计学分析,频数资料用百分比(%)表示,频数资料组间比较采用χ2检验,生存分析采用Kaplan-Meier法,生存期组间比较采用Log-rank法,以P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般情况
研究组和对照组的中位年龄分别为61(33~72)岁和58(36~75)岁,两组患者的性别、年龄、病理类型、分期、远处转移情况、吸烟状态、一线治疗情况等基线特征具有可比性(均P>0.05,表1)。
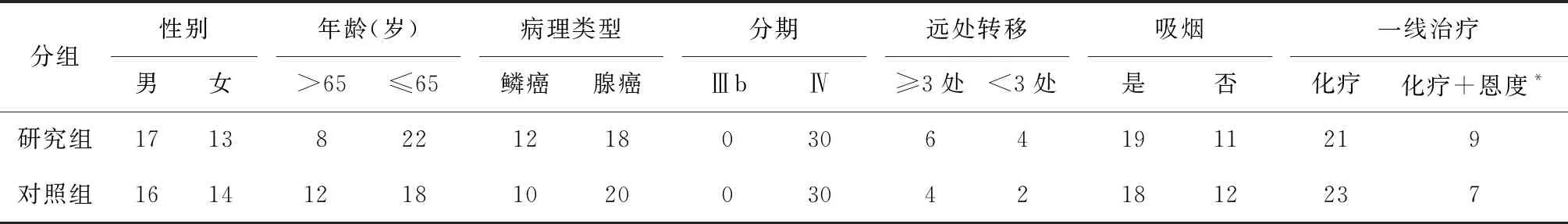
表1 两组患者基线资料Table 1 Baseline characteristics about the patients of the two groups
2.2 近期疗效
研究组中位化疗3个周期,安罗替尼中位口服7.4周期,对照组中位化疗3个周期,对照组有13例疾病进展后口服安罗替尼,中位口服3.0个周期。两组均无病例达到CR,但研究组ORR、DCR均高于对照组(均P<0.05),见表2。

表2 两组近期疗效比较[n(%)]Table 2 Comparison of short-term efficacy between the two groups[n(%)]
2.3 无进展生存期
截止2020年6月10日,两组病例均发生了疾病进展,无失访病例。其中研究组有2例分别服用安罗替尼2个和3个周期后因经济困难停用,最佳疗效均为SD,有1~2级乏力和食欲下降,无其他明显副反应。全分析集(FAS)研究组和对照组的中位PFS分别为3.61个月和2.28个月,差异有统计学意义(HR=0.35,95%CI:0.19~0.62,P<0.01),见图1;符合方案集(剔除研究组2例因经济困难停服安罗替尼的病例,PPS)研究组和对照组的中位PFS分别为3.62个月和2.23个月,差异有统计学意义(HR=0.32,95%CI:0.18~0.58,P<0.01),与全分析集相近。研究组FAS中亚组分析腺癌和鳞癌的中位PFS分别为3.62个月和3.27个月,差异无统计学意义(HR=0.93,95%CI:0.44~1.94,P=0.834),见图2;PPS中腺癌和鳞癌的中位PFS分别为3.70个月和3.27个月,差异无统计学意义(HR=0.82,95%CI:0.38~1.76,P=0.593),与全分析集相近。
2.4 总生存期
截止2020年6月10日,研究组有4例患者仍存活,其中1例接受ICIs联合安罗替尼治疗,1例接受ICIs联合化疗,2例口服安罗替尼,病情均稳定,余26例疾病进展后仅接受了最佳支持治疗,已死亡;对照组有3例仍存活,其中1例脑转移患者疾病进展后选择ICIs联合安罗替尼治疗,2例口服安罗替尼,病情稳定,余27例死亡病例中的10例疾病进展后选择安罗替尼治疗,17例选择最佳支持治疗。全分析集(FAS)研究组和对照组的中位OS分别为6.00个月和4.40个月,差异有统计学意义(HR=0.46,95%CI:0.26~0.81,P=0.002),见图3;符合方案集(PPS)研究组和对照组的中位OS分别为6.00个月和4.40个月,差异有统计学意义(HR=0.44,95%CI:0.25~0.79,P=0.002),与全分析集相近。研究组FAS中亚组分析示腺癌和鳞癌的中位OS分别为6.30和5.40个月,差异无统计学意义(HR=0.87,95%CI:0.39~1.95,P=0.294),见图4;研究组PPS中腺癌和鳞癌的中位OS亦分别为6.30和5.40个月,差异无统计学意义(HR=0.62,95%CI:0.23~1.47,P=0.223)。因两组患者疾病进展后更换其他抗肿瘤方案病例较少,考虑研究组中位OS的延长主要为安罗替尼联合用药所致。
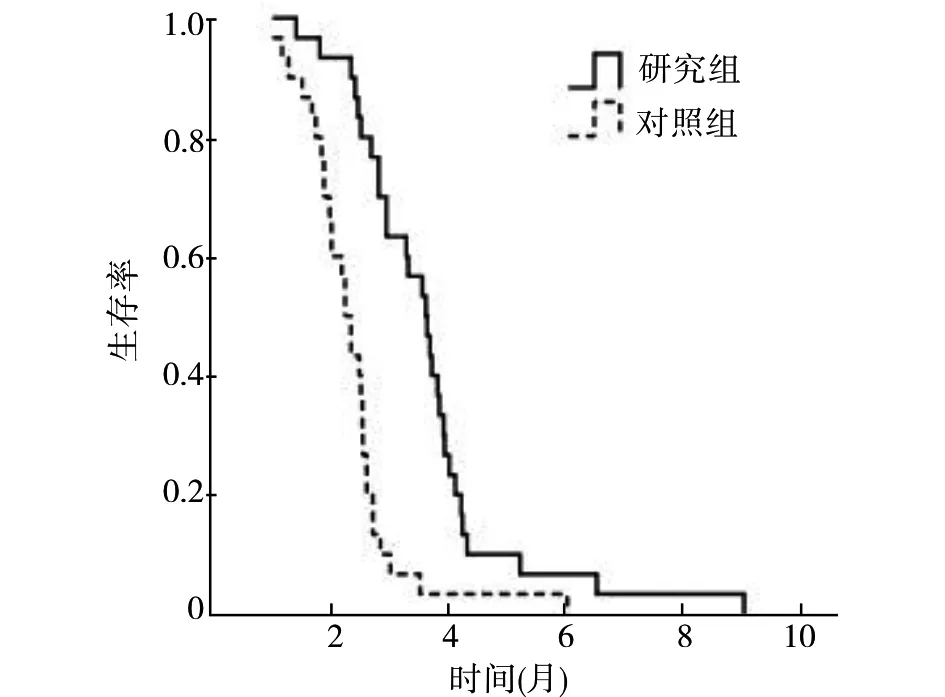
图1 全分析集两组无进展生存期Fig.1 Progression-free survival in FAS of the two groups
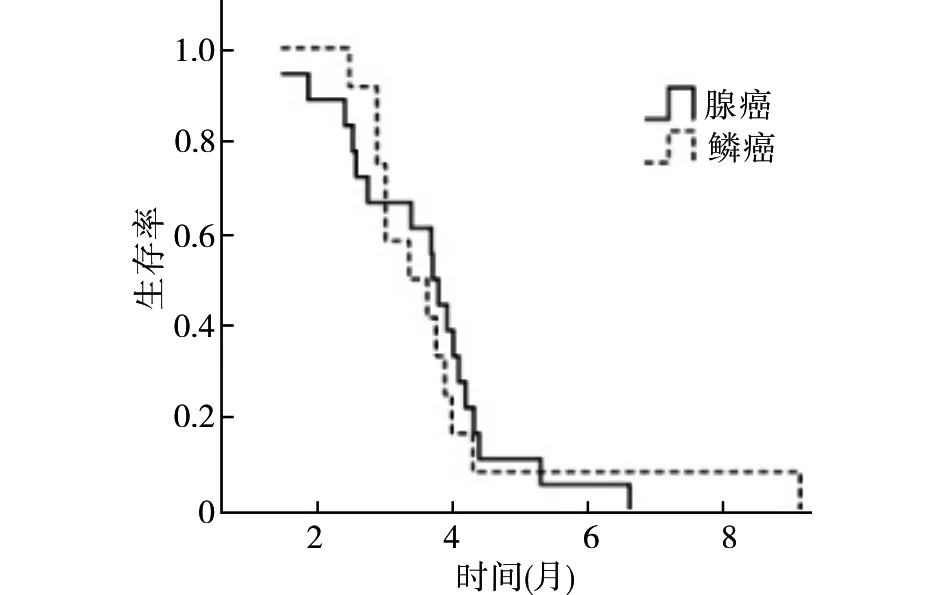
图2 研究组全分析集亚组无进展生存期Fig.2 The subgroup analysis of progression-free survival in FAS of the study group
图3 全分析集两组总生存期Fig.3 Overall survival in FAS of the two groups
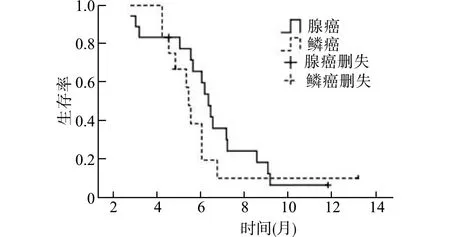
图4 研究组全分析集亚组总生存期Fig.4 The subgroup analysis of overall survival in FAS of the study group
2.5 不良反应及安全性
研究组的不良反应有1~3级血液学毒性、1~2级手足皮肤反应、食欲下降、乏力、高血压、蛋白尿、咯血、高脂血症,未发生甲状腺及肝功能异常。对照组不良反应有1~3级血液学毒性、1~2级食欲下降、乏力、手足皮肤反应。两组不良反应经调整剂量、对症处理、必要时请皮肤科等相关科室诊治均可缓解。研究组中有6例患者安罗替尼剂量下调至10 mg/d,研究组和对照组分别有6例和4例患者多西他赛剂量下调至60 mg/m2。两组各不良反应发生率无显著差异(均P>0.05,表3),均无患者发生4级不良反应和治疗相关性死亡。
3 讨论
非小细胞肺癌二线治疗的经典研究REVEL及LUME-Lung 1表明,抗VEGF受体(VEGFR)雷莫芦单抗和小分子多靶点TKI尼达尼布联合多西他赛二线治疗NSCLC可提高疗效[9-10],但均未区分EGFR突变状态,且雷莫芦单抗需静脉用药,两种药物均获批用于非鳞NSCLC,存在一定的用药不便及局限性。
多项研究表明小分子多靶点抗血管生成药物如索拉非尼、舒尼替尼、凡德他尼等,联合化疗或单药用于晚期NSCLC在Ⅰ、Ⅱ期临床研究中显示出较好的抗肿瘤效应,但Ⅲ期临床研究中患者获益不多,不良反应明显增加[11]。
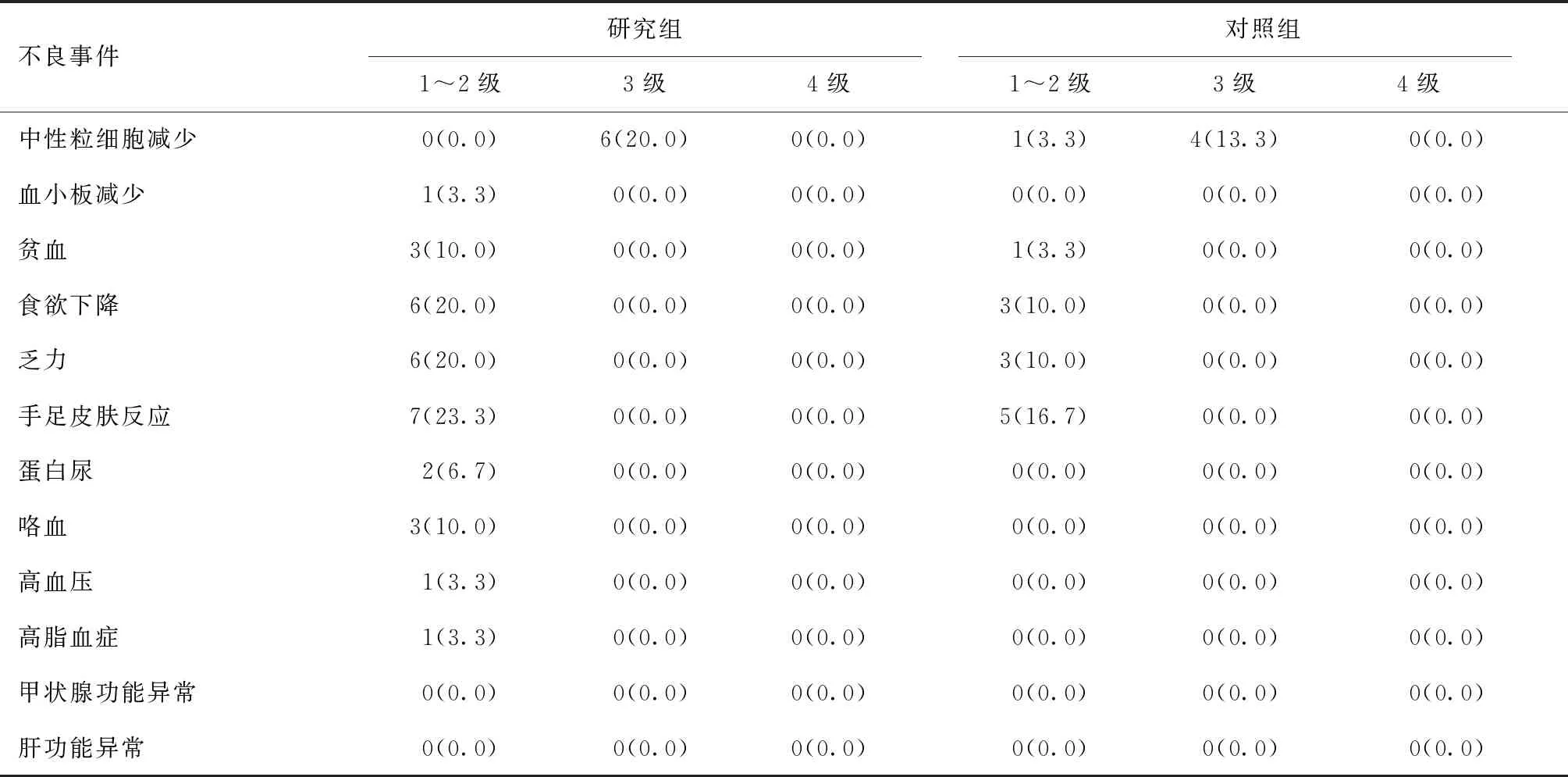
表3 两组不良反应发生情况[n(%)]Table 3 The incidence of adverse effects in the two groups[n(%)]
安罗替尼是新型小分子TKI,可强效抑制VEGFR1~3、血小板衍生生长因子受体(PDGFR)α和β、成纤维细胞生长因子受体(FGFR)1~4和干细胞生长因子受体c-Kit等多个靶点[12-13],被用于肺癌、软组织肉瘤、甲状腺癌等多种实体瘤的治疗[14]。Ⅰ期临床研究显示,安罗替尼血药浓度呈非剂量依赖性,并最终确定给药剂量为12 mg/d,口服2周停药1周,避免药物蓄积[15]。Ⅲ期随机安慰剂对照研究ALTER0303显示安罗替尼三线治疗晚期NSCLC延长了PFS和OS,且EGFR突变组较野生组获益更多[16],贝伐珠单抗联合紫杉醇、卡铂一线治疗非鳞NSCLC的BEYOND研究也得出类似结论[17],提示EGFR突变可作为预后的生物标志物;亚组分析示腺癌PFS及OS均有获益,而鳞癌及其他亚组PFS获益更多。
有关安罗替尼联合化疗用于驱动基因阴性晚期NSCLC二线治疗的报道较少。赵论等[18]在《中华全科医学》杂志上发表了关于安罗替尼联合多西他赛二线治疗无驱动基因晚期NSCLC的回顾性单臂临床观察。该研究显示其中位PFS为4.5个月,长于本研究的3.61个月,考虑与其纳入部分Ⅲb期患者有关,而本研究纳入的均为Ⅳ期病例,且部分为多发远处(脑、骨、肝等)转移病例,总体预后不佳。吴炳群等[19]研究发现,脑、骨、肝及多器官转移患者的中位生存期分别为6个月、5个月、4个月和3个月。本研究两组中位OS均较短,考虑与以下因素有关:①入组均为Ⅳ期、驱动基因阴性人群,65岁以上病例占1/3左右,且包含一线应用过其他抗血管生成药物的患者;②治疗药物的副反应如纳差、手足皮肤反应等影响患者持续用药;③安罗替尼二线应用未被纳入医保报销范围,且价格较高,经济负担重,部分患者自行停药(研究组中的2例,疗效均为SD,无3~4级不良反应);④一线应用抗血管药物的人群,血管靶向通路有被抑制可能。亚组分析示研究组腺癌的中位PFS、中位OS稍长于鳞癌,但差异无统计学意义,尚需扩大样本量进一步研究联合方案在不同病理类型晚期NSCLC人群中的疗效差异;临床也观察到年龄小于65岁的患者联合用药耐受性好,疗效也较好。
安罗替尼为多靶点抗血管生成药物,毒副反应与其他多靶点TKIs如阿帕替尼、尼达尼布等有所相似,如皮肤损害、胃肠道反应、高血压、蛋白尿、出血、乏力[20]。本研究中,部分患者因胃肠道反应、乏力等下调剂量或暂停用药,临床中也观察到安罗替尼下调至每日10 mg或8 mg联合化疗时患者耐受性较好。研究组发生的1~2级高血压、咯血,给予降压及止血等治疗均能改善。研究组3级中性粒细胞减少的发生率稍高于对照组,考虑主要为化疗药多西他赛引起,予以重组人粒细胞集落刺激因子及下调剂量后好转。郭运杰等[21]研究显示抗VEGFR-2药物阿帕替尼联合多西他赛二线治疗非鳞NSCLC对比多西他赛可延长PFS,而3级血液学毒性明显增加。在LUME-Lung 1研究团队的一项研究中,尼达尼布联合多西他赛组3级及以上毒副反应明显增多,主要为腹泻及转氨酶升高[22],说明不同的抗血管生成药物作用于每个靶点的强度有所差异。
综上所述,安罗替尼联合多西他赛二线治疗驱动基因阴性晚期NSCLC在近期疗效及生存期上均有获益趋势,同时,联合用药的不良事件相对增多,但均可管理。鉴于临床条件所限,本研究尚存在不足之处,如非盲法、无安慰剂对照、样本量小等。此联合用药模式还需扩大样本量,谨慎选择目标人群,探索联合用药的适宜剂量,兼顾疗效及安全性,并期待安罗替尼价格更加惠民,在延长生存期的同时,减轻患者经济压力。

