OSAHS患者外周血Th17细胞相关细胞因子的表达及临床意义*
章哪哪, 李本农, 许伟民, 李艳妮
武汉市第四医院,华中科技大学同济医学院附属普爱医院耳鼻咽喉科,武汉 430034
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是一种常见的慢性睡眠呼吸性疾病,由睡眠时反复上气道阻塞引起,可引发呼吸暂停和低通气。OSAHS在全世界范围内是一种高发病率疾病,在男性中发病率为34%,女性约为17%[1]。OSAHS患者在睡眠时可伴发巨大鼾声、慢性间歇性缺氧、反复出现微觉醒、睡眠结构紊乱等[2]。越来越多研究表明OSAHS引起的慢性间歇性缺氧能造成体内交感神经系统激活,氧化活性产物大量生成及慢性炎症因子产生[3],这些细胞因子和炎症细胞的刺激导致体内一系列炎症反应,如嗜中性粒细胞募集、组织破坏、新生血管形成等,对人体各靶器官造成损害。已有研究显示如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-10等细胞因子在OSAHS患者中存在高表达[4],经过治疗后,细胞因子引起的炎症反应减轻[5-7]。Th17细胞作为一种新型的T淋巴细胞,在机体的炎症反应、免疫应答、自身免疫性疾病和肿瘤等的发生发展中具有重要意义,尤其在免疫应答及呼吸系统慢性炎症性疾病中起着重要的作用[8],其核转录因子为RORγt,主要分泌IL-17、IL-6、IL-23等细胞因子。作为一种促进炎症及免疫调节的重要细胞,关于Th17在OSAHS中病理生理作用的研究尚少。本研究通过对不同严重程度OSAHS患者外周血中的Th17细胞及相关细胞因子进行系统研究,探讨Th17细胞及相关因子IL-17、IL-23、IL-6与OSAHS病情程度的关系。
1 资料与方法
1.1 临床资料
选取2018年1月至2018年12月在我科行多导睡眠监测(polysommogram,PSG)的患者,排除过敏性鼻炎、哮喘、风湿性关节炎及其他免疫性疾病,近4周内未服用抗组胺药、糖皮质激素等药物。研究资料包括患者的性别、年龄及体质量指数(BMI)、最低血氧饱和度、睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)。本研究获得武汉市第四医院伦理委员会批准。
1.2 主要试剂和仪器
RORγt抗体(eBioscience,美国),BCA试剂盒(Thermo Forma,美国),IL-17、IL-23、IL-6 ELISA试剂盒(武汉博士德),酶标仪(Bio-Rad,美国),美国邦德安佰S7000多道睡眠监测系统。
1.3 实验方法
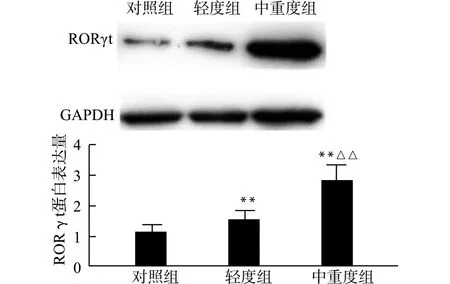
1.3.1 AHI的测定 采用标准的PSG进行检测,并用睡眠软件进行睡眠分析。由专业技术人员依据美国睡眠医学会(AASM)发布的“睡眠及相关事件判读手册”[9]对睡眠软件分析后的结果进行判读,并计算出AHI,依据AHI值将患者分为对照组15例(AHI≤5次/h)、轻度组20例(5 1.3.2 标本的收集与处理 采集研究对象清晨静脉血6 mL,分2份,1份离心,取血清,用于酶联免疫吸附实验(ELISA)测定细胞因子,1份肝素抗凝,1 h内用淋巴细胞分离液以Ficoll密度梯度法分离出外周血淋巴细胞,经含1%小牛血清的PBS洗涤后,制备淋巴细胞悬液,用于免疫印迹检测。 1.3.3 酶联免疫吸附实验(ELISA) 取患者血清,按照IL-17、IL-23、IL-6的ELISA检测试剂盒说明书检测IL-17、IL-23、IL-6,通过A值计算相应浓度。 1.3.4 免疫印迹法(Western blot)检测核转录因子RORγt 吸出淋巴细胞悬液置于离心管中,PBS洗涤后加200 μL含蛋白酶抑制剂的裂解液,冰上充分裂解40 min后,4℃、12000 r /min离心20 min;吸取上清,用BCA法测蛋白浓度,并调整浓度一致。100℃水浴5 min使蛋白变性后进行SDS-PAGE电泳,转膜,5%脱脂奶粉封闭2 h,洗涤3次后加入兔抗RORγt多克隆抗体(1∶2000)4℃孵育过夜,次日洗膜;加入辣根过氧化物酶标记山羊抗兔二抗(1∶5000)室温孵育1 h,洗膜,ECL化学发光法成像,扫描仪采集图像后用Image J图像分析软件对各图像灰度值进行半定量。 3组患者平均年龄、性别、BMI均无统计学差异,AHI及最低血氧饱和度比较均有统计学差异,具体见表1。 表1 研究对象一般情况比较Table 1 Comparison of clinical characteristics of participants 通过ELISA检测比较各组血清IL-17浓度,中重度组高于轻度组及对照组,各组间比较差异均有统计学意义(均P<0.01);血清IL-23浓度,中重度组高于轻度组及对照组,各组间差异均有统计学意义(均P<0.01);血清IL-6浓度,中重度组高于轻度组及对照组,各组间差异均有统计学意义(均P<0.01),见表2。 表2 各组血清中细胞因子水平比较Table 2 Comparison of cytokines in serum in each 免疫印迹法检测显示,中重度组患者外周血淋巴细胞中Th17细胞核转录因子RORγt蛋白表达较轻度组及对照组高,三组间差异有统计学意义(F=169.86,P<0.01),各组间比较,差异均有统计学意义(均P<0.01)。见图1。 与对照组比较,**P<0.01;与轻度组比较,△△P<0.01图1 免疫印迹法检测各组RORγt蛋白表达情况Fig.1 Detection of expression of RORγt protein in each group by Western blotting 通过相关性分析发现IL-17血清含量和AHI呈正相关(r=0.95,P<0.01),IL-23含量和AHI呈正相关(r=0.87,P<0.01),IL-6含量和AHI呈正相关(r=0.92,P<0.01),RORγt蛋白表达量和AHI呈正相关(r=0.91,P<0.01),见图2。 A:IL-17血清含量和AHI呈正相关;B:IL-23含量和AHI呈正相关;C:IL-6含量和AHI呈正相关;D:RORγt蛋白表达量和AHI呈正相关图2 IL-17、IL-6、IL-23、RORγt蛋白表达量和AHI的关系Fig.2 The correlation of IL-17,IL-6,IL-23,RORγt protein expression and AHI 慢性间断性缺氧是OSAHS的主要病理生理特点[10],和缺血再灌注损伤有一定相似性[11],由于长期的间歇性缺氧,OSAHS患者的高碳酸血症使中性粒细胞等炎性细胞应激性增多,相关炎症细胞因子浓度随之增加[10]。RORγt是Th17细胞分化和分泌IL-17A的关键核转录因子,可诱导Th0细胞分化成熟为Th17细胞,而IL-17、IL-6、IL-23是Th17细胞分化的主要细胞因子。本研究发现中重度OSAHS患者外周血淋巴细胞RORγt蛋白表达较轻度组及对照组高,中重度组血清IL-17、IL-6、IL-23等细胞因子较轻度组及对照组高,提示OSAHS程度越重,即慢性间歇性缺氧程度越重,Th17细胞分化增加,其分泌的相关细胞因子增加。这可能和OSAHS患者夜间缺氧达到一定程度时,造成缺氧诱导因子1(HIF-1)表达增加有关。有研究显示HIF-1能促使Th17分化增加[12],也有研究认为间歇性低氧能诱导NF-κB活化[13],产生更多的促炎因子如IL-6等,并抑制CD4+淋巴细胞向Treg细胞分化,联合TGF-β,通过Jak/STAT3信号诱导CD4+淋巴细胞细胞向Th17分化[14-15]。本研究显示细胞因子IL-6在中重度组较轻度组及对照组高,这和相关研究一致[16],有研究认为缺氧引起的低氧血症和高碳酸血症能使交感神经兴奋,导致血中儿茶酚胺类物质的浓度升高,又进一步促进IL-6分泌,导致OSAHS患者血清IL-6水平的上升,IL-6既能在OSAHS的炎症中起着重要作用,也能促进Th17细胞分化[17]。Th17细胞分泌的IL-23是促进原始T细胞向Th17细胞分化的关键细胞因子[18],已有报道IL-23在OSAHS中表达增加,但具体机制尚不清楚,可能和Th17细胞分化增加有关。 OSAHS诊断的金标准是PSG,AHI是评价其严重程度的指标[19],本研究显示OSAHS患者外周血淋巴细胞RORγt蛋白含量、血清IL-17、IL-6、IL-23水平均和AHI呈正相关。国外也有研究显示某些血清学指标如CRP、IL-6和OSAHS严重程度呈相关性[20],因此试图将其作为评价OSAHS严重程度的一种补充检测。有研究认为在越严重的间歇性低氧环境中,研究对象的炎症反应更严重[14],而Th17细胞作为重要的促炎细胞,其细胞数量及分泌的细胞因子因此增加,这些炎性因子水平显著升高可能是诱发和加重OSAHS的重要调控机制之一。但由于本研究样本量的限制,Th17细胞及其细胞因子水平能否作为评价OSAHS严重程度的指标,还有待进一步研究。同时尚需密切随访经长期持续正压通气治疗后的OSAHS患者,以其体内Th17细胞及相关炎症因子的变化情况作横断面研究。 综上所述,OSAHS是一种慢性炎症性疾病,Th17细胞及其细胞因子介导的炎性反应可能在OSAHS的病理生理过程中起着重要的作用,且与OSAHS的严重程度有关。阻断这些细胞因子,可望成为减少OSAHS病理损伤的新途径。1.4 统计学方法
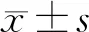
2 结果
2.1 一般资料
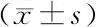
2.2 各组血清IL-17、IL-23、IL-6浓度
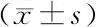
2.3 RORγt蛋白表达情况
2.4 AHI与血清Th17相关细胞因子及外周血淋巴细胞RORγt水平的相关性

3 讨论

