SOCS3在脂多糖诱导体外氧糖剥夺大脑皮层细胞药理性预适应中的作用*
潘琳娜, 樊 萍, 刘海云, 李建斌, 宋志坚, 马炜林, 潘 旭, 吕 青
1江西省中西医结合医院(江西中医药大学附属中西医结合医院)神经内科,南昌 330003 2江西中医药大学生理学系,南昌 33000 3华中科技大学同济医学院基础医学院药理学系,武汉 430030
脑缺血预适应(ischemia preconditioning,IPC)现象是指脑组织经短暂非致死性缺血缺氧刺激后,获得的对随后长时程致死性缺血缺氧的耐受力和保护作用[1],但是因为缺血预处理是一种伤害性应激过程,其在临床应用上受到了极大的限制。药理性预适应是在缺血预适应的理论基础上,通过药物模拟缺血预适应样作用,对脑缺血损伤产生保护作用,具有很好临床应用价值。Toll样受体(Toll like receptors,TLRs)是脑缺血再灌注损伤中最主要的炎症应答触发器[2-3]。在脑缺血再灌注过程中,损伤组织及坏死细胞产生内源性配体与胶质细胞表面的TLR2和TLR4等TLRs结合,诱导下游炎性因子如TNF-α、IL-1、IL-6和IL-12和粘附分子CD86等大量产生,促进脑缺血损伤进一步加重[4]。而另据报道,小剂量TLR4配体脂多糖(lipopolysaccharides,LPS)及其下游的炎性因子TNF-α和IL-6均能诱导脑缺血耐受,减少脑梗死体积[5]。综上提示:LPS药理预适应过程中,适度激活TLR4,进而诱导产生适度的细胞因子,可能通过某种机制抑制随后缺血再灌注脑组织的炎症信号通路,抑制脑组织过度炎症反应,从而发挥保护作用,但具体机制目前还未见研究报道。
细胞因子信号抑制分子(suppressors of cytokine signaling,SOCS)是JAK-STAT信号通路的重要靶基因[6],SOCS反馈抑制多种细胞因子的信号通路并抑制NF-κB活化从而调节机体对细胞因子的过度刺激[7]。SOCS家族中的SOCS1和SOCS3在中枢神经系统分布广泛[8],SOCS3为JAK2激活STAT3后的靶蛋白,近年来在中枢神经系统的研究发现SOCS3可能参与了脑缺血耐受形成[9-11]。那么SOCS3是否也参与LPS诱导的药理性预适应,此过程中SOCS3激活是否依赖JAK2-STAT3途径,SOCS3激活后是否可通过抑制炎性通路起保护作用,目前未见研究报道。为验证以上假设,我们建立了大脑皮层混合培养神经细胞氧糖剥夺(oxygen-glucose deprivation,OGD)损伤模型,观察LPS药理性预适应对氧糖剥夺损伤大脑皮层细胞的保护作用,及其是否与JAK2-STAT3-SOCS3信号通路和炎性通路两通路之间的相互调控有关。
1 材料与方法
1.1 实验动物及材料
新生SD大鼠,雌雄不计,由华中科技大学同济医学院实验动物中心提供。
LPS(Sigma公司),DMEM/F12培养液、胎牛血清、Neurobasal培养液(Gibco公司),3-(4,5)-2-噻唑-(2,5)-二苯基溴化四氮唑蓝(MTT)(AMERESCO公司),乳酸脱氢酶(LDH)试剂盒(Roche公司),IL-6、IL-1β、TNF-ɑ ELISA检测试剂盒(ABclonal公司),SOCS3、p-JAK2一抗(Abcam公司),JAK2、STAT3、GAPDH、β-tublin一抗(Proteintech公司),p-STAT3一抗(Cell Signaling Technology公司),二抗均购自武汉三鹰生物技术有限公司。二氧化碳培养箱(SHELL/JB,美国),超净工作台(苏州净化设备有限公司),XDS-1B倒置显微镜(重庆光电仪器有限公司),DYY-8C型电泳仪、小型水平摇床(北京六一仪器厂),转膜槽(JY-ZY2,北京君意东方电泳设备有限公司),pH计[DELTA320,梅特勒(上海)有限公司],90-2定时恒温磁力搅拌器(上海沪西分析仪器厂),精密电子天平(Sartorius公司,德国),电动匀浆机(R104,IKA公司,德国),台式高速低温离心机(Biofuge-24 RHeraeus公司,德国),-80℃超低温冰箱(Thermo公司,美国),Elx800酶标仪(Bio Tek仪器公司,美国),凝胶成像分析系统(Alpha公司,美国)。
1.2 实验方法
1.2.1 大脑皮层细胞培养 取新生(1 d以内)的SD大鼠乳鼠,用75%乙醇消毒3次。在超净台中装有冰冷D-Hank’s混合液的培养皿内,将乳鼠断头后分离颅骨取出大脑,充分剥离脑膜。将皮质组织转移至盛有DMEM/F12的青霉素小瓶中,剪碎成1 mm3大小的组织碎块,加入等体积的0.25%胰蛋白酶,吹打混匀,37℃消化5 min,加入含20%胎牛血清的完全培养液终止消化。用200目滤网过滤至离心管中,1000 r/min离心5 min,弃上清。在细胞沉淀中加入适量的Neurobasal培养液(含10%B27、100 U/mL青霉素、100 U/mL链霉素)重悬细胞,使用细胞计数板计数,调整细胞密度至1×106/mL,接种于预先用0.1%多聚赖氨酸包被过夜的培养皿或者培养板中。24 h后完全培养液全量换液,以后根据需要每2~3天换液1次,实验于体外培养第8天进行[12]。
1.2.2 实验分组和模型的建立 实验分为空白对照组(Control组),溶剂对照组(Sham组)、单纯低剂量(0.02 μg/mL)LPS作用组(LLPS+Sham组)、单纯高剂量(0.05 μg/mL)LPS作用组(HLPS+Sham组)、氧糖剥夺(OGD)损伤组(OGD组)、低剂量LPS预处理后进行OGD损伤组(LLPS+OGD组)、高剂量LPS预处理后进行OGD损伤组(HLPS+OGD组)。脑皮层细胞培养方式及氧糖剥夺模型建立方法:各LPS作用组预先48 h给予相应剂量LPS,需进行OGD的组别取原代培养10 d的大脑皮层细胞,采用物理氧糖剥夺方法[13]进行OGD损伤造模,OGD损伤2 h后将培养液更换为正常培养液,放入正常CO2培养箱中,模拟再灌注过程,24 h后进行相应实验。
1.2.3 细胞活性及损伤的检测 MTT法检测细胞活性:大脑皮层细胞OGD 2 h再灌注24 h后用D-Hank’s液洗3遍,每孔给予0.5 g/L MTT 200 μL,培养箱(37℃,95% O2,5%CO2)内孵育4 h,结束后吸弃上清液,每孔加入150 μL DMSO,在恒温振荡器振荡10 min,充分溶解甲臜,在全自动酶标仪上562 nm处测定其吸光度(A562 nm)值。LDH释放实验检测细胞损伤:OGD 2 h再灌注24 h后,收集细胞培养上清液,另设一阳性对照,该组细胞经过2% Triton-100充分破膜,作为细胞LDH最大释放量。收集细胞上清液,按照LDH检测试剂盒说明书检测492 nm处吸光度值(A492nm)。细胞损伤程度以LDH百分释放量表示,LDH百分释放量=(测定组A492nm值-空白对照A492nm值)/(阳性对照A492nm值-空白对照A492nm值)×100%。
1.2.4 ELISA法测定细胞培养上清IL-6、IL-1β、TNF-ɑ含量 细胞OGD 2 h再灌注24 h后,收集培养上清,参照试剂盒说明及参考文献[14]进行ELISA检测。
1.2.5 Western blot检测大脑皮层细胞JAK2-STAT3-SOCS3信号通路相关蛋白表达 在培养有细胞的35 mm培养皿中加入80 μL含蛋白酶抑制剂及磷酸化蛋白酶抑制剂的冰冷蛋白裂解液提取蛋白,参照文献[14]方法进行Western blot。各一抗稀释比例分别为:抗SOCS3(1∶1000),抗p-JAK2(1∶1000),抗JAK2(1∶1000),抗p-STAT3(1∶1000),抗STAT3(1∶1000),抗β-tublin(1∶5000),抗β-actin(1∶3000),抗GAPDH(1∶3000)。
1.3 统计学方法
采用SPSS 18.0统计软件进行统计学分析,组间均数比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 LPS预适应对OGD大脑皮层细胞活性及损伤的影响
2.1.1 MTT检测细胞活力 以Control组大脑皮层细胞活力为100%,与Control组比较,Sham组、LLPS+Sham组、HLPS+Sham组细胞活力无明显差异;OGD组与Sham组比较,差异有统计学意义;LLPS+OGD组、HLPS+OGD组细胞活力与OGD组比较有明显提高,差异有统计学意义。结果见图1。
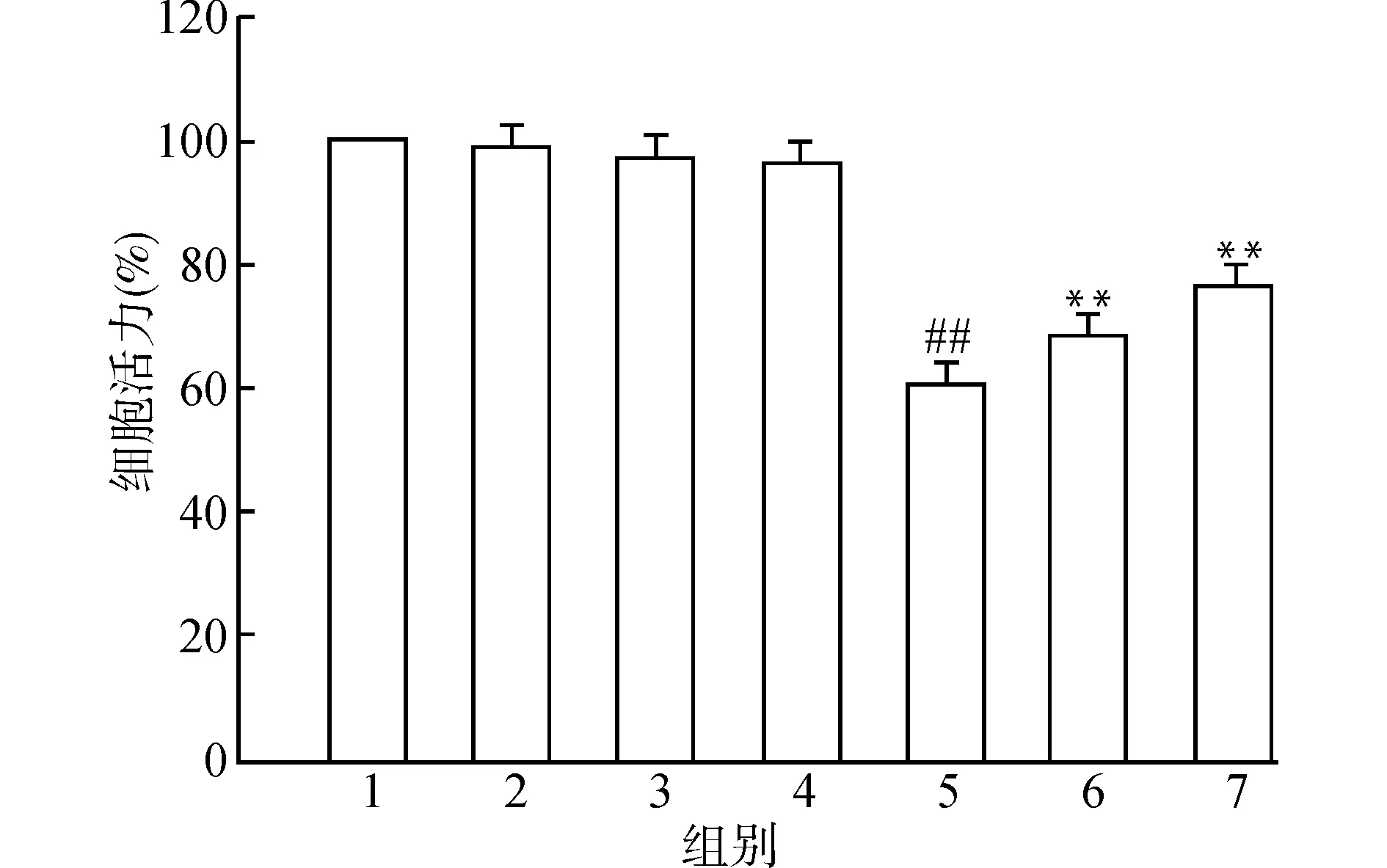
1:Control;2:Sham;3:LLPS+Sham;4:HLPS+Sham;5:OGD;6:LLPS+OGD;7:HLPS+OGD;与Sham组比较,##P<0.01;与OGD组比较,**P<0.01;n=6图1 MTT检测LPS药理性预适应对OGD 2 h复氧24 h后大脑皮层细胞活力的影响Fig.1 Effect of LPS preconditioning by prior sublethal OGD on cell viability after lethal OGD detected by MTT assay
2.1.2 LDH释放量的检测 Control组细胞LDH释放量为(18.77±2.93)%;与Control组比较,Sham组、LLPS+Sham组、HLPS+Sham组细胞损伤程度的差异无统计学意义;OGD组与Sham组比较,差异有统计学意义。LLPS+OGD组、HLPS+OGD组与OGD组比较,LDH释放量明显减少,差异统计学有意义。结果见图2。
2.2 LPS预适应对大脑皮层细胞OGD损伤后炎性因子表达的影响
如图3所示,与Control组比较,Sham组培养上清中炎性因子IL-6、IL-1β和TNF-α的表达无明显差异。与Sham组比较,LLPS+Sham和HLPS+Sham组炎性因子IL-6、IL-1β和TNF-α的表达有升高趋势,但差异无统计学意义,而OGD组IL-6、IL-1β和TNF-α的表达明显升高,差异有统计学意义;与OGD组比较,LLPS+OGD组和HLPS+OGD组炎性因子IL-6、IL-1β、TNF-α的表达明显下降,差异有统计学意义。
2.3 Western blot检测JAK2-STAT3-SOCS3信号通路相关蛋白表达
如图4所示,与Sham组比较,LLPS+Sham、HLPS+Sham组p-JAK2/JAK2比值、p-STAT3/STAT3比值、SOCS3表达有升高趋势,OGD组p-JAK2/JAK2比值、p-STAT3/STAT3比值、SOCS3表达明显升高,差异有统计学意义;与OGD组比较,LLPS+OGD、HLPS+OGD组SOCS3表达明显升高,p-JAK2/JAK2、p-STAT3/STAT3明显下降。
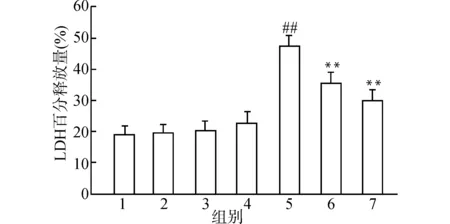
1:Control;2:Sham;3:LLPS+Sham;4:HLPS+Sham;5:OGD;6:LLPS+OGD;7:HLPS+OGD;与Sham组比较,##P<0.01;与OGD组比较,**P<0.01;n=6图2 LPS药理性预适应对OGD 2 h复氧24 h后大脑皮层细胞损伤的影响Fig.2 Effects of LPS preconditioning by prior sublethal OGD on the leakage of LDH
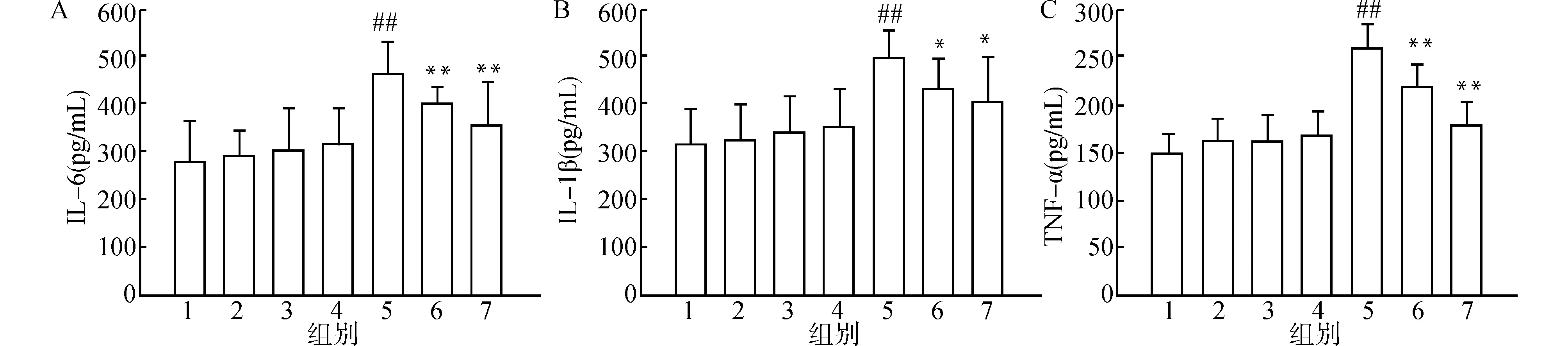
1:Control;2:Sham;3:LLPS+Sham;4:HLPS+Sham;5:OGD;6:LLPS+OGD;7:HLPS+OGD;A:ELISA检测大脑皮层细胞培养上清IL-6水平;B:ELISA检测大脑皮层细胞培养上清IL-1β水平;C:ELISA检测大脑皮层细胞培养上清TNF-ɑ水平;与Sham组比较,##P<0.01;与OGD组比较,*P<0.05 **P<0.01;n=6图3 ELISA检测LPS药理性预适应对大脑皮层细胞OGD损伤后炎性因子分泌量的影响Fig.3 Effect of LPS preconditioning by prior sublethal OGD on the release of cytokines from cells subjected to OGD detected by ELISA
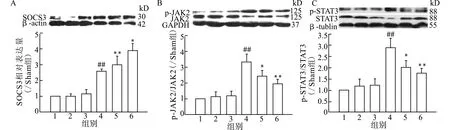
1:Sham;2:LLPS+Sham;3:HLPS+Sham;4:OGD;5:LLPS+OGD;6:HLPS+OGD;A:大脑皮层细胞SOCS3总蛋白表达的变化;B:大脑皮层细胞p-JAK2/JAK2蛋白比值的表达变化;C:大脑皮层细胞p-STAT3/STAT3蛋白比值的变化;与Sham组比较,##P<0.01;与OGD组比较,*P<0.05 **P<0.01;n=3图4 LPS药理性预适应对OGD损伤后大脑皮层细胞SOCS3-JAK2-STAT3信号通路各节点蛋白表达的影响Fig.4 Effect of LPS preconditioning by prior sublethal OGD on the expression of SOCS3-JAK2-STAT3 signaling pathway proteins from cells after OGD in vitro detected by Western blotting
3 讨论
在脑缺血及复灌过程中,损伤组织及坏死细胞释放出内源性配体与胶质细胞表面的TLRs结合,其中TLR4分布最为广泛,通过激活下游MyD88炎性信号通路,最终导致转录因子NF-κB和AP-1活化,诱导IL-1β、IL-6、TNF-ɑ、IL-8和IL-12等炎性因子产生,加重脑缺血损伤[7]。在本研究中,大脑皮层细胞OGD 2 h复氧糖后细胞IL-6、IL-1β、TNF-α表达升高,与之相符合。如前所述,由TLR4介导的MyD88信号通路触发免疫炎症反应是促进脑缺血及再灌注后损伤加重的关键因素。
LPS又称内毒素、脂多糖,为革兰阴性菌细胞壁的主要成分,能刺激机体产生炎症反应。研究表明,LPS可与脑内胶质细胞膜上的CD14结合,激活Toll样受体,以及髓样分化因子88(MyD88)依赖性信号通路,最终激活核因子pNF-κB通路和丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK),介导促炎性细胞因子如TNF-α、IL-1和IL-6等的释放和免疫系统的活化,导致神经元损伤[15-16]。
LPS为TLR4的特异性配体,有研究证明小剂量LPS能减少脑梗死体积[5]。在敲除TLR4基因的小鼠,脑缺血预适应保护作用消失[11]。依上述结果推测,在小剂量LPS预处理过程中TLR4被激活,诱发轻微炎症反应,释放炎症因子作为内源性配体,并通过内在信号通路抑制缺血后炎症反应,发挥神经细胞保护作用。在本研究中,我们发现,小剂量的LPS可引起大脑皮层细胞TLR4-MyD88-炎性因子信号通路蛋白轻微上调,而预先给予小剂量LPS对缺血再灌注损伤的乳鼠大脑皮层细胞有保护作用。
SOCS家族是一组蛋白质家族,目前已发现SOCS家族有8个成员,结构相似,均包括了N区、中央区的SH2结构域和C端保守序列SOCS盒[17]。其中,SOCS3可被JAK2/STAT3激活,同时SOCS3可通过负性调节JAK2/STAT3细胞因子信号转导途径发挥一定作用[18-19]。有研究报道,外周细胞因子TNF-α、IL-6和IL-1与其受体结合后,能激活JAK-STAT途径,STATs在细胞凋亡过程中也起着重要作用[20],外周组织IL-6、IL-1、TNF-α等细胞因子与SOCS家族受体结合后,激活JAK-STAT途径,导致STAT磷酸化,然后二聚体化,转入细胞核内与DNA上的特定调节序列结合诱导各种细胞因子调节基因(包括SOCS)的表达。同时,SOCS在细胞因子信号通路中起负反馈调节作用,广泛参与了细胞因子信号的调节。
本实验中,我们发现在脑缺血再灌注的小鼠缺血脑组织中,SOCS3、p-JAK2、p-STAT3表达升高,小剂量的LPS预处理可以促进SOCS3产生,与之前的研究结果相符,同时TLR4下游信号通路蛋白被抑制。因此我们认为,在LPS诱导的药理性预适应过程中,适度激活TLR4信号通路,以及适度激活MyD88、NF-κB和MAPK,诱导细胞因子如TNF-α、IL-1β和IL-6等生成增多,这些细胞因子作用于相应受体后激活JAK2-STAT3信号通路诱导生成SOCS3;当机体再次遭遇致死性脑缺血时,已经提前激活的SOCS3可能通过快速抑制缺血期TLR4-MyD88致炎信号通路激活而抑制炎症反应进而发挥脑缺血保护作用。

