球形氧化镁的控制合成研究
朱华阳,仲剑初,于本儒,刘建行,罗鑫虎
(1.大连理工大学化工学院,辽宁大连116024;2.辽宁省硼镁特种功能材料制备与应用技术工程实验室;3.辽宁省硼镁资源化工与新材料工程技术研究中心)
球形氧化镁由于具有较大的表面积、物理强度及较高的导热率等特性,可以在色谱法中作为固定相材料,也可以作为吸附有毒物质的吸附剂,以及作为导热材料添加到塑料中提高复合材料的导热性,作为一种无机功能材料其用途十分广泛。球形氧化镁的制备一般以球形碱式碳酸镁[1]或球形氢氧化镁[2-4]为前驱体,经过煅烧获得。以氢氧化镁为前驱体制备氧化镁时,主要以硫酸镁为原料;氯化镁是一种价廉的含镁原料,因此研究开发以氯化镁为原料制备球形氧化镁的新工艺有着十分重要的经济意义。笔者以氯化镁、氢氧化钠和氨水为原料,以聚乙烯吡咯烷酮为控制剂,经静态反应得到了球形氢氧化镁,后经煅烧得到颗粒大小均匀、球形度高的球形氧化镁。系统考察了控制剂种类、控制剂用量、反应物浓度、反应时间等条件对氧化镁形貌的影响。
1 实验部分
1.1 试剂和仪器
试剂:六水氯化镁、氢氧化钠、聚乙烯吡咯烷酮、氨水,均为分析纯;去离子水。
仪器:SmartLab 9型X射线衍射仪、QUANTA-450型扫描电子显微镜、SA-CP3-10型离心粒度分布仪。
1.2 球形氧化镁的制备
向氯化镁溶液中加入一定量聚乙烯吡咯烷酮,再滴加氢氧化钠溶液,搅拌混匀,得到氢氧化镁晶种溶液,将晶种溶液和氨水分别置于不同培养皿中,放于密闭容器中静态反应一段时间。反应结束后,对溶液中白色沉淀进行过滤洗涤,滤饼在105℃下于烘箱中干燥5 h,得到Mg(OH)2前驱体。将Mg(OH)2前驱体置于马弗炉中在600℃下煅烧2 h得到产物MgO。
2 结果与分析
2.1 控制剂种类及用量对Mg(OH)2形貌的影响
室温下,取1 mol/L氯化镁溶液25 mL,一组实验为不添加控制剂和分别按氯化镁干质量1.0%(质量分数,下同)加入聚乙烯吡咯烷酮(PVP)、十二烷基苯磺酸钠(SDBS)、十二烷基硫酸钠(SDS)等3种不同的控制剂,另一组按氯化镁干质量加入一定量(0、0.5%、1.0%和2.0%)的PVP,再在搅拌下滴加25 mL 0.25 mol/L氢氧化钠溶液,将反应后的溶液和氨水分别置于不同培养皿中,放于密闭容器中静态反应24 h。在不同控制剂种类和不同PVP用量下,得到的球形氢氧化镁前驱体SEM照片见图1。从图1a可见,未添加控制剂时得到的氢氧化镁形貌不规则,仅有极少类球形颗粒;从图1b~1d可见,添加控制剂后,氢氧化镁多为球形颗粒,且球形度高,说明添加控制剂对氢氧化镁形貌有显著的控制作用,其中控制效果PVP、SDS优于SDBS。聚乙烯吡咯烷酮水溶性好,操作简便,在反应过程中,一方面它的长分子链可以包覆颗粒表面防止所形成的粒子发生团聚,起到表面活性剂的作用;另一方面聚乙烯吡咯烷酮分子会选择性地吸附在特定的晶面上,导致这个晶面的生长速率慢于其他晶面,从而起到控制形貌的作用[5-6],故选用PVP作控制剂。
由图1e、1f可见,随着PVP用量的增加,球形氢氧化镁逐渐增多,且分散性提高。由图1g可见,继续加大PVP用量,氢氧化镁又出现不规则块状,有团聚现象。这可能是由于低浓度时,PVP在溶液中延展成线型,而PVP分子结构中的强极性基团内酰胺将溶液中形成的Mg(OH)2晶核中的羟基从不同方向吸附在聚合高分子链上,或者吸附溶液中的OH-形成Mg(OH)2晶核;随着PVP用量的增加,PVP在溶液中达到一定浓度,高分子链交联成网状结构。随着PVP浓度进一步增加,在立体空间中网状结构又相互交联成立体球型,Mg(OH)2晶核即在其诱导下生长为由薄片状结构单元组成的Mg(OH)2微球[7];随着PVP浓度进一步增加,PVP高分子链数量急剧增加,占据较多的空间,而其在溶液中不能够得到充分的延展,产物Mg(OH)2再次出现团聚现象。综上所述,最佳的控制剂为PVP,最佳用量为1.0%。

图1 不同控制剂和不同PVP用量制得的氢氧化镁SEM照片
2.2 反应物浓度对Mg(OH)2形貌的影响
室温下,向25 mL一定浓度的氯化镁溶液中加入1.0%的PVP,再在搅拌下滴加25 mL一定浓度的氢氧化钠,将反应后的溶液和氨水分别置于不同培养皿中,放于密闭容器中静态反应24 h。在不同的氯化镁和氢氧化钠浓度配比下,得到的球形氢氧化镁前驱体SEM照片见图2。

图2 不同氯化镁与氢氧化钠浓度比制得的氢氧化镁SEM照片
由图2a可知,未添加NaOH时,得到的Mg(OH)2形貌不规则。由图2b、2c、2e、2f可知,当MgCl2与NaOH物质的量比为4∶1,MgCl2溶液浓度为0.5 mol/L时,得到的球形Mg(OH)2球体孔隙较大,结构松散;当MgCl2与NaOH物质的量比为4∶1、MgCl2溶液浓度为1.0 mol/L时,得到的Mg(OH)2球形度高,分散性好,球体结构密实。由图2d可知,当MgCl2与NaOH物质的量比为2∶1、MgCl2溶液浓度为1.0 mol/L时,得到球形和不规则块状的Mg(OH)2。综上所述,当MgCl2与NaOH物质的量比为4∶1、MgCl2溶液浓度为1.0 mol/L、NaOH溶液浓度为0.25 mol/L时,得到Mg(OH)2的球形度最高,单体分散性最好,球体结构密实。
2.3 反应时间对Mg(OH)2形貌的影响
室温下,取1 mol/L氯化镁溶液25 mL,加入1%的PVP,再在搅拌下滴加0.25 mol/L氢氧化钠溶液25 mL,将反应后的溶液和氨水分别置于不同培养皿中,分别放于密闭容器中静态反应6、18、24、30 h。图3为不同反应时间下的氢氧化镁SEM照片。由图3a~3b可以看出,反应时间较短时产物颗粒单体分散性较差,形貌不规则;当反应24 h时,球形氢氧化镁形貌规则,单体分散性好(图3c);而随着反应时间的延长,产物形貌又变得不规则(图3d)。综上所述,较佳的反应时间为24 h。

图3 不同反应时间制得的氢氧化镁SEM照片
2.4 球形MgO的制备及表征
将制得的球形氢氧化镁前驱物在600℃下煅烧2 h,得到球形氧化镁产物。图4为球形氢氧化镁和球形氧化镁的XRD谱图。图5为煅烧获得的球形氧化镁的SEM照片。由图4可知,前驱物氢氧化镁和产物氧化镁的XRD衍射数据与氢氧化镁衍射标准卡片(PDF 44-1482)、氧化镁衍射标准卡片(PDF 45-0946)相符合,峰型窄而尖锐,峰型较强,晶体的结晶度好。
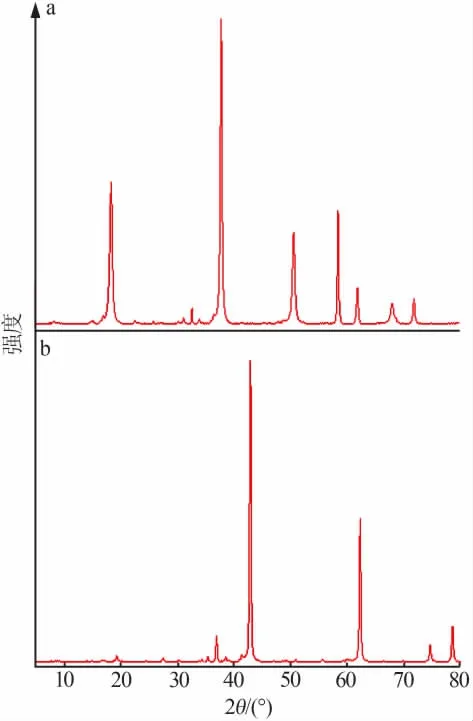
图4 球形氢氧化镁(a)和球形氧化镁(b)的XRD谱图

图5 球形氧化镁的SEM照片
球形氢氧化镁和球形氧化镁的粒度分布、平均粒径和比表面积如图6和表1所示。结合图5、图6和表1可知,600℃下煅烧得到的MgO形貌没有太大变化,仍保持较高的球形度,球体粒度分布没有太大变化;煅烧后平均粒径(D50)略有减小,比表面积减小。比表面积的减小是由于球形氧化镁的大粒径粒子含量更高所致。
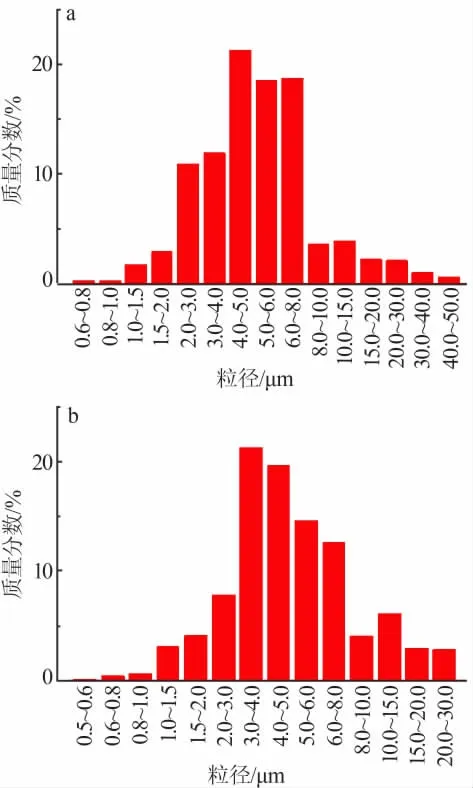
图6 球形氢氧化镁(a)和球形氧化镁(b)的粒度微分分布曲线
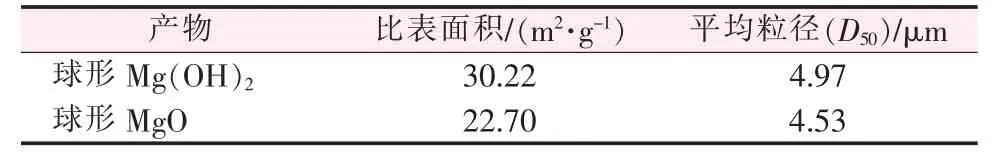
表1 球形Mg(OH)2和球形MgO的比表面积和平均粒径
3 结论
以聚乙烯吡咯烷酮为控制剂,氯化镁、氢氧化钠和氨水为原料,经静态反应制备出球形氢氧化镁前驱体,再经煅烧得到球形MgO。研究了控制剂种类、控制剂用量、反应物浓度、反应时间等因素对球形氢氧化镁形貌的影响,并用XRD、SEM等分析手段对产物做了表征。通过实验得到结论:1)聚乙烯吡咯烷酮、十二烷基苯磺酸钠、十二烷基硫酸钠都对氢氧化镁的形貌有显著的控制作用,其中聚乙烯吡咯烷酮控制效果好,且操作简单,最佳用量为氯化镁干质量的1%;2)氯化镁和氢氧化钠浓度会直接影响氢氧化镁的形貌,最佳的氯化镁浓度为1 mol/L,氢氧化钠浓度为0.25 mol/L;3)反应时间对氢氧化镁形貌也有较大影响,最佳反应时间为24 h。
综上所述,在常温、聚乙烯吡咯烷酮用量为1%、氯化镁浓度为1 mol/L、氢氧化钠为0.25 mol/L、反应时间为24 h条件下制得的球形氢氧化镁经600℃下煅烧2 h得到平均粒径为4.53μm的球形氧化镁。

