艾灸对IBS-D模型大鼠海马与结肠组织中TNF-α表达的影响
王宇,储浩然
(1.安徽中医药大学研究生院,合肥 230038;2.安徽中医药大学第二附属医院,合肥 230061;3.安徽省中医药科学院针灸临床研究所,合肥 230038)
肠易激综合征(irritable bowel syndrome,IBS)是一种以腹痛或腹部不适为主,伴有排便习惯改变和(或)大便性状异常的功能性肠病。腹泻型肠易激综合征(diarrhea predominant irritable bowel syndrome,IBS-D)是 IBS最主要的分型,症状以腹痛伴有排便次数增多(>3次/d),大便性状稀溏,或带有黏液,甚至水样便为主,严重影响患者生活质量[1]。目前IBS常用的治疗方法有解痉剂、止泻药、肠道动力调节药、益生菌、抗抑郁药等,疗效并不满意[2-5],而针灸对功能性胃肠疾病的防治具有良好的疗效,且不良反应少[6]。
IBS发病机制尚未完全明确,其发病机制可能与肠道动力及感觉异常、炎症与免疫、精神与心理等有关,所有这些发病因素均与脑-肠轴相关,脑肠轴功能失调是IBS-D发病的重要病机[7-8]。炎症和免疫反应异常参与 IBS-D发病,且与脑-肠轴密切相关[9]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作为一种促炎细胞因子,是构成机体免疫系统的重要介质,在IBS-D免疫应答、免疫调节及炎症反应中均具有十分重要的作用,影响IBS-D内脏高敏感性[10],是IBS-D动物模型的客观评价指标。TNF-α也是脑-肠互动的一种重要介质,有研究发现TNF-α在IBS-D大鼠的海马和结肠组织中均异常表达,影响脑-肠轴功能的结构基础改变,进而导致 IBS-D的发生和发展[9]。目前,脑肠轴是IBS-D研究的热点[11-13]。近年来,对针灸治疗IBS-D调节脑肠轴和降低细胞因子表达的作用机制研究较多,但将细胞因子与脑-肠轴联系的研究较少。所以艾灸治疗 IBS-D是否是通过抑制脑-肠轴中细胞因子的表达需进一步深入探讨。本研究拟观察艾灸对IBS-D大鼠海马与结肠组织中TNF-α蛋白和mRNA表达的变化,探讨艾灸治疗 IBS-D是否与抑制脑-肠轴中细胞因子的表达有关,此机制是否是通过脑-肠轴途径调节肠道黏膜免疫功能。
1 材料与方法
1.1 实验动物
选用健康SD雄性大鼠24只,购于安徽医科大学,体质量(220±30)g,动物许可证号为 SCXK(皖)2017-001。动物在安徽中医药大学实验动物中心饲养,饲养条件为Ⅱ级,光照周期 12 h/12 h,室温 22℃~25℃,相对湿度 45%~60%,自由进食、饮水。在整个实验过程中 SD大鼠的处理方法均遵照中华人民共和国科技部2006年颁布的有关动物的使用及伦理学规定。
1.2 主要仪器和试剂
细艾条(直径 0.5 cm,南阳宛北艾绒厂),TNF-α的PCR引物(生工生物工程股份有限公司),反转录试剂盒(K1622,Thermo Scientific,美国),TNF-α抗体(bs-2081R,北京博奥森生物技术有限公司),通用型二抗试剂盒(PV-6000,北京中杉金桥生物技术有限公司),DAB显色试剂盒(ZL1-9018,北京中杉金桥生物技术有限公司),荧光定量PCR仪(Thermo Scientific,美国),番泻叶购自安徽中医药大学第二附属医院,由安徽中医药大学第二附属医院中药制剂室提供制剂。
1.3 造模方法
采用慢性束缚联合番泻叶灌胃方法造IBS-D大鼠模型。对模型组和艾灸组大鼠进行番泻叶灌胃(将番泻叶置入100℃沸水中浸泡30 min,并经双层纱布过滤,最后将滤液减压浓缩成生药含量为 0.45 g/mL,在﹣4℃冰箱保存备用。剂量为 1 mL/100 g)。灌胃后,用粗制棉绳束缚大鼠双后肢,以限制大鼠活动,每日 1 h。对空白组大鼠以等体积蒸馏水灌胃,连续14 d[14-15]。以模型组大鼠稀便率升高至少 50%、腹部回缩反射的最小容量阈值降低至少 1 mL,与空白组差异具有统计学意义为造模成功的标准。
1.4 分组与干预
将24只SD大鼠随机分为空白组、模型组、艾灸组,每组 8只。空白组不做任何干预,模型组仅造模,不进行其他干预。艾灸组取穴为双侧上巨虚、天枢[16],将大鼠置于特制大鼠艾灸架上,将直径0.5 cm细艾条固定于艾灸支架上,悬于穴位上约2 cm处,每日1次,每次每穴灸30 min,共7次。
1.5 检测指标
1.5.1 稀便率
在治疗结束后第1天,观察6 h内各组大鼠的稀便率。稀便率(%)=稀便数/总排便粒数×100%。干稀便的区分以滤纸上有无污迹为准。
1.5.2 球囊扩张反射(CRD)容量阈值
内脏敏感性评估,即非伤害性结直肠球囊扩张反射(CRD)容量阈值测定,是在稀便率检测结束后,对各组大鼠 CRD诱发刺激下的腹部回缩反射(AWR)进行容量阈值测定。实验前,各组大鼠禁食不禁水 12 h。轻度麻醉后,将经甘油润滑后8F的导尿管缓慢插入肛门,将大鼠放于透明塑料盒中。待大鼠完全苏醒后约20 min,经球囊注入26℃~28℃的生理盐水,观察引起大鼠腹部回缩反射的最小容量阈值,重复3次,取3次均值作为直肠扩张引起腹部回缩反射的最小容量阈值[17-18]。
1.5.3 海马和结肠组织中TNF-α蛋白表达检测
采用免疫组织化学法检测海马和结肠组织中TNF-α蛋白表达。海马和结肠组织经组织脱水,石蜡包埋,切片。依次过3道二甲苯,每道15 mim。依次过3道100%、95%、80%乙醇,每道5 min,自来水流水缓慢冲洗。抗原高压修复。在组织上滴加 3% H2O2,室温孵育20 min。PBS冲洗3遍,滴加一抗(1:200),4℃冰箱过夜。PBS冲洗3遍,片子甩干,加二抗,孵育20 min。PBS冲洗 3遍,甩干,加 DAB显色剂,显微镜下控制显色。显色完全后,蒸馏水冲洗。苏木素染色 1 min,水冲洗。1%盐酸乙醇分化数秒,水冲洗。碳酸锂蓝化1 min,水冲洗。经过脱水、透明、封片后,显微镜观察。通过数字扫描仪扫描整张片子并保存,利用数字扫描的读片软件(CaseViewer)进行选片,使用形态学图像分析系统软件(JD801)分析,计算其平均光密度值(Average Optical Density,AOD)。
1.5.4 海马和结肠组织中TNF-α mRNA表达检测
采用Rt-qPCR检测海马和结肠组织中TNF-α mRNA的表达。提取结肠组织中RNA,经RT反应后,最后荧光定量 PCR反应获得的数据,根据扩增效率和熔解曲线分析,记录循环阈值(Ct),并经 Relative Quantification Study分析方法和2﹣△△Ct方法计算相对表达量,△△Ct计算公式为△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。各基因片段扩增引物序列见表1。

表1 PCR引物序列
1.6 统计学方法
采用SPSS24.0统计软件处理,符合正态分布计量资料以均数±标准差表示,实验数据采用单因素方差分析比较,方差齐时用LSD法,方差不齐时用Tamhane’s法,实验数据不符合正态分布采用Kruskal-Wallis H秩和检验,以P<0.O5为差异有统计学意义。相关性分析采用Pearson或Spearman相关系数,若两组均服从正态分布,则使用双变量相关分析中的Pearson相关分析;若两组不全部服从正态分布,则使用Spearman相关分析。若P<0.05,为两个变量存在相关性,若相关系数为0<r<1之间,为呈正相关,在﹣1<r<0之间,为呈负相关。
2 结果
2.1 各组腹部回缩反射的最小容量阈值和稀便率比较
与空白组比较,模型组腹部回缩反射的最小容量阈值显著下降(P<0.01),稀便率显著升高(P<0.01);与模型组比较,艾灸组腹部回缩反射的最小容量阈值均显著升高(P<0.01),稀便率均显著下降(P<0.01)。详见图1。
2.2 各组海马和结肠组织中TNF-α蛋白表达比较
与空白组比较,模型组大鼠海马和结肠 TNF-α蛋白表达增高(P<0.01);与模型组比较,艾灸组大鼠海马和结肠TNF-α蛋白表达降低(P<0.01)。详见图2-4。
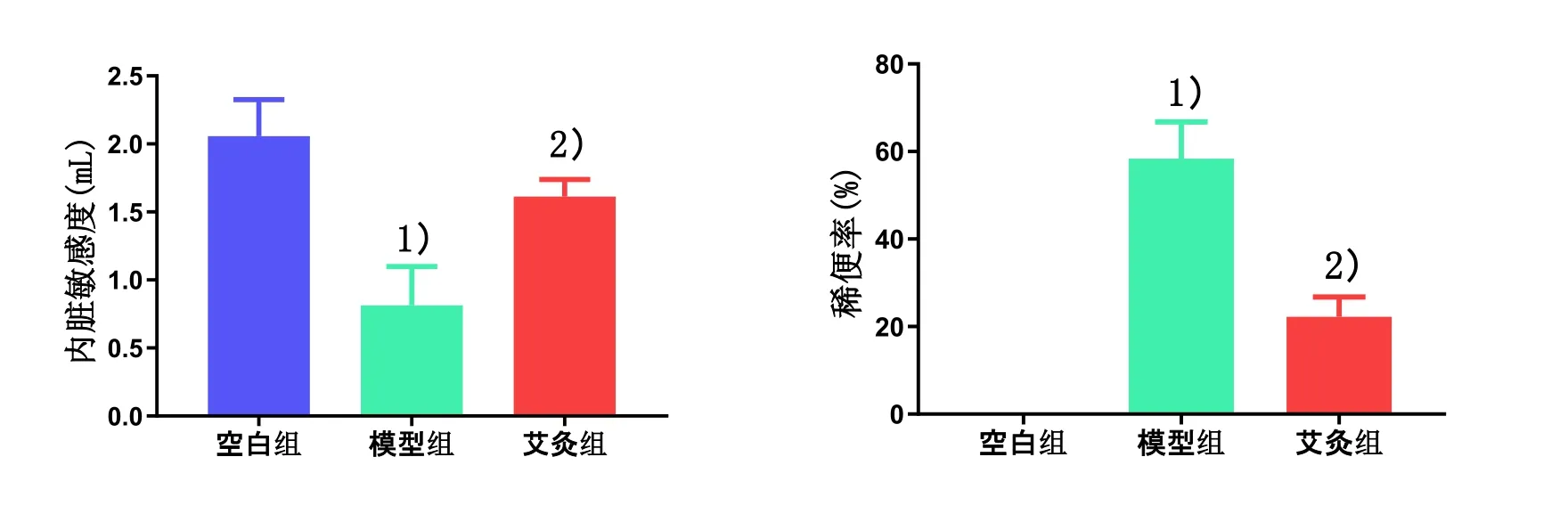
图1 各组大鼠腹部回缩反射的最小容量阈值和稀便率比较

图2 各组大鼠结肠组织TNF-α的免疫组化(×200)

图3 各组大鼠海马组织TNF-α的免疫组化(×200)
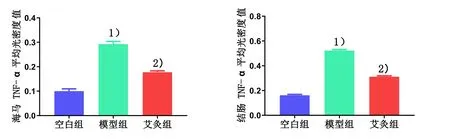
图4 各组大鼠海马和结肠TNF-α蛋白表达比较
2.3 海马和结肠组织中TNF-α蛋白表达相关性分析
根据散点图初步判断海马和结肠组织中 TNF-α蛋白表达间存在线性关系;线性相关性分析表明,空白组、模型组和艾灸组海马、结肠组织的 TNF-α蛋白表达量呈正相关(0<r<1,P<0.05)。详见图5,表2。
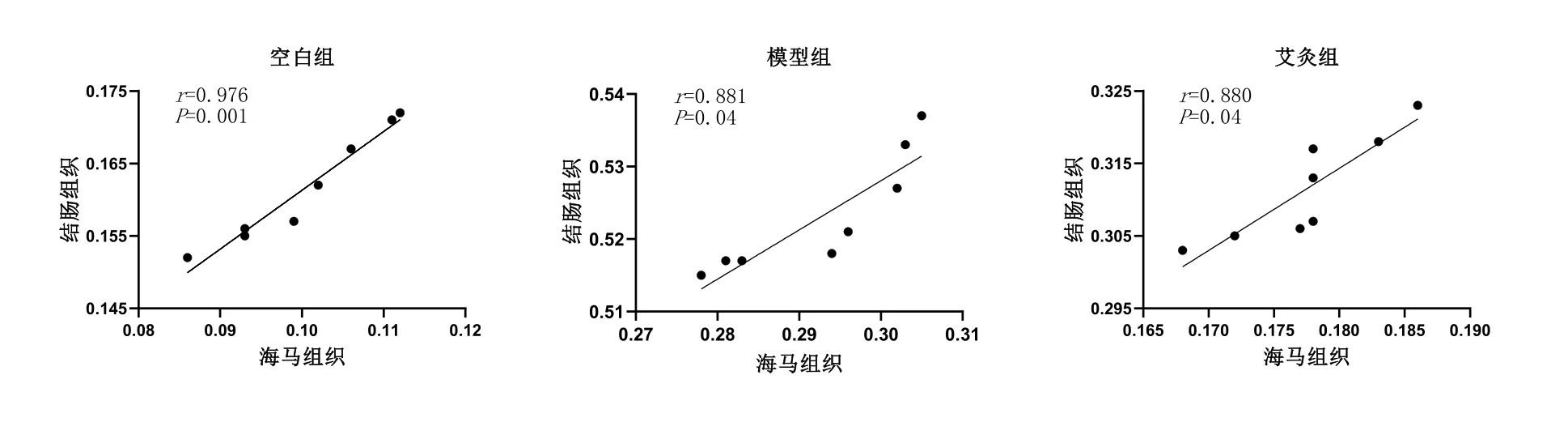
图5 各组大鼠海马和结肠组织中TNF-α蛋白表达相关性的散点图
表2 各组大鼠海马和结肠组织中TNF-α蛋白表达相关性分析 (±s)
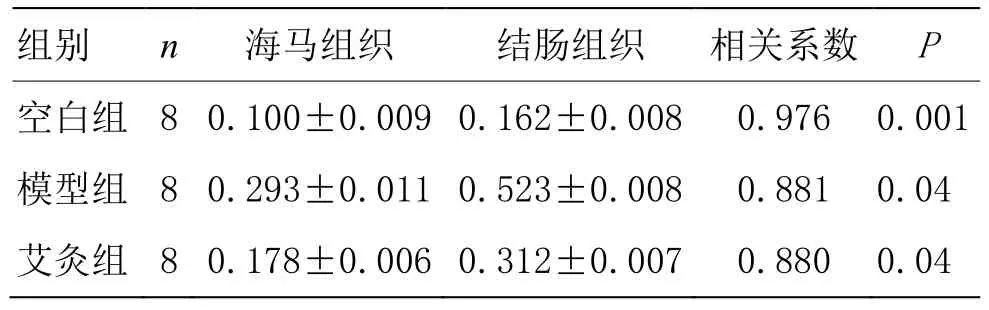
表2 各组大鼠海马和结肠组织中TNF-α蛋白表达相关性分析 (±s)
组别 n 海马组织 结肠组织 相关系数 P空白组 8 0.100±0.009 0.162±0.008 0.976 0.001模型组 8 0.293±0.011 0.523±0.008 0.881 0.04艾灸组 8 0.178±0.006 0.312±0.007 0.880 0.04
2.4 各组海马和结肠组织中TNF-α mRNA的表达比较
与空白组比较,模型组海马和结肠组织中TNF-α mRNA的表达显著增加(P<0.01);与模型组比较,艾灸组海马和结肠组织中 TNF-α mRNA的表达显著降低(P<0.01)。详见图6。
2.5 海马和结肠组织中TNF-α mRNA相关性分析
根据散点图初步判断海马和结肠组织中TNF-α mRNA间存在线性关系;线性相关性分析表明,空白组、模型组和艾灸组海马、结肠组织的TNF-α mRNA表达量呈正相关(0<r<1,P<0.05)。详见图7,表3。
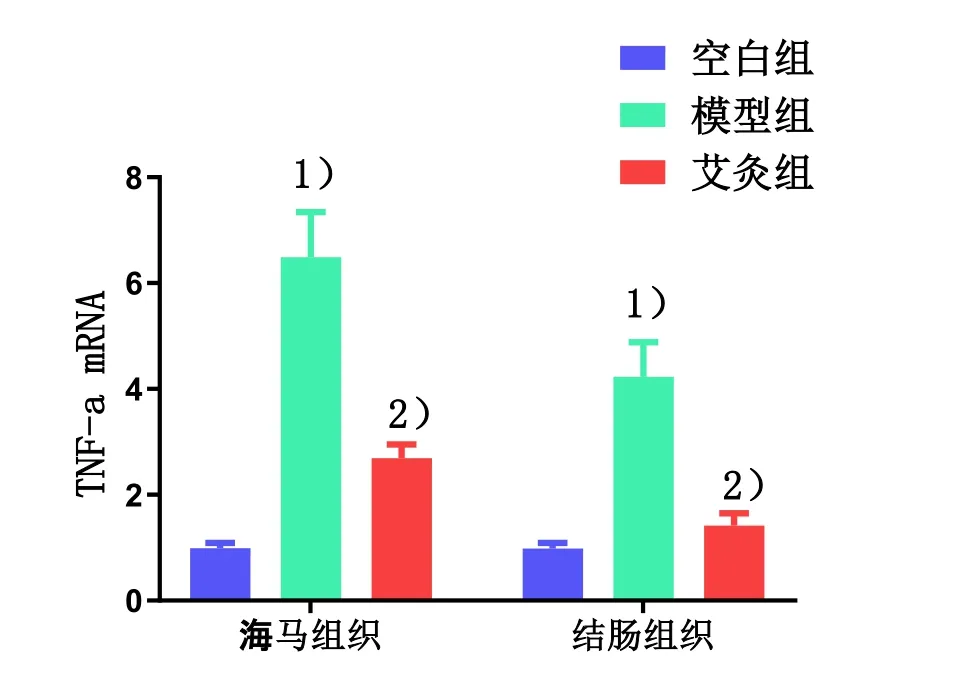
图6 各组大鼠海马和结肠TNF-α mRNA的表达比较
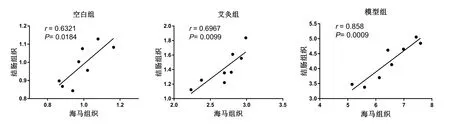
图7 各组大鼠海马和结肠组织中TNF-α mRNA相关性的散点图
2.6 海马和结肠组织中TNF-α mRNA与内脏敏感度和稀便率相关性分析
根据散点图初步判断海马和结肠组织中TNF-α mRNA与内脏敏感度和稀便率间存在线性关系;线性相关性分析表明,空白组、模型组和艾灸组海马、结肠组织的 TNF-α mRNA表达量与内脏敏感度呈负相关(﹣1<r<0,P<0.01),空白组、模型组和艾灸组海马、结肠组织的 TNF-α mRNA表达量与稀便率呈正相关(0<r<1,P<0.01)。详见图8。
表3 各组大鼠海马和结肠组织中TNF-α mRNA相关性分析 (±s)

表3 各组大鼠海马和结肠组织中TNF-α mRNA相关性分析 (±s)
组别 n 海马组织 结肠组织 相关系数 P空白组 8 0.99±0.10 0.98±0.11 0.7950 0.0184模型组 8 6.49±0.85 4.23±0.65 0.9262 0.0009艾灸组 8 2.69±0.26 1.41±0.24 0.8347 0.0099

图8 大鼠海马和结肠组织中TNF-α mRNA与内脏敏感度和稀便率相关性的散点图(24只/组)
3 讨论
肠道黏膜低度炎症等免疫功能失调在IBS-D的致病过程中发挥着重要作用。胃肠道是人体最大的免疫系统,全身近70%的淋巴组织附于肠道黏膜。淋巴系统内含有大量免疫细胞,将外在的病原体与人体内环境隔开,起到黏膜免疫的作用[19]。IBS患者肠腔中的食物抗原、细菌等穿过肠黏膜,激活黏膜下的免疫系统,促进炎症因子TNF-α释放,TNF-α作用于肠道神经元和平滑肌细胞,导致肠黏膜化学感受器和机械感受器对各种刺激敏感性增加,参与肠黏膜炎症级联反应的发生、发展[10],引起或维持肠道持续低度炎症反应,从而引发IBS症状。有研究显示,TNF-α等炎症因子的高表达在IBS-D疾病的发生、发展过程中发挥重要作用,它们通过神经、内分泌等途径影响肠道动力作用于肠道黏膜层和平滑肌层的神经纤维,从而产生腹痛、腹胀及大便性状的改变等症状[20]。本研究发现空白组、模型组和艾灸组海马、结肠组织的 TNF-α mRNA表达量与内脏敏感度呈负相关,与稀便率呈正相关,提示 TNF-α的表达增加与腹痛及稀便相关。IBS-D大鼠海马和结肠组织中TNF-α mRNA表达升高,艾灸治疗后,IBS-D大鼠稀便率降低、腹部回缩反射的最小容量阈值升高,海马和结肠组织中TNF-α mRNA表达降低,提示艾灸能调节免疫反应,有效地减轻IBS-D大鼠肠道低度炎症。
脑-肠轴是指胃肠道和大脑间相互作用的双向调节系统,其有机地把胃肠功能和脑功能联系起来,是维持肠管正常生理功能的基础,对肠道疾病发生的机制及治疗方法的选择有着重要的指导意义[21-22]。脑-肠轴可通过“脑肠互动”体现,即胃肠道活动的信息传入到中枢神经系统,并由中枢神经系统对信息进行整合,将调控信息传送到肠神经系统,或直接作用于胃肠效应细胞[7]。功能磁共振成像(FMRI)显示 IBS患者存在脑部功能的变化,大脑皮层的活动性与内脏感觉以及症状呈现同步改变的现象,且目前 IBS患者中海马功能的紊乱已经是很多研究达成的共识[23]。
免疫系统活化的标志之一是细胞因子的分泌,结肠中局部产生的细胞因子参与了 IBS脑肠轴的互动,通过传入神经将炎症信号传递入脑。脑中存在着一个由神经元、小胶质细胞、星形胶质细胞组成的免疫反应网络,对外周传入的信号做出反应。外周炎症因子传递至脑内后可引起小胶质细胞的活化,进一步分泌促炎性细胞因子[24]。Zhang G等[25]研究发现,CRD可增加海马小胶质细胞对外周疼痛传入信号的敏感性,促使已致敏的小胶质细胞释放炎性细胞因子,作用于周围的神经元细胞产生神经痛,加重内脏高敏感性的发生。本研究发现,IBS-D大鼠海马和结肠组织中TNF-α mRNA表达明显升高,且呈正相关。艾灸治疗后,IBS-D大鼠海马和结肠组织中TNF-α mRNA表达水平明显降低,呈正相关,提示艾灸治疗 IBS-D可能与降低脑-肠轴中细胞因子TNF-α有关。
艾灸具有温阳通脉、活血化瘀、舒经活络之功效。天枢穴乃大肠募穴,在调理中焦、调畅气机等方面十分有效。上巨虚为大肠下合穴,《外台秘要》:“巨虚上廉,足阳明与大肠合,在三里下三寸,灸三壮,主飧泄大肠痛。”故艾灸上巨虚穴能够调理气血、疏通经络,治疗胃肠疾病,且能提高痛阈,抑制中枢神经和外周神经的痛觉传导,有明显的镇痛作用[26]。合募配穴治疗腑病,升清降浊,止泻止痛。此为艾灸对IBS-D脑-肠轴过程的干预作用提供了理论依据。所以艾灸治疗 IBS-D与降低脑-肠轴中细胞因子TNF-α mRNA有关。
综上,艾灸天枢、上巨虚改善IBS-D大鼠腹泻症状和内脏高敏感性,可能与艾灸抑制海马和结肠组织中细胞因子 TNF-α的表达,调节肠道黏膜免疫功能有关,此机制可能是通过脑-肠轴实现,但具体作用机制尚未明确,还需进一步研究。

