微波联合酶法对小麦麸皮品质改良及结构特性影响
吕春月,杨庆余,刘 璐,李芮芷,罗志刚,张宏伟,王妍文,张依睿,肖志刚,*
(1.沈阳师范大学粮食学院,辽宁沈阳 110034; 2.华南理工大学食品科学与工程学院,广东广州 510641; 3.东北农业大学食品学院,黑龙江哈尔滨 150030)
小麦麸皮约占小麦整个籽粒的22%~25%[1],是小麦加工面粉过程中的副产物。麸皮含有丰富的维生素B、膳食纤维、维生素E以及人体所必需的微量元素[2],具有极高的营养价值。麸皮中的膳食纤维及其含有的生物活性成分有助于降低人体肥胖、心血管疾病、某些癌症、糖尿病的风险[3]。但小麦麸皮中脂肪酶和粗纤维含量较高,麸皮质地粗糙、口感差、颗粒粗、生理功能不佳、缺乏香味、储藏稳定性差等缺陷,使其应用受到限制[4]。研究表明,小麦麸皮中植酸盐含量丰富,植酸盐对淀粉酶具有很强抑制作用,可降低淀粉消化率,阻碍人体对维生素和矿物质的吸收,是一种抗营养因子[5-6]。目前,很多学者针对小麦麸皮的缺陷进行改良,常用的方法为挤压膨化处理[7]、超微粉碎[8]、蒸汽爆破[9]等方法。挤压膨化可增加小麦麸皮中可溶性膳食纤维含量,降低胆固醇,但挤压膨化改性后的小麦麸皮色泽较深,影响其感官品质[10]。Zhang等[11]研究发现,超微粉碎后粒径越小的麦麸纤维对面条中的面筋网络破坏程度越弱,有利于改善面条的烹饪品质,但该方法对设备、试剂和工艺等要求高、使用的条件苛刻和存在苦涩味等难题[12]。麸皮的酶解不仅可以改善其膳食纤维的物理化学特性和生理功能,还可有效改善小麦麸皮品质和口感,解决小麦麸皮的可溶性差、缺乏香味、不受糖尿病人喜欢等缺陷。因此,选择合适的小麦麸皮处理方法是改良其品质的核心要素。
本研究采用微波-生物酶技术对小麦麸皮进行研究,弥补了单一改性方法存在的不足。优化了小麦麸皮的加工工艺条件,同时对比分析了不同方法对小麦麸皮的结构和性质的影响规律,并对小麦麸皮的结构进行了表征。为充分发挥小麦麸皮中膳食纤维的生理功能,提高小麦麸皮的综合利用率,为开发高品质的小麦麸皮类产品提供理论支持。
1 材料与方法
1.1 材料与仪器
小麦麸皮(食品级) 沈阳香雪面粉有限公司;纤维素酶(10000 U/g)、木聚糖酶(100000 U/g) 河南万邦实业有限公司;无水乙醇、磷酸二氢钠、磷酸氢二钠、盐酸、氯化钠、氢氧化钠、三氯化铁、磺基水杨酸 天津大茂化学试剂厂;DNS试剂 北京索莱宝科技有限公司;其他试剂 均为分析纯。
UV-1200S型紫外可见分光光度计 翱艺仪器(上海)有限公司;MAS-II PLUS常压微波合成/萃取反应工作站 上海新仪微波化学科技有限公司;LD4-2离心机 上海安亭科学仪器厂;HN-150Y超声波细胞粉碎机、XB-85雪花制冰机 宁波新芝生物科技股份有限公司;SLQ-6型粗纤维测定仪 上海纤检仪器有限公司;JD2000-2L电子天平 沈阳龙腾电子有限公司;数显恒温磁力搅拌水浴锅 上海汗诺仪器有限公司;S-4800型高分辨场发射扫描电镜 日本日立公司;Nicolet 380型傅里叶红外光谱仪 Termo公司;ZQPW-70台式全温振荡培养箱 天津市莱玻特瑞仪器设备有限公司。
1.2 实验方法
1.2.1 小麦麸皮的改良方法
1.2.1.1 微波辐照改良小麦麸皮 在预实验基础上,准确称取5.0 g小麦麸皮置于锥形瓶中,料水比为1∶4,即加入20 mL水,设置微波处理时间15 min,微波功率700 W。将处理后的麸皮混合液倒入平皿中,置于45 ℃恒温干燥箱中烘干[13]。
1.2.1.2 酶解改良小麦麸皮 准确称取5.0 g小麦麸皮置于锥形瓶中,向锥形瓶中加入10倍麸皮质量的蒸馏水、0.4 g纤维素酶和0.4 g木聚糖酶,将锥形瓶放入60 ℃恒温振荡水浴锅中反应4 h,对小麦麸皮进行复合酶解。酶解反应结束后,将麸皮混合液置于100 ℃恒温水浴锅中灭酶10 min。冷却后4500 r/min离心10 min得到酶解液[14]。
1.2.2 微波辐照联合酶解改良小麦麸皮 采用微波辐照联合酶解法改善小麦麸皮品质,准确称取5.0 g微波辐照改良后的小麦麸皮,加入10倍麸皮质量的蒸馏水、0.4 g纤维素酶和0.4 g木聚糖酶,后续操作同1.2.1.2。
1.2.3 微波联合酶解改良小麦麸皮的单因素实验
1.2.3.1 不同纤维素酶添加量对小麦麸皮中还原糖含量的影响 在反应温度50 ℃,木聚糖酶添加量0.3 g,反应时间3 h条件下,添加不同质量的纤维素酶(0.1、0.2、0.3、0.4、0.5 g),进行小麦麸皮中还原糖含量测定。
1.2.3.2 不同木聚糖酶添加量对小麦麸皮中还原糖含量的影响 在反应温度50 ℃,纤维素酶添加量0.3 g,反应时间3 h条件下,添加不同质量的木聚糖酶(0.1、0.2、0.3、0.4、0.5 g),进行小麦麸皮中还原糖含量测定。
1.2.3.3 反应温度对小麦麸皮中还原糖含量的影响 在木聚糖酶添加量0.4 g、纤维素酶添加量0.3 g、反应时间3 h条件下,分别设置反应温度为(30、40、50、60、70 ℃),进行小麦麸皮中还原糖含量测定。
1.2.3.4 反应时间对小麦麸皮中还原糖含量的影响 在木聚糖酶添加量0.4 g、纤维素酶添加量0.3 g、反应温度60 ℃,分别设置反应时间为(1、2、3、4、5 h),进行小麦麸皮中还原糖含量测定。
1.2.4 正交试验确定微波联合酶解最佳工艺参数 在单因素实验的基础上进行正交实验设计,木聚糖酶添加量、纤维素酶添加量、反应温度和反应时间为因素,小麦麸皮中还原糖含量为指标,采用L9(34)正交试验,优化酶解的最佳工艺条件。

表1 因素水平表Table 1 Factor level table
1.2.5 小麦麸皮结构表征
1.2.5.1 扫描电镜(SEM) 实验参照Xue等[15]的方法稍作修改。将一定量原麸皮和三种方式改良后的小麦麸皮充分分散于固定在载物台上双面导电胶上,在真空条件下进行镀金处理,加速电压为1.0 kV,放大倍数1200倍和2000倍。
1.2.5.2 傅里叶红外光谱(FT-IR)的测定 称取少量未处理、微波处理、酶解处理和微波联合酶解处理后小麦麸皮样品研磨均匀,用压片机将样品压片,压力保持15 kPa,测试范围为4000~400 cm-1,扫描累加32次,分辨率为4 cm-1。
1.2.6 小麦麸皮基本性质的测定
1.2.6.1 小麦麸皮中植酸含量测定 小麦麸皮中植酸含量的测定参照GB 5009.153-2016 《食品安全国家标准 食品中植酸的测定》法。
1.2.6.2 小麦麸皮中还原糖含量测定 还原糖的测定采用3,5-二硝基水杨酸(DNS)法测定[16-17]。
取0、0.4、0.6、0.8、1.0、1.2 mL的1 mg/mL的还原糖标准溶液于25 mL刻度试管中,分别加蒸馏水补到2 mL,再各加DNS试剂1.5 mL,混匀后沸水浴5 min,冷却至室温并定容到25 mL,振荡摇匀,静置20 min,在540 nm波长下测试,并绘制其标准曲线,得到其线性回归方程为y=0.5349x-0.0146,R2=0.9971。
分别取1 mL原样品、微波、酶解、微波联合酶解样品提取液(其中原样品、微波提取液的制备:分别称取原样品、微波样品5.0 g,在1∶10的料水比条件下反应4 h后,4500 r/min条件下离心10 min得到上清液,上清液适当稀释后得到样品提取液),加1 mL蒸馏水,加DNS试剂1.5 mL,摇匀后沸水浴5 min,冷却至室温并定容到25 mL,振荡摇匀,静置20 min,在540 nm波长下比色,从线性回归方程中计算得到溶液中还原糖的含量。
1.2.6.3 小麦麸皮脂肪酶残余酶活测定 参考Haniye等[18]的方法稍作修改。准确称取5 g未处理、微波处理、酶解处理和微波联合酶解处理后小麦麸皮样品于研钵中,加入pH6.9的磷酸缓冲液20 mL,在冰浴中研磨10 min,利用超声波细胞破碎仪进行细胞破碎10 min,时间间隔设为5 s,全程处于冰浴,将破碎后的麸皮进行离心处理(10000 r/min,10 min,4 ℃)。离心后过滤取上层清液,储存于4 ℃备用。用0.05 mol/L的氢氧化钠溶液滴定滤液,并记录消耗氢氧化钠溶液体积。其计算方法见式(1)和式(2):
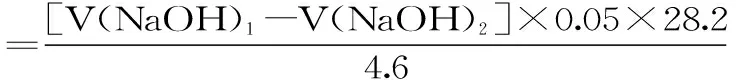
式(1)
式(2)
式中:V(NaOH)1表示样品消耗氢氧化钠体积,mL;V(NaOH)2表示空白消耗氢氧化钠体积,mL;0.05表示配制NaOH溶液0.05 mol/L;LA活性1表示样品钝化后酶的活性,mL/min;LA活性2表示样品钝化前酶的活性mL/min。
1.2.6.4 小麦麸皮粗纤维含量的测定 小麦麸皮粗纤维含量的测定依据GB 6193-1986《谷物籽粒粗纤维测定法》中的附录A粗纤维快速法进行测定。取1 g未处理、微波处理、酶解处理和微波联合酶解处理后小麦麸皮样品与砂芯漏斗中,在粗纤维测定仪上先用3.14%的沸腾H2SO4煮沸8 min,抽滤并冲洗至中性,再用3.14%的沸腾NaOH煮沸8 min抽滤并冲洗至中性,分别用乙醇和乙醚进行脱色和脱脂处理,放入130 ℃烘箱中烘2 h,冷却,称重,再放入600 ℃马弗炉中烧30 min,冷却称重,2次称重之差即为样品中粗纤维的质量。其计算见式(3)。
式(3)
式中:A1表示坩埚+粗纤维+残渣中灰分质量,g;A2表示坩埚+残渣中灰分质量,g;W表示风干样品重,g;B表示水分含量,%。
1.2.6.5 小麦麸皮持油性测定 实验参照Luo等[19]的方法稍作修改。准确称取1.00 g未处理、微波处理、酶解处理和微波联合酶解处理后的小麦麸皮,将其放入50 mL离心管中,加入20 g食用油,在37 ℃下静置1 h,离心机转速设置3000 r/min,离心20 min后除去上层油,然后按下式计算。其计算见式(4)。
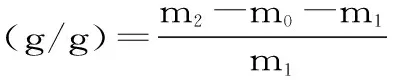
式(4)
式中:m2表示离心管与麦麸的总质量,g;m1表示小麦麸皮质量1.00 g;m0表示离心管的质量,g。
1.2.6.6 小麦麸皮持水性的测定 实验参照Luo等[19]的方法稍作修改。分别取一定量未处理、微波处理、酶解处理和微波联合酶解处理后的小麦麸皮,按1∶10比例加入蒸馏水,室温下搅拌混匀30 min,2500 r/min离心20 min,弃去上清液,沉淀称重。其计算见式(5)。
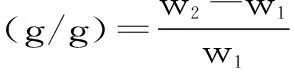
式(5)
式中:W1表示样品质量,g;W2表示沉淀质量,g。
1.3 数据处理
试验数据采用SPSS 26.0和Origin 9.5软件对数据进行处理并分析,采用ANOVA对数据进行差异显著性分析(P<0.05)。所有样品重复测定3次取平均值。
2 结果与分析
2.1 微波联合酶解改良小麦麸皮工艺优化
2.1.1 纤维素酶添加量对小麦麸皮中还原糖含量的影响 图1为不同纤维素酶添加量对麸皮中还原糖含量影响。由图1可以看出,当纤维素酶添加量由0.1 g增加到0.2 g时,还原糖含量快速增加,0.2~0.5 g时小麦麸皮中还原糖含量增加趋势变缓。可能是因为酶在添加量为0.2 g时,底物与酶结合位点接触几率增加,有利于小麦麸皮粗纤维解聚,粗纤维分子的糖苷键断裂降解为小分子的还原糖[20],还原糖含量增加。随着酶添加量的增多,还原糖含量继续增加,增速减缓。综上,选择纤维素酶添加量0.2、0.3、0.4 g进行下一步的优化实验。
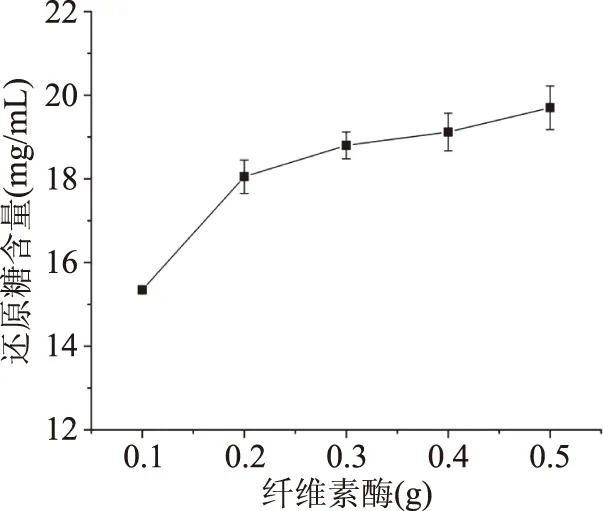
图1 纤维素酶添加量对小麦麸皮中还原糖含量影响Fig.1 Effect of cellulase content onreducing sugar content of wheat bran

图2 木聚糖酶添加量对小麦麸皮中还原糖含量影响Fig.2 Effect of xylanase content onreducing sugar content of wheat bran
2.1.2 木聚糖酶添加量对小麦麸皮中还原糖含量的影响 图2为不同木聚糖酶添加量对小麦麸皮中还原糖含量的影响。由图2可知,随着木聚糖酶添加量的增多,麸皮中还原糖含量逐渐增加,但当酶添加量超过0.4 g时,还原糖含量稍有增加,酶解反应趋于稳定,可见酶的添加影响小麦麸皮的酶解效果,可能是因为木聚糖酶可使阿拉伯木聚糖中的糖苷键断裂,聚合度降低,使得还原糖含量升高,从经济角度考虑,选择木聚糖酶添加量0.2、0.3、0.4 g进行下一步的优化。
2.1.3 反应温度对小麦麸皮中还原糖含量的影响 图3为不同反应温度对小麦麸皮中还原糖含量影响。由图3可知,当温度由30 ℃增加到60 ℃时,还原糖含量逐渐增多,60~70 ℃麸皮中还原糖含量降低。可能是因为随着温度的升高体系中分子间碰撞机会增加[21],有利于麸皮中还原糖的溶出,当酶解温度高于一定范围时,可能会引起酶的构象变化,导致酶活性降低,水解速度下降,还原糖含量降低。酶解温度40 ℃和70 ℃条件下还原糖含量仅相差0.7 mg/mL,但温度却相差30 ℃,考虑到在实际生产中温度越高,能耗越大,工业化大批量生产所需能耗增加。综合考虑,选择酶解温度40、50、60 ℃进行下一步的优化。

图3 反应温度对小麦麸皮中还原糖含量影响Fig.3 Effects of reaction temperature onreducing sugar content of wheat bran
2.1.4 反应时间对小麦麸皮中还原糖含量影响 图4为不同反应时间对小麦麸皮中还原糖含量的影响。由图4可知,当时间由1 h增加到3 h时,还原糖含量逐渐增多,在3~5 h小麦麸皮中还原糖含量逐渐趋于平缓。这可能是因为在反应初期,底物与复合酶能够充分吸附接触,酶解速度较快,还原糖含量逐渐增多。但随着反应时间的延长,小麦麸皮中可以被纤维素酶和木聚糖酶进行酶解的化学基团逐渐减少,同时随着反应时间的延长复合酶活性逐渐降低[22]。后续试验酶解时间确定为2、3、4 h三个水平。
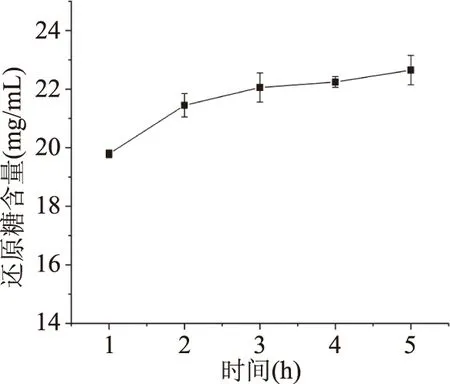
图4 反应时间对小麦麸皮中还原糖含量的影响Fig.4 Effect of reaction time onreducing sugar content of wheat bran
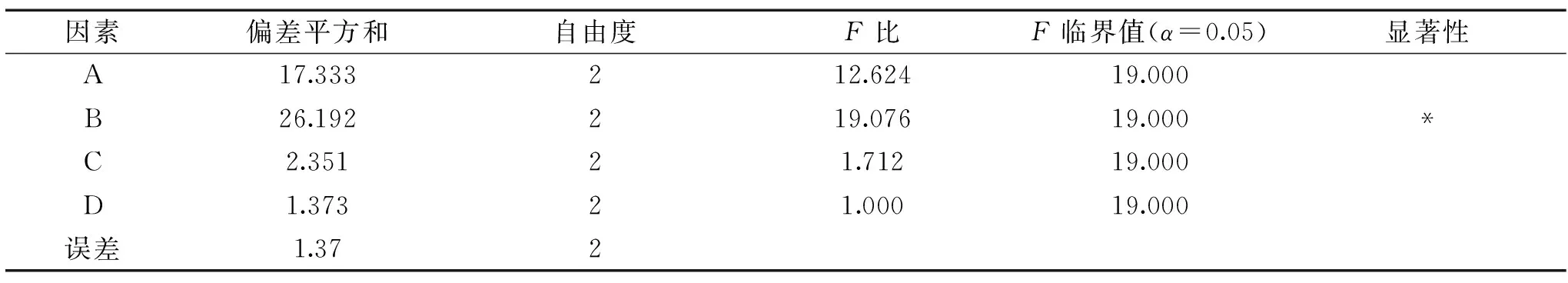
表3 酶解处理条件优化方差分析Table 3 Analysis of variance for condition optimization of enzymatic hydrolysis treatment
2.2 正交试验
以木聚糖酶(A)、纤维素酶(B)、反应时间(C)、反应温度(D)为因素,采用四因素三水平正交试验,以小麦麸皮中还原糖含量为考察指标,正交试验结果及极差分析见表2。
由表2可知,各因素的影响顺序为:RB>RA>RC>RD。依次为纤维素酶的添加量、木聚糖酶添加量、反应时间和反应温度。由方差分析表3可知,纤维素酶添加量对还原糖含量影响显著(P<0.05),木聚糖酶、反应时间、反应温度对还原糖含量的影响不显著(P>0.05)。根据正交实验结果,小麦麸皮还原糖含量的最佳工艺条件组合为A3B3C3D3,即木聚糖酶添加量0.4 g,纤维素酶添加量0.4 g,温度60 ℃,时间4 h。
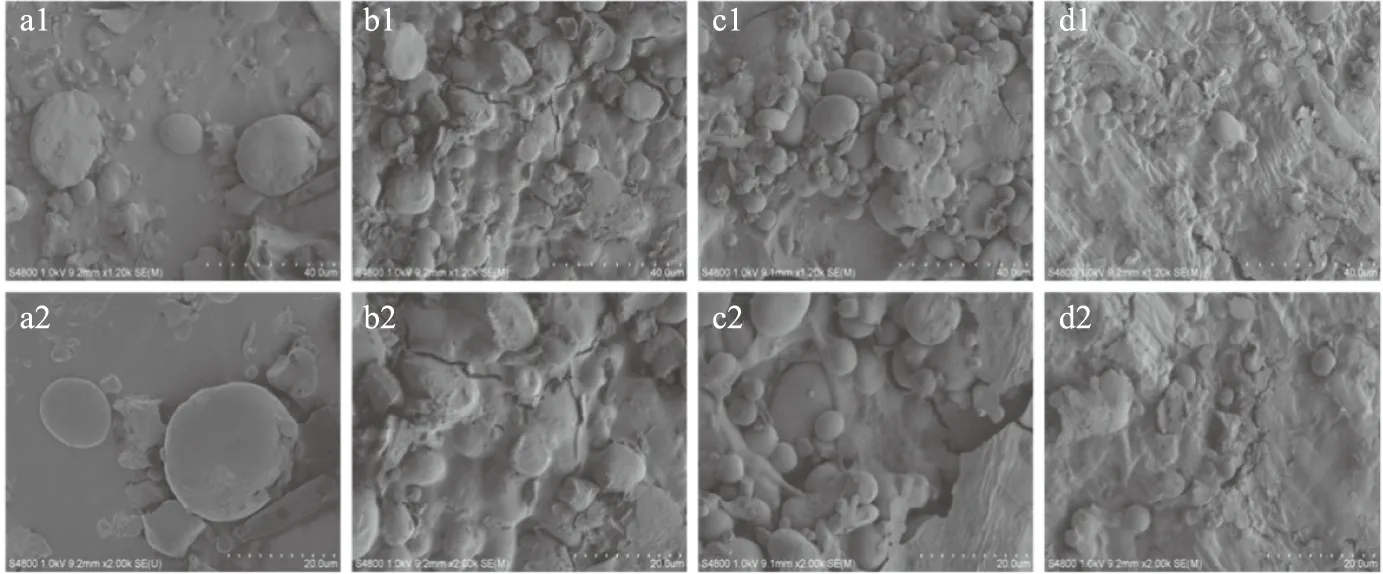
图5 不同处理方式对小麦麸皮微观结构的影响Fig.5 Effects of different treatments methods on microstructure of wheat bran注:a1、b1、c1、d1分别为原麸皮、微波处理麸皮、生物酶酶解麸皮、微波-生物酶解麸皮(1200×);a2、b2、c2、d2分别为原麸皮、微波处理麸皮、生物酶解麸皮、微波-生物酶解麸皮(2000×)。
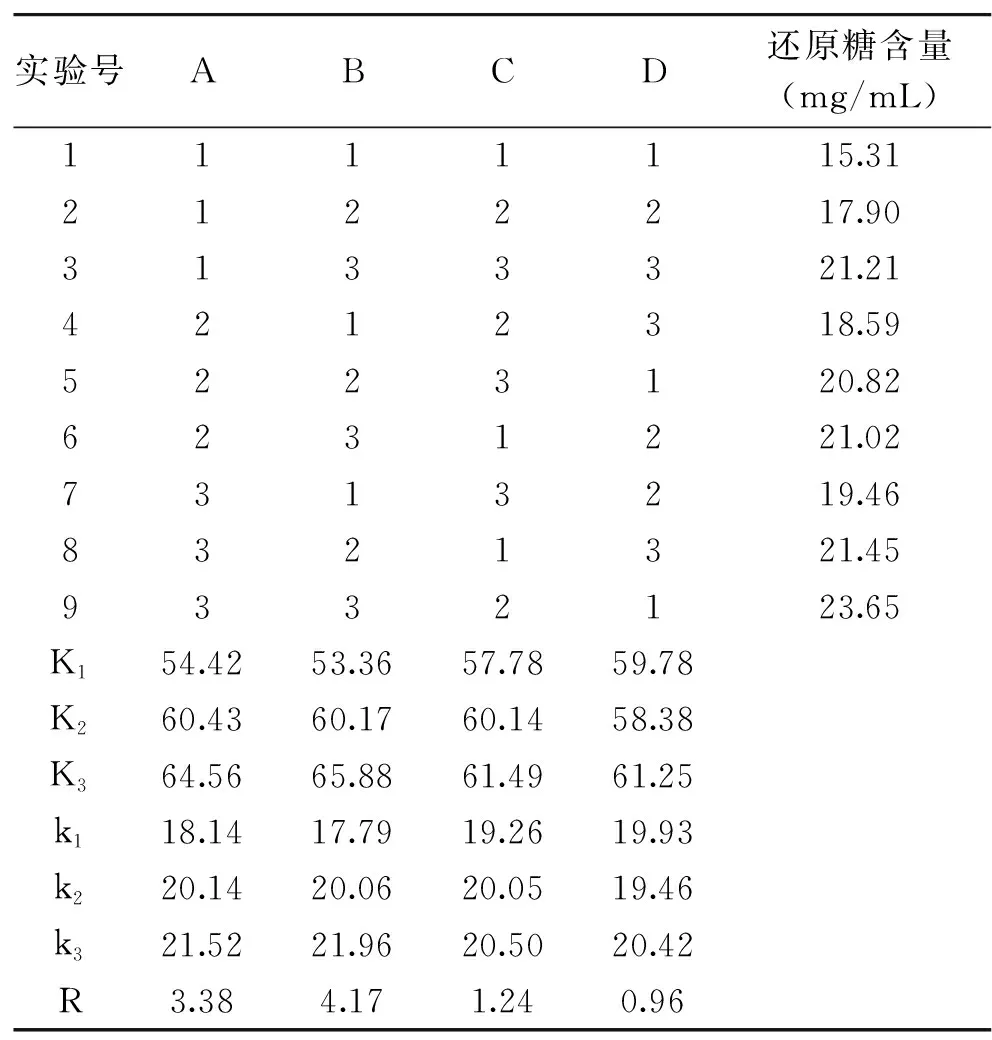
表2 酶解处理条件优化实验结果Table 2 Experimental results of optimizationof enzymatic hydrolysis conditions

表4 验证试验结果Table 4 Verifies test results
2.3 验证试验
选取木聚糖酶添加量0.4 g,纤维素酶添加量0.4 g,温度60 ℃,时间4 h做验证试验,所得小麦麸皮中还原糖含量为25.15 mg/mL,高于所有试验中还原糖的含量,与正交实验结果相一致。原麸皮、微波、酶解处理后还原糖含量分别为0.8、6.853、20.44 mg/mL。验证实验结果见表4。
2.4 不同处理方法对小麦麸皮结构的影响
2.4.1 不同处理方式对小麦麸皮微观结构的影响 图5为不同处理方式对小麦麸皮微观结构的影响。由图5可以看出,未处理的小麦麸皮与微波处理、生物酶解、微波-生物酶解处理的麸皮相比,微观结构具有明显差异。未经处理的麸皮表面较光滑、紧密,形态完整,表面没有破坏,内侧(淀粉层)淀粉粒较为完整、呈卵圆形。微波处理后的小麦麸皮,麸皮表面失去光泽、粗糙,结构疏松。仅酶解处理的小麦麸皮,表面粗糙有裂痕。微波联合生物酶法处理的小麦麸皮,大颗粒的淀粉明显减少,麦麸光滑的表面被撕裂成小段,淀粉内部氢键断裂,淀粉粒解体,外皮失去了原有的光泽[23],变得粗糙不平。
2.4.2 不同处理方式对小麦麸皮红外光谱的影响 图6是不同处理方式的小麦麸皮在500~4000 cm-1范围内具有糖类特征吸收峰。由图6可知,在3300 cm-1处出现的是O-H的伸缩振动吸收峰,O-H键主要来源于纤维素和半纤维素。改性前后的小麦麸皮在2925 cm-1处出现的弱吸收峰是糖类C-H键的反对称伸缩振动。1540 cm-1处代表苯环特征峰,苯环主要来源于木质素[24]。1637 cm-1代表羧基的特征吸收峰,羧基通过形成分子间氢键与纤维素链相连,1735 cm-1代表羰基特征吸收峰。与原麸皮相比,小麦麸皮经微波、酶解、微波联合酶解处理后这些吸收峰强度都较低,说明纤维素链之间的氢键被破坏[25],同时,小麦麸皮经改性处理后部分糖苷键断裂,致使还原糖含量增加。综合分析得出改性前后小麦麸皮结构很相似,表明小麦麸皮的基团类型未变,不同基团的含量有所不同。

图6 不同处理方式对小麦麸皮结构影响红外光谱对比图Fig.6 Effects of different treatment methodson wheat bran structure by IR spectra
2.5 不同处理方法对小麦麸皮基本性质的影响
2.5.1 不同处理方式对小麦麸皮中植酸含量的影响 图7为不同处理方式对小麦麸皮中植酸含量影响。由图7可以看出,原小麦麸皮中植酸盐含量为0.369 g/kg,经微波、酶解、微波联合酶解处理后,小麦麸皮中植酸盐含量分别降为0.278、0.172、0.109 g/kg。这可能是因为,微波联合酶解导致麦麸中的半纤维素等物质发生水解,产生的酸性物质使体系pH下降,植酸含量降低[26]。另一方面可能是因为微波可使麸皮中的水分子发生共振,引起分子的摩擦产生热量,使一定量的麸皮快速吸收微波热量,从而破坏植酸分子,植酸含量下降有利于体内矿物质的吸收,提高矿物质利用率[27]。

图7 不同处理方式对小麦麸皮中植酸含量影响Fig.7 Effects of different treatmentson phytic acid content in wheat bran
2.5.2 不同处理方式对小麦麸皮中还原糖含量的影响 图8为不同处理方式对小麦麸皮中还原糖含量的影响。由图8可以看出,原麸皮中的还原糖含量为0.8 mg/mL,微波辐照麸皮、生物酶酶解麸皮、微波辐照-生物酶酶解麸皮中的还原糖分别为6.853、20.44、25.15 mg/mL。小麦麸皮经微波、酶解、微波联合酶解处理后还原糖含量均呈现升高趋势,其中微波联合酶解效果最显著。可能是微波辐射使化学键受到破坏,粗纤维成分之间结合程度降低[28],促进纤维素酶对小麦麸皮中纤维素和β-1,4糖苷键的水解,使得粗纤维降解为小分子的还原糖,小麦麸皮中还原糖含量升高。木聚糖酶是一种水解酶,能够酶解小麦麸皮中阿拉伯木聚糖主链并且破坏阿拉伯木聚糖中的糖苷键[29],从而改变阿拉伯木聚糖的功能和理化性质,对麸皮品质起到改善作用。

图8 不同处理方式对小麦麸皮中还原糖含量影响Fig.8 Effects of different treatmentson reducing sugar content in wheat bran
2.5.3 不同处理方式对小麦麸皮中脂肪酶残余酶活的影响 图9为不同处理方式对小麦麸皮中脂肪酶残余酶活的影响。由图9可知,微波、酶解、微波联合酶解处理后小麦麸皮脂肪酶(LA)残余酶活分别为12.16%、30.65%、6.13%。由此可见,麸皮中添加复合酶增强了微波钝化脂肪酶效果。这可能是因为微波辐照作用于小麦麸皮中的极性分子,使其内部分子间剧烈摩擦[30],导致脂肪酶变性失活;另一方面可能是因为脂肪酶作为一种生物催化剂,在长时间的微波处理过程中导致脂肪酶失活,可以明显的钝化脂肪酶的活性[31],抑制脂肪的水解,可以延长小麦麸皮储藏期,提高小麦麸皮的储藏稳定性。
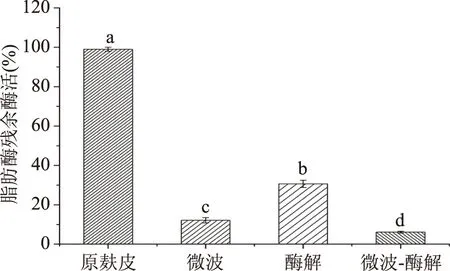
图9 不同处理方式对小麦麸皮中脂肪酶残余酶活的影响Fig.9 Effects of different treatmentson lipase residual enzyme activity in wheat bran
2.5.4 不同处理方式对小麦麸皮中粗纤维含量影响 图10是不同处理方式对小麦麸皮中粗纤维含量影响,由图10中可知,对照组中小麦麸皮粗纤维含量为11.58%,微波、酶解、微波联合酶解处理后粗纤维含量分别降至10.35%、6.12%、2.79%,这可能是因为微波处理可以降低麸皮粗纤维之间结合的紧密程度,纤维素酶可以引起半纤维素和纤维素的降解[32],导致部分粗纤维降解为可溶性物质,粗纤维含量降低。经微波联合酶解处理后能有效降低麸皮中粗纤维含量,提高了小麦麸皮的适口性,有利于消化吸收。
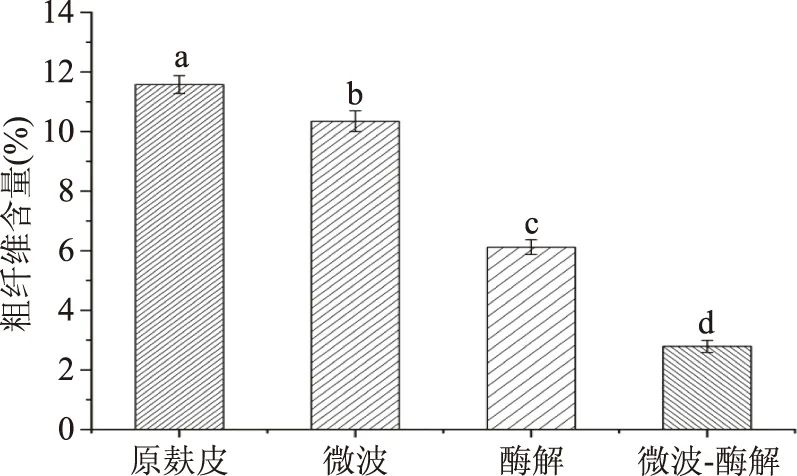
图10 不同处理方式对小麦麸皮中粗纤维含量影响Fig.10 Effects of different treatmentson crude fiber content in wheat bran
2.5.5 不同处理方式对小麦麸皮持油性的影响 图11是不同处理方式对小麦麸皮持油性的影响。由图11可以看出,原麸皮的持油性为2.81 g/g,经微波、酶解、微波联合酶解处理后,小麦麸皮持油性分别降为2.32、2.19、2.06 g/g。这可能是因为改性后麦麸纤维结构断裂,麦麸网孔结构遭到破坏[33],大分子物质长链断裂,使得改性麦麸对油脂保持作用下降。小麦麸皮中含有大量的木质素和非淀粉多糖,经微波联合酶解处理后大部分转化为还原糖,使得改性后的小麦麸皮持油性降低。
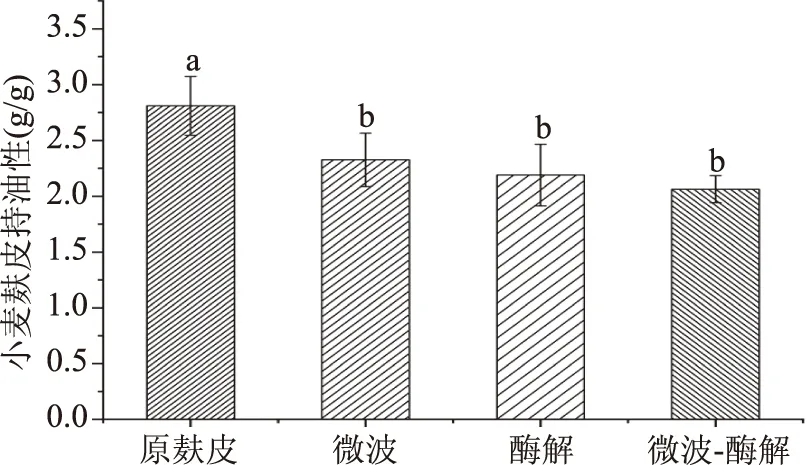
图11 不同处理方式对小麦麸皮持油性的影响Fig.11 Effects of different treatmentson wheat bran oil retention
2.5.6 不同处理方式对小麦麸皮持水性的影响 图12是不同处理方式对小麦麸皮持水性影响。由图12可知,原麸皮的持水性为2.22 g/g,微波、酶解、微波联合酶解处理后的小麦麸皮含水量分别为2.75、2.55、2.89 g/g。微波联合酶解处理后的小麦麸皮的持水性升高最为明显。可能因为木聚糖酶和纤维素酶水解可以破坏纤维素和半纤维素(木聚糖)的β-糖苷键[34],导致麦麸纤维结构被破坏,使其变得更加疏松,增加了其比表面积,使得改性后的小麦麸皮持水性提高。
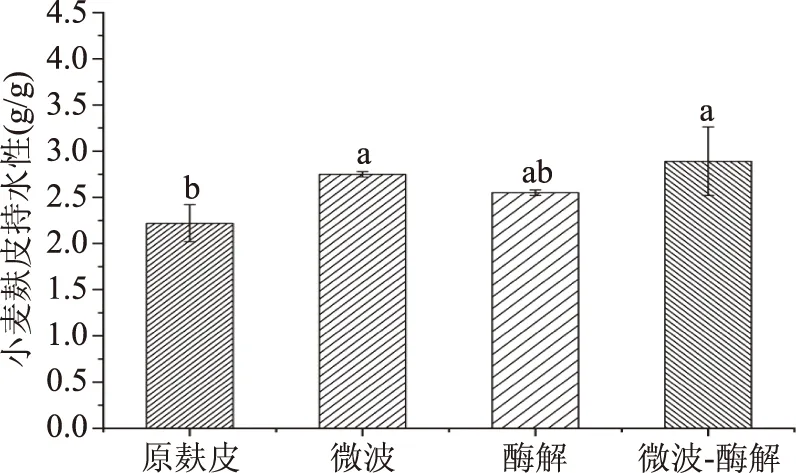
图12 不同处理方式对小麦麸皮持水性的影响Fig.12 Effect of different treatmentson water holding capacity of wheat bran
3 结论
本研究采用微波联合复合酶法优化了小麦麸皮品质的加工工艺,并对比了微波、酶解、微波联合酶解三种处理方式对小麦麸皮品质的影响。微波联合酶法改良小麦麸皮的最佳加工工艺参数为:微波功率700 W,时间15 min,料水比1∶4,木聚糖酶添加量0.4 g,纤维素酶添加量0.4 g,酶解时间4 h,酶解温度60 ℃,此时小麦麸皮中还原糖含量为25.15 mg/mL,而原麸皮、微波、酶解处理后还原糖含量分别为0.8、6.853、20.44 mg/mL。其中微波联合酶解对小麦麸皮的品质改善最为显著,主要表现为:经微波联合酶解处理后,小麦麸皮中还原糖含量增加至25.15 mg/mL,脂肪酶(LA)残余酶活降至6.13%,粗纤维含量降至2.79%,植酸含量降低了70.46%,持油性降低了26.69%,持水性增加了30.18%。小麦麸皮表面结构变粗糙,结构疏松多孔,利于提高全麦食品中面筋网络的形成,小麦麸皮的食用品质得到显著改善。

