外源添加对黄河流域典型湿地土壤矿化及硝化的影响
朱文会,杨欣桐,王夏晖,卢然,刘瑞平,陈茜
(生态环境部环境规划院土壤环境保护中心,重金属污染防治研究中心,北京100012)
引 言
土壤有机碳作为全球碳循环中的重要碳库,其矿化、分解是调控土壤碳库时空格局、土壤碳收支平衡和植物养分供应的重要过程[1]。CO2作为生态系统碳输出的重要途径,自1750年以来其浓度增加了40%[2]。有研究表明大气CO2浓度的升高会增加植物固碳,并以高碳基质的形式被输送到陆地生态系统中[3],碳输入的增加会对生态系统的稳定性与氮等营养元素供给造成影响[4]。土壤氮矿化速率作为氮有效性的指标影响着陆地系统的初级生产力[5],而硝化作用是导致陆地生态系统氮损失的重要途径[6]。中国已经成为继欧美后的第三大氮沉降区,氮沉降增量问题尤为突出[3]。如黄河口湿地氮沉降已经从1980 年的1~2g·m-2·a-1增至近年的3~4.5g·m-2·a-1[7],已接近其4.0g·m-2·a-1的氮沉降临界负荷[8]。从全国尺度来看,我国北部地区氮沉降问题更为突出,氮沉降量远高于其他地区[9]。氮素是湿地生态系统限制性营养元素[10],氮沉降通过改变微生物活性、植被生长等因素影响生态系统氮循环过程[4]以及土壤中碳的循环和储存[11]。土壤碳、氮矿化与硝化作用对陆地生态系统健康具有重要意义[12]。已有研究表明,土壤碳矿化速率受温度[4]、凋落物性质[1]、外源添加[4]等因素影响显著,而土壤类型[13]、外源添加[14]、温度和水分[13]、pH[12]等是影响土壤净氮矿化速率和净硝化速率的主要因素。
黄河流域生态保护和高质量发展是继京津冀协同发展、长江经济带发展、粤港澳大湾区建设、长三角一体化发展的又一重大国家战略[15]。黄河流域许多重要生态问题如土地沙化、干支流断流、环境恶化等现象都与湿地退化有关。湿地保护实质上是流域生态保护的基础,湿地在为生物提供栖息地、净化水质、调蓄洪水、涵养水源等方面具有重要作用[16]。《全国湿地保护工程规划(2002—2030 年)》专门设立了青藏高寒湿地区和黄河中下游湿地区,提出了加强黄河流域湿地生态功能恢复与保护的目标[17]。当前,关于黄河流域及流域湿地的研究多集中在污染源解析及空间分布[18-19]、湿地水质净化功能[16]、土壤盐分空间分异[20]等方面研究,黄河流域湿地的保护与管理也多从制度框架与规划角度出发[15]。仅有极少部分研究针对黄河流域湿地土壤碳、氮转化相关过程,但研究的湿地类型单一,且主要针对碳或氮单一转化研究[12,21]。黄河流域湿地类型空间分布差异性很大,目前已有研究缺乏差异性比较分析。
本文以黄河流域上游(若尔盖湿地土壤)、中游(包头南海湿地土壤)、下游(黄河三角洲湿地)典型湿地土壤为研究对象,分别选用NH4NO3和葡萄糖作为外加氮源和碳源,采用28 d 恒温培养法,研究了外源添加对黄河流域典型湿地土壤碳、氮矿化及硝化的影响,以期为黄河流域湿地生态保护提供基础数据与科学依据。
1 研究区域概况与研究方法
1.1 研究区域概况
若尔盖湿地是世界上面积最大的高寒泥炭沼泽湿地,同时也是黄河上游最重要的水源涵养区,属于大陆性高原气候,寒冷湿润,年平均气温1℃左右,年降水量600~800 mm,土壤类型主要为高寒泥炭土,植被以沼泽植被和草甸植被为主[22]。南海湿地是黄河中游河流湿地包头段的重要组成,属于半干旱中温带大陆性季风气候,年平均气温8.5℃左右,年降水量约300 mm,土壤类型以草甸土为主,盐土和风沙土为辅[23]。黄河三角洲湿地属于滨海湿地,是中国暖温带保存最完整、最广阔和最年轻的湿地生态系统,具有明显的大陆性季风气候特点,雨热同期,四季分明,年平均气温12.1℃左右,年均降水量551.6 mm,土壤类型主要为隐域性潮土和盐土[12]。
1.2 样品采集及检测
2018年10月,分别采集黄河上游若尔盖高寒泥炭湿地土壤、中游南海湿地土壤和下游黄河三角洲湿地土壤为研究对象。土壤采集过程在每个研究区域随机选取5 个土壤采样点,用土壤采样器采集直径7.5 cm,长10 cm 的上层柱状土壤样品,样品采集后4℃低温保存运输到实验室。将各研究区域采集的5 个土壤岩心分别手动去除植物根系和碎石,均匀混合并过2 mm筛,取部分土壤用于初始基本理化性质测定,基本理化性质见表1,测定方法参考《土壤农化分析》[24]。剩余土壤在室内实验开始前4℃低温保存,预处理后的上游若尔盖高寒泥炭湿地土壤、中游南海湿地土壤和下游黄河三角洲湿地土壤分别记为A土、B土和C土。

表1 土壤基本理化性质Table 1 Basic physical and chemical properties of the experimental soil
1.3 研究方法
实验设置对照、低氮(0.005 mgN·g-1)、高氮(0.025 mgN·g-1)、低碳(2 mg 葡萄糖·g-1)、高碳(10 mg 葡萄糖·g-1)五种处理,每种处理设置3 个平行。称取相当于30 g 干土的新鲜土壤(A 土、B 土、C 土)分别置于250 ml 的蓝盖试剂瓶中。将蓝盖试剂瓶放置在恒温光照培养箱中,25℃、12 h光照与黑暗交替条件下培养。分别测量培养后第1、3、5、7、14、21、28 天静态碱液吸收量,计算土壤有机碳矿化速率。分别测量培养前后土壤铵态氮和硝态氮含量,计算净氮矿化速率和净硝化速率。通过每星期称量1 次各土壤及样品瓶的质量,及时补充土壤水分以使其在培养阶段保持恒定。
1.4 计算方法
土壤有机碳矿化速率采用静态碱液吸收法测定[4],计算公式如式(1)所示:

式中,Cmin是土壤碳矿化速率;V0是空白滴定时消耗的标准盐酸的体积;V 是样品滴定时消耗的标准盐酸的体积;CHCl是标准盐酸的浓度;m 是土壤质量,w为土壤水分质量分数,t为培养时间。
假定两次测量期间碳矿化速率恒定且等于末尾测量值,按式(2)计算28 d 培养期间日平均碳矿化速率(Caverage):
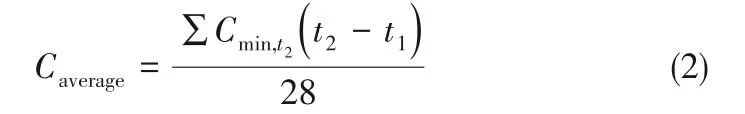
其中,t2-t1表示两次测量的时间间隔。
在培养第28 天计算平均净氮矿化速率(mg·kg-1·d-1)[4]及净硝化速率(mg·kg-1·d-1)[12],以比较不同外源添加对净氮矿化、净硝化速率的影响,计算公式分别如式(3)、式(4)所示:
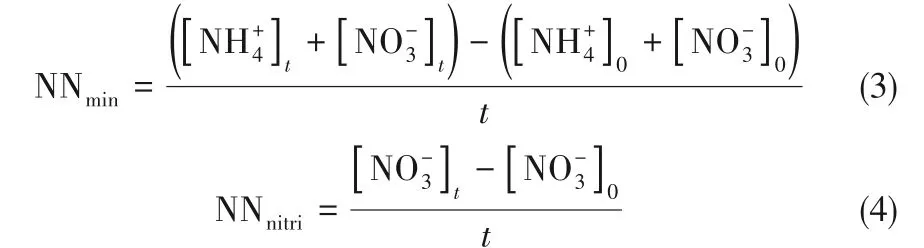
其中,NNmin是净氮矿化速率,NNnitri是净硝化速率,t是培养时间(28 d);[NH4+]0是土壤中铵态氮起始浓度;[NH4+]t是培养结束时土壤中铵态氮的浓度;[NO3-]0是土壤中硝态氮起始浓度,[NO3-]t是培养结束时土壤中硝态氮的浓度。
1.5 数据处理与分析
采用OriginPro 2015 制图,采用SPSS 22.0 完成数据分析。单因素方差分析及LSD 事后多重检验用于比较外源添加对湿地土壤碳、氮矿化与净硝化速率的显著影响。Pearson 相关分析用来了解碳、氮矿化和净硝化速率之间以及与影响因子之间的相关关系。统计显著水平均为α=0.05。
2 结果与讨论
2.1 不同湿地类型对土壤矿化及硝化速率影响
不同湿地类型对土壤矿化及硝化速率影响如图1所示。
由图1 可知,在没有外加碳源、氮源条件下,不同湿地类型对土壤日平均碳矿化速率(Caverage)、净氮矿化速率(NNmin)、净氮硝化速率(NNnitri)有显著影响。A 土Caverage(31.28 mg·kg-1·d-1)、NNmin(0.182 mg·kg-1·d-1)及NNnitri(0.102 mg·kg-1·d-1)均显著高于B 土和C 土。湿地土壤基本理化性质参数对碳、氮矿化及硝化的影响较大,包括含水率、可利用基质含量、温度和pH 等[25-26]。在没有外源添加条件下,不同类型湿地土壤自身理化性质与土壤矿化及硝化速率的Pearson相关性分析见表2。

图1 不同类型湿地土壤碳、氮矿化与硝化速率Fig.1 Carbon and nitrogen mineralization and nitrification rate with different wetland type
由表2 可知,在本试验培养条件下,土壤Caverage、NNmin、NNnitri与土壤含水率、微生物量氮、微生物量碳、有机质、全氮、NH4+-N 含量之间的正相关性较强。A土125%的高含水率以及(299.79±11.19)g·kg-1的高有机质含量使其具有更高的碳、氮矿化及硝化能力,相比之下,土壤贫瘠且盐渍化严重的黄河三角洲[20],土壤有机质含量仅为(19.95±1.37)g·kg-1,是导致其碳、氮矿化及净硝化速率显著低于其他类型湿地土壤的可能原因。此外,微生物量氮、微生物量碳、NH4+-N 含量对湿地土壤碳、氮矿化及净硝化速率也有显著影响。目前研究表明,外加碳源和氮源可能有利于微生物量氮、碳的增加,促进异养菌对有机碳的矿化分解和对无机氮的固定,从而影响土壤碳、氮矿化及硝化速率。
2.2 外源添加对土壤碳矿化速率的影响
外加碳源、氮源对土壤碳矿化速率的影响如图2所示。
由图2(a)可知,外源碳的添加对不同类型湿地土壤Caverage均表现出显著的促进作用(P<0.05),且随碳添加水平的增加促进作用逐渐增强。A土不同碳源添加水平(低碳、高碳)Caverage分别为47.40 mg·kg-1·d-1和82.23 mg·kg-1·d-1;B 土不同碳源添加水平(低碳、高碳)Caverage分别为26.34 mg·kg-1·d-1和37.68 mg·kg-1·d-1;C土不同碳源添加水平(低碳、高碳)Caverage分别为16.59 mg·kg-1·d-1和21.68 mg·kg-1·d-1。低碳与高碳添加背景下,B 土日平均碳矿化速率分别显著提高32.13%和89.04%;A 土Caverage最高,碳添加对其的促进作用也最强,低碳与高碳添加分别使其显著提高51.56%和162.92%;C 土低碳使土壤Caverage与对照相比产生24.10%的增量,但该促进作用并未达到显著水平(P>0.05),仅高碳添加使其显著增加62.14%(P<0.05)。A 土微生物量碳、氮含量均高于其他两类湿地土壤,葡萄糖的添加可直接作为微生物易利用底物分解促进CO2的释放。而对于土壤盐分含量较高的C 土[20],高盐渍化可能对微生物活性产生抑制作用[27]。因此,C 土添加低碳后,碳矿化速率并未显著提升,可见外源碳添加与土壤类型对碳矿化速率存在交互影响。
由图2(b)可知,外源氮的添加对不同类型湿地土壤碳矿化速率的促进作用未达到显著水平(P>0.05)。A 土不同氮源添加水平(低氮、高氮)Caverage分别为34.13 mg·kg-1·d-1和34.52 mg·kg-1·d-1;B土不同氮源添加水平(低氮、高氮)Caverage分别为20.90 mg·kg-1·d-1和21.14 mg·kg-1·d-1;C 土不同氮源添加水平(低氮、高氮)Caverage分别为14.25 mg·kg-1·d-1和14.91 mg·kg-1·d-1。有研究表明外加氮源会通过刺激土壤微生物体活性、增加土壤微生物量促进土壤中有机碳的分解[28]。但本研究发现对于黄河流域三种典型的湿地土壤,外源氮添加对碳矿化速率仅表现出细微的促进作用,低氮处理使土壤Caverage与对照相比产生4.86%~9.14%的变化幅度,高氮处理使其变化幅度在6.04%~11.52%之间,促进作用均未达到显著水平,这与已有研究结果相似[4]。一方面,土壤溶解性有机碳是土壤微生物易于吸收利用的有机碳源,无机氮输入会抑制土壤溶解性有机碳产出[29],从而影响碳矿化速率;另一方面,土壤难分解碳组分在土壤碳库中占有较大比重,该部分有机质碳的分解需要长期的过程才会发生显著变化,因此氮添加的显著影响可能暂未显现[30]。
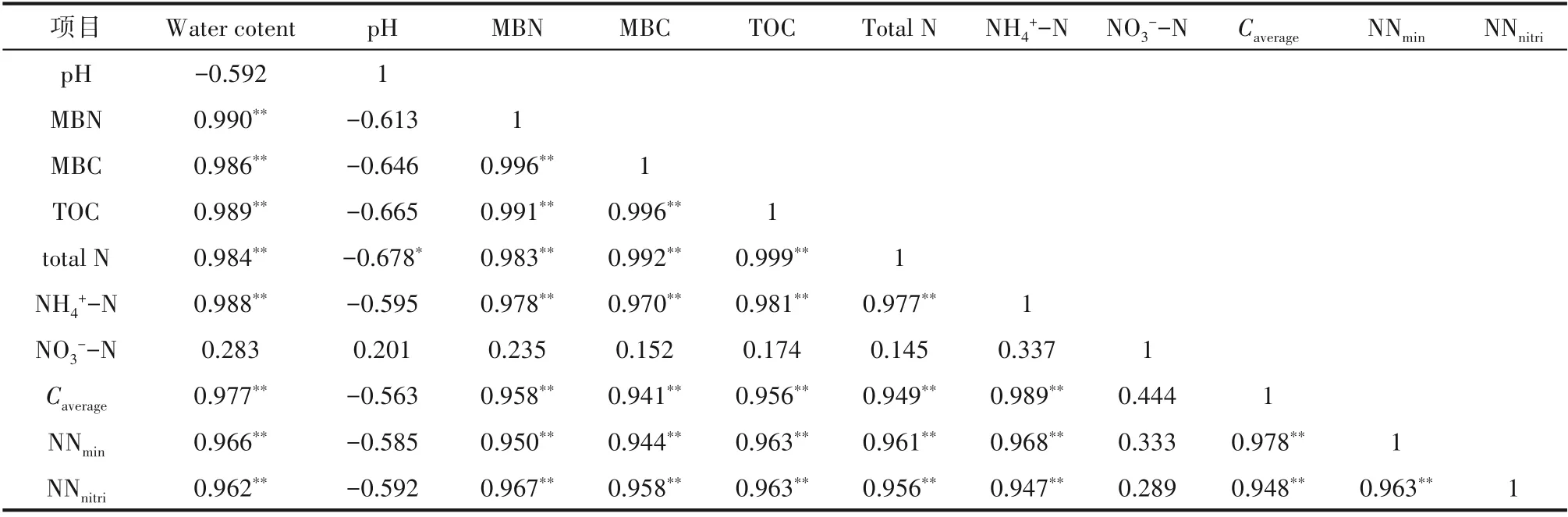
表2 土壤基本理化性质参数与土壤矿化及硝化速率的Pearson相关性分析Table 2 Pearson correlation analysis for physical and chemical parameters and transformation rate of carbon and nitrogen

图2 外源添加对土壤日平均碳矿化速率影响Fig.2 Effects of exogenous addition on average carbon mineralization in soil
2.3 外源添加对土壤净氮矿化速率的影响
外加碳源、氮源对土壤NNmin的影响如图3所示。
由图3(a)可知,低水平碳源添加显著抑制C 土NNmin(P<0.05),但对A 土和B 土NNmin影响不显著(P>0.05),高水平碳源添加对不同类型湿地土壤NNmin均表现出显著的抑制作用(P<0.05)。A土不同碳源添加水平(低碳、高碳)NNmin分别为0.169 mg·kg-1·d-1和0.097 mg·kg-1·d-1;B 土不同碳源添加水平(低碳、高碳)NNmin分别为0.085 mg·kg-1·d-1和0.063 mg·kg-1·d-1;C 土不同碳源添加水平(低碳、高碳)NNmin分别为0.060 mg·kg-1·d-1和0.032 mg·kg-1·d-1。低碳添加对A 土和B 土NNmin没有显著影响,但高碳添加使二者分别显著降低46.40%和46.93%;低碳与高碳添加分别使C 土NNmin显著降低35.48%和65.41%。碳添加对湿地土壤NNmin的抑制作用与土壤微环境中的“矿化-固定”过程有关[31],而土壤中氮的“矿化-固定”与土壤中碳的可利用性密切相关[32],当向土壤中添加含碳量高的物质时,如本研究所采用的葡萄糖,微生物对氮的固定作用增强,这是由于微生物需要额外的矿质氮来代谢含碳量高的物质[33]。已有研究表明,碳添加会增强微生物呼吸速率和对土壤中无机氮的固定,即碳添加导致微生物活性增强,从而使微生物维持自身生长繁殖需要所消耗的无机氮量增加,因此NNmin减弱[34]。A 土和B土有机质含量均高于C 土,相同水平碳源添加对不同类型湿地土壤中可利用有机碳含量增加幅度不同,可能由此导致响应特征存在差异。
由图3(b)可知,低水平氮源添加对三种湿地土壤NNmin影响不显著(P>0.05);高氮添加显著抑制B土、C 土NNmin(P<0.05),但对A 土NNmin影响不显著(P>0.05)。A 土不同氮源添加水平(低氮、高氮)NNmin分别为0.178 mg·kg-1·d-1和0.170 mg·kg-1·d-1;B土不同氮源添加水平(低氮、高氮)NNmin分别为0.109 mg·kg-1·d-1和0.057 mg·kg-1·d-1;C 土不同氮源添加水平(低氮、高氮)NNmin分别为0.074 mg·kg-1·d-1和0.017 mg·kg-1·d-1。低氮添加使土壤NNmin与对照相比产生2.30%~20.33%的变化幅度,促进作用未达到显著水平。高氮添加除没有显著改变A 土NNmin外,使B 土和C 土NNmin分别显著降低51.08%和81.44%。土壤微生物对氮的需求较高,而在短期的培养过程中,低水平的外加氮源能够被微生物全部利用来满足其自身的高氮需求,因此没有进一步影响土壤含氮有机物的分解[4]。A土的微生物量碳、氮均显著高于B 土和C 土,其微生物具有更高的氮需求,且A土本身氮含量较高,因此可能同等高水平的外加氮源对A土本身和其土壤微生物碳氮平衡影响较小,在抑制B土和C土NNmin的情况下,没能对A土NNmin造成显著影响。土壤矿质氮初始含量与培养期间矿化氮产量负相关,这是由于土壤中存在“高矿质氮初始值抑制土壤氮矿化”的控制机制[31]。外加氮源对其他两种类型湿地土壤NNmin的抑制作用可能由于,土壤中的微生物通过分解含氮有机物来获取氮,本试验采用NH4NO3作为外加氮源,添加到土壤中直接增加了微生物可利用氮素的初始含量,因此减弱了为满足微生物氮需求而产生的土壤中含氮有机物的分解[34]。

图3 外源添加对土壤净氮矿化速率影响Fig.3 Effects of exogenous addition on net nitrogen mineralization in soil
2.4 外源添加对土壤净硝化速率的影响
外加碳源、氮源对土壤NNnitri的影响如图4所示。
平均净硝化速率被广泛用于土壤硝化过程的影响因素研究[12-14]。与实时监测速率相比,平均速率虽不能体现土壤硝化速率的动态变化特征,但能反映其整体影响趋势。由图4 可知,外源添加(碳源、氮源)对不同类型湿地土壤NNnitri的影响均未达到显著水平(P>0.05)。外源低碳与高碳添加情景下,A 土NNnitri分别为0.105 mg·kg-1·d-1和0.119 mg·kg-1·d-1,B 土NNnitri分别为0.066 mg·kg-1·d-1和0.050 mg·kg-1·d-1,C 土NNnitri分 别 为0.063 mg·kg-1·d-1和0.053 mg·kg-1·d-1;外源低氮与高氮添加情景下,A土NNnitri分别 为0.111 mg·kg-1·d-1和0.119 mg·kg-1·d-1,B 土NNnitri分 别 为0.100 mg·kg-1·d-1和0.105 mg·kg-1·d-1,C 土NNnitri分 别 为0.085 mg·kg-1·d-1和0.097 mg·kg-1·d-1。外源添加(碳源、氮源)对不同类型湿地土壤NNnitri仅表现出细微的促进或抑制作用,且均未达到显著水平,这与已有研究结果相似[14]。首先,在本研究中,外加碳源、氮源对土壤NNmin均表现出不同程度的抑制(2.3 节),NNmin的降低减少了铵态氮作为硝化底物的供应,但NH4NO3添加到土壤中,部分弥补了由氮矿化作用减弱导致的铵态氮供应减少,缓解了对NNnitri可能产生的显著抑制作用。此外,氨的氧化是土壤硝化过程的限速步骤,有研究表明大气CO2浓度升高能够显著提高氨氧化菌的丰度,并显著提高土壤硝化速率[35]。本研究外加碳源导致CO2排放量增加,由此产生的对土壤硝化速率的促进作用可能弥补了底物供应的不足。此外,有研究表明,室内培养条件下NNnitri随时间延长而减慢[14],本研究采用28 d 培养时间段内的平均硝化速率,降低了外源添加前期对硝化速率可能存在的显著影响。
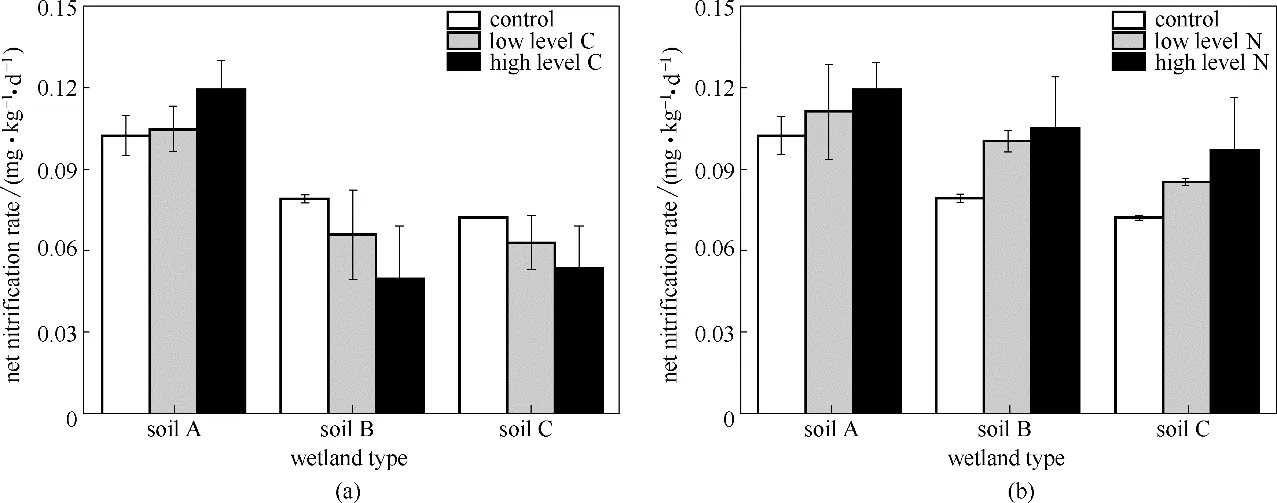
图4 外源添加对土壤净硝化速率影响Fig.4 Effects of exogenous addition on net nitrification in soil
3 结论与建议
(1)在没有外源添加条件下,不同湿地类型对土壤矿化及硝化速率有显著影响。A 土Caverage、NNmin及NNnitri均显著高于B 土和C 土,土壤基本理化性质的差异是导致土壤矿化及硝化速率不同的主要原因。
(2)外源碳的添加对不同类型湿地土壤Caverage均表现出显著的促进作用,且随碳添加水平的增加促进作用逐渐增强;低水平碳源添加显著抑制C 土NNmin,但对A 土和B 土NNmin影响不显著,高水平碳源添加对不同类型湿地土壤NNmin均表现出显著的抑制作用;外源碳的添加对不同类型湿地土壤NNnitri的影响均未达到显著水平。
(3)外源氮的添加对不同类型湿地土壤Caverage的促进作用不显著;低水平氮源添加对不同类型湿地土壤NNmin影响不显著,高氮添加显著抑制B土、C土NNmin,但对A 土NNmin影响不显著;外源氮添加对不同类型湿地土壤NNnitri的影响均未达到显著水平。
(4)黄河流域上游湿地土壤具有更高的碳、氮转化速率,且对外源添加响应敏感,建议对黄河流域上游湿地土壤予以优先保护。

