新型嗜热耐碱脂肪酶的纯化表征及应用
张昕怡,许蕊,王钰棋,张瑜,王飞,李迅
(1 南京林业大学化学工程学院,江苏南京210037; 2 江苏省生物质绿色燃料与化学品重点实验室,江苏南京210037)
引 言
生物催化剂因其环保、高效和特异性等特点而广泛应用于各工业领域[1]。脂肪酶(EC 3.1.1.3)是自然界中最具潜力的工业酶之一,能催化水解、酯化、酯交换等反应,在食品营养、油脂化学工业等方面有较好应用[2]。工业用脂肪酶主要来源于酵母和细菌[3-4],最适温度和pH 范围多为35~45℃和6.5~8.0[5],适应中低温和偏中性的应用环境。目前,中低温脂肪酶在工业应用中存在一些普遍问题,如高温或碱性等条件下易失活等,这在一定程度上限制了脂肪酶的工业应用。在此背景下,人们逐渐关注来自于极端微生物的极端脂肪酶资源的挖掘,如嗜热脂肪酶、碱性脂肪酶、低温脂肪酶及综合多极端脂肪酶等[6-7],以达到工业应用要求。其中,嗜热脂肪酶多从嗜热菌中分离得到,具有催化效率高、冷却能耗低、改善底物可溶性等优点,且在应用时较中低温酶更稳定[8]。耐碱脂肪酶则多从土壤、盐碱湖的耐碱菌中分离得到,常用于洗涤清洁工业[9]。目前报道的嗜热耐碱脂肪酶多来源于芽孢杆菌,其适宜温度在40~60℃之间,最适pH在7.0~9.0之间[9]。
生物柴油是甘油三酯与醇进行酯交换反应获得的脂肪酸烷基酯,是经济无毒的石油代用品[10]。与传统的酸碱催化相比,酶法制备生物柴油具有环境友好、条件温和、易分离等优势[11]。然而,目前工业用脂肪酶多在30~50℃条件下应用,催化时间长且易失活。碱性高温条件能促进疏水反应底物的溶解和加快反应速率,若脂肪酶能适应碱性高温的条件,将具有更广的应用前景。近来,已有研究人员使用嗜热耐碱脂肪酶生产生物柴油,Christopher等[12]利用游离嗜热耐碱脂肪酶催化废餐饮油,在65℃下反应48 h,收率为76%,Sivaramakrishnan 等[13]把嗜热耐碱脂肪酶用于叔丁醇体系,在55℃下催化微藻油40 h,收率可达76%。据此,已报道的极端酶都未能满足生物柴油行业的需求,主要体现在催化时间长、收率低等。因而加大对脂肪酶资源的挖掘显得更加迫切,寻找新的嗜热耐碱脂肪酶对酶法高收率制备生物柴油具有重要意义。
本研究将在大肠杆菌中克隆表达来源于肯尼亚碱性温泉中的解脂嗜热互营杆菌(Thermosyntropha lipolytica)中的脂肪酶(TlLipA),对其纯化和酶学性质表征,并将TlLipA 初步应用于生物柴油的制备,为该酶后续的基因改造和应用奠定理论基础。
1 实验材料和方法
1.1 材料和仪器
1.1.1 实验材料 大肠杆菌Top10 和BL21(DE3)菌株由本实验室保存。引物由上海生工有限公司合成。Taq DNA 聚合酶、限制性内切酶和T4 DNA Ligase 购于Takara 生物技术公司。胰化蛋白胨、酵母提取物等购于Oxoid(Hampshire,England)公司,常用生物试剂卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)购于BIOFROXX(广州,赛国生物科技有限公司)。系列底物对硝基苯酯(p-NP) 和系列脂肪酸甲酯标准品(色谱级)都购于Sigma 公司。月桂醇醚磷酸酯(AEO-7)、十二烷基硫酸钠(SDS)、月桂酸钠(LAS)、吐温80(Tween 80)、聚乙二醇辛基苯基醚(Triton X-100)、乙二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、Tris(三羟甲基氨基甲烷)、磷酸二氢钠、甘氨酸、氢氧化钠等购于国药集团化学试剂有限公司,以上试剂未经特殊指明均为分析纯试剂。大豆油购自益海粮油工业有限公司(泰州,中国)。亲和层析柱(HisTrapTMHP柱)购于美国Novagen公司。
1.1.2 主要仪器 低温液相层析柜、酶标仪,德国Thermo公司;PCR 仪、全自动凝胶成像仪,美国Bio-Rad 公司;气相色谱仪,美国Aglilent 公司;离心机,德国Eppendorf 公司;高速冷冻离心机,美国Beckman 公司;超净工作台,苏州安泰技术有限公司;恒温培养振荡器,上海知楚有限公司。
1.2 重组质粒pET28a-TLL1的构建
根据大肠杆菌优势密码子,对获得的TlLipA氨基酸序列(Genbank No.SHG68904.1)进行密码子优化,优化的TlLipA 基因序列由上海捷瑞生物工程有限公司通过全基因合成。分别以Nco I 和EcoR I 对TlLipA 基因(tll1)及pET28a 进行双酶切反应,酶切后将质粒pET28a 和tll1 连接,转化至大肠杆菌Top10 中,经验证,获得正确的重组质粒pET28a-TLL1。
1.3 重组脂肪酶TlLipA的表达纯化
LB 培养基按参考文献配制[14]。将重组质粒pET28a-TLL1 热激转化大肠杆菌BL21(DE3)细胞内,37℃过夜培养。挑取单菌落接种于含有卡那霉素(50 μg/ml)抗性的LB 液体培养基中,37℃振荡培养至OD600nm值达到0.6~0.8,经终浓度为0.5 mmol/L IPTG 在25℃诱导表达24 h 后,在4℃、8000 g 离心5 min收集菌体细胞。用5 mmol/L咪唑缓冲液(pH 8.0)重悬细胞后,超声波破碎细胞30 min,离心收集上清液获得粗酶液。经60℃,15 min 热处理去除非耐热杂蛋白,离心收集上清液获得热处理酶液。
使用HisTrapTMHP 柱亲和层析柱纯化热处理酶液,收集洗脱产物并经SDS-PAGE电泳验证。
1.4 重组脂肪酶TlLipA的酶活测定方法
以10 μl 20 mmol/L p-NPP 为底物,加入180 μl 50 mmol/L Tris-HCl 缓冲液(pH 8.0),在65℃预热5 min 后,加入10 μl 纯酶液,准确计时反应10 min,加入600 μl 1mol/L 的Na2CO3试剂终止反应,在410 nm 下测定吸光值,以释放的对硝基苯酚的量计算酶活力[15]。酶活力单位(U)定义:在pH 8.0、65℃条件下,每分钟生成1 μmol 对硝基苯酚所需要的酶量为1 U。酶液的蛋白浓度采用Bradford法测定[16]。
1.5 重组脂肪酶TlLipA酶学性质的表征方法
最适反应温度的测定:在45~85℃温度范围内分别测定酶活力,以最高酶活力为100%计;热稳定性的测定:将酶液于55~70℃分别保温不同时间,测定酶活力,以初始酶活力为100%计。
最适反应pH 的测定:在pH 4.0~11.0 范围内分别测定重组脂肪酶TlLipA 的酶活力,以最高酶活力为100%计;pH 稳定性的测定:将酶液于不同pH 缓冲液中室温(25℃)放置1 h,测定酶活力,以初始酶活力为100%计。
金属离子和化学试剂对酶影响的测定:在反应体系中加入不同的金属离子及化学试剂至其终浓度为1 mmol/L,Tween 80 终浓度为0.05%(质量分数),混合保温1 h 后,测定酶活力,以加入等量蒸馏水的酶样品为对照。
底物特异性的测定:测定重组脂肪酶TlLipA 对不同碳链长度对硝基苯酯(p-NP)的偏好特性。测定的底物如下:棕榈酸对硝基苯酯(p-NPP,C16)、肉豆蔻酸对硝基苯酯(p-NPM,C14)、月桂酸对硝基苯酯(p-NPL,C12)、癸酸对硝基苯酯(p-NPD,C10)、辛酸对硝基苯酯(p-NPO,C8)、己酸对硝基苯酯(p-NPC,C6)、乙酸对硝基苯酯(p-NPA,C2)。
动力学反应参数的测定:取不同浓度(0.1~2 mmol/L)的p-NPP 在最适条件下与纯化的TlLipA 反应,测定酶活力,用Sigma-Plot 软件作图,得出动力学反应参数。以上每组实验均做三个平行样,并计算三个平行数据的平均值和标准差。除测定最适pH 和最适温度实验外,其余实验均在最适条件pH 8.0、65℃下测定酶活力。
1.6 重组脂肪酶TlLipA 催化制备生物柴油条件优化
在TlLipA 加量为200 U/g 油、55℃、180 r/min 条件下,采取分批加入甲醇(间隔12 h)的方式,测试不同反应溶剂体系(无溶剂、正己烷、DES) 、不同醇油比(3∶1~5∶1)、不同含水率(5%~60%基于油重,下同)条件下的生物柴油收率。
反应溶剂体系的优化:在体系含水率10%,分别设置醇油比为3∶1 和4∶1,在无溶剂、正己烷、DES体系中分别进行反应;醇油比的优化:在含水率10%的无溶剂体系中,分批加入甲醇(单次醇油摩尔比1∶1),间隔12 h 补加,醇油比分别为3∶1、4∶1、5∶1;含水率的优化:在无溶剂体系中,保持醇油比4∶1,分别加入5%~60%油重的水,测试其对生物柴油收率的影响。DES 的配制∶氯化胆碱∶甘油=1∶2(摩尔比)于80℃水浴搅拌1 h。
1.7 生物柴油的检测
内标法定量生物柴油收率。反应结束后,离心取上层产物,用正己烷稀释成一定浓度,加入一定浓度的内标物(十七烷酸甲酯,正己烷配制),混匀后进行气相色谱(GC,Aglilent 7890A)分析。分析条件为:PEG-20M 极性毛细管柱,FID 检测器,载气为高纯氮气,流速为30 ml/min。进样量1 μl,分流比50∶1,进样口和检测器温度分别设为250℃和260℃,初始温度180℃,保温2 min,然后以3℃/min 升至240℃,保温10 min。
2 实验结果与讨论
2.1 重组脂肪酶TlLipA 的表达与纯化
重组质粒pET28a-TLL1 经转化和表达后获得粗酶液,粗酶液通过热处理得到热处理酶液,再经镍柱亲和层析纯化获得纯酶。如图1 列7 所示,镍柱亲和层析洗脱液经SDS-PAGE电泳验证在53×103附近有单一条带,这与目标蛋白TlLipA 大小相符。重组脂肪酶TlLipA 纯化步骤及提纯倍数见表1,由表可知,粗酶液比酶活为1.99 U/mg;热处理后TlLipA 比酶活为6.48 U/mg,酶活回收率为72.42%,纯化倍数为3.26倍;通过镍柱亲和层析纯化,TlLipA比酶活为22.11 U/mg,酶活回收率为24.39%,纯化倍数为11.11倍。
2.2 重组脂肪酶TlLipA 的酶学性质表征
2.2.1 TlLipA 的最适反应温度和温度稳定性 以p-NPP 为底物,分别在45~85℃下测定重组脂肪酶TlLipA 的酶活,图2(a)结果表明,45~65℃该重组脂肪酶TlLipA 酶活力呈直线上升趋势,65℃时酶活力最高,高于70℃后,随着温度的升高酶活呈剧烈下降趋势。重组脂肪酶TlLipA 的最适温度与来自Geobacillus thermodenitrificans AV-5的嗜热脂肪酶的最适温度相当[12],但高于来源Thermophilic Anoxybacillus flavithermus HBB 134、Acinetobacter sp.RAG-1的脂肪酶最适温度[17-18]。

表1 重组脂肪酶TlLipA 的纯化Table 1 The purification of recombinant lipase TlLipA
由图2(b)可得,重组脂肪酶TlLipA 于60℃下保温120 min 后,酶活力为初始活力的70%;于65℃下保温1 h 后酶活保持初始酶活的51%;70℃保温20 min 相对酶活仅为初始酶活的30%。来源于G.thermodenitrificans AV-5 的脂肪酶稳定范围为50~60℃[12],重组脂肪酶TlLipA的热稳定性与之相当。
2.2.2 TlLipA 的最适pH 和pH 稳定性 由图3 可知,重组脂肪酶TlLipA在pH 8.0(50 mmol/L Tris-HCl缓冲液)酶活力最佳且最稳定,图3(a)表明其适宜的pH 范围较宽,在pH 7.0~10.0 酶活力维持在最高酶活力的60%以上。为探究重组脂肪酶TlLipA 的pH 稳定性,将酶液于不同pH 缓冲液中室温(25℃)放置1 h,测定酶活力,以初始酶活力为100%计。图3(b)显示重组脂肪酶TlLipA 的pH 稳定范围宽,在pH 为7.0~11.0 缓冲液中,酶活力保持在80%以上,以上结果表明重组脂肪酶TlLipA 是一种耐碱脂肪酶。

图1 重组脂肪酶TlLipA 的SDS-PAGE 分析Fig.1 SDS-PAGE analysis of the recombinant lipase TlLipA

图2 温度对重组脂肪酶TlLipA酶活力的影响Fig.2 Effect of temperature on lipase activity(a)and stability(b)

图3 pH对重组脂肪酶TlLipA酶活力的影响Fig.3 Effect of pH on lipase activity(a)and stability(b)
大多数脂肪酶的pH 为中性到碱性[5]。来自Bacillus coagulans BTS-3、 Geobadllus stearothermophilus strain-5 纯化的脂肪酶最适pH 分别为8.5、8.0,稳定pH 分别为8.0~10.5、5.0~9.0[19-20],重组脂肪酶TlLipA 最适pH 与两种脂肪酶相当,且其pH稳定范围(7.0~11.0)更为宽泛。
2.2.3 金属离子和化学试剂的影响 由表2 所示,二价阳离子Mg2+、Mn2+对重组脂肪酶TlLipA 有轻微的激活作用,其他测试的金属离子及化学试剂对脂肪酶有一定抑制作用,其中Fe3+和Zn2+,化学试剂SDS、Tween 80、EDTA、AEO-7 的存在下,酶活力严重下降,仅能保持酶初始活力的2%~20%,表明Fe3+和Zn2+,化学试剂EDTA、Tween 80、SDS、AEO-7 对TlLipA 有强烈抑制作用。文献报道来源于T.Anoxybacillus flavithermus HBB 134 的脂肪酶也被Fe3+和Zn2+抑制[17],推测可能的原因是Fe3+和Zn2+占据了底物与酶的结合位点,改变了酶的构象,从而抑制了酶的活性[21];而SDS 作为蛋白变性剂,破坏了酶的空间结构,导致酶活性降低[22];较高浓度的非离子型表面活性剂Tween 80、AEO-7,会进入脂肪酶的活性中心并与其紧密结合,使脂肪酶的活性中心被占据,而无法催化其他底物,因此脂肪酶的活力受到抑制[23];EDTA 对酶有强烈的抑制作用,初步推测该酶是一种金属酶。因此在该酶的使用过程中应严格控制Fe3+、Zn2+,化学试剂SDS、EDTA、Tween 80 和AEO-7 的浓度,避免这些金属离子和化学试剂对酶活力造成强烈的抑制。而蛋白酶抑制剂PMSF 对重组脂肪酶TlLipA 的抑制作用较弱,分析其原因,PMSF 是通过与酶活性中心的丝氨酸反应来抑制蛋白酶活性的,虽然在大多数脂肪酶中,都有丝氨酸残基存在于酶的活性部位[24],但脂肪酶有盖子结构,盖住了活性部位的入口,因此,部分脂肪酶不受PMSF的抑制或略有抑制[25]。
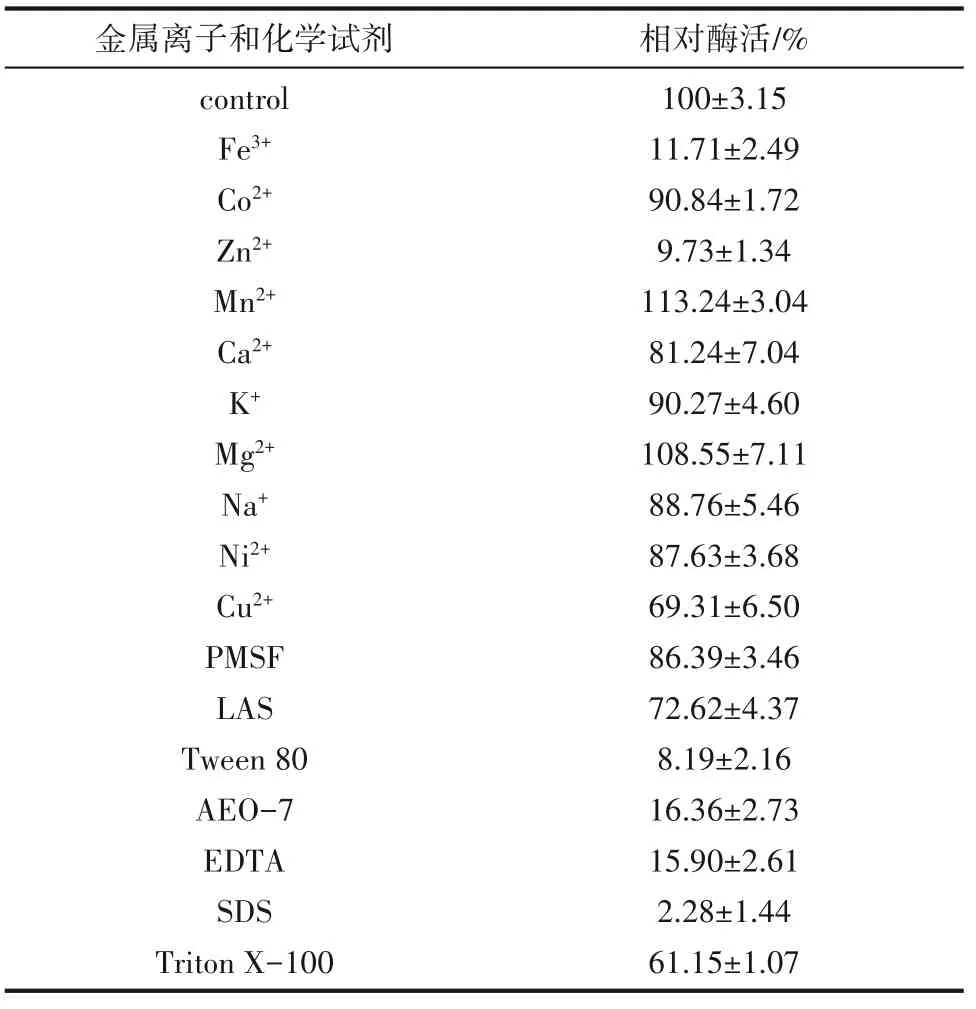
表2 金属离子和化学试剂对酶活性的影响Table 2 Effects of ions and reagents on the activity of the lipase
2.2.4 底物特异性 使用不同碳链长度脂肪酸对硝基苯酯表征TlLipA 的底物特异性。研究表明,该酶偏好的碳链长度范围宽,但对中等碳链长度的脂肪酸对硝基苯酯(辛酸对硝基苯酯,C8)的催化效果最佳(图4)。重组脂肪酶TlLipA 对底物乙酸对硝基苯酯(C2)催化效果较差。来源于Bacillus subtilis 168的脂肪酶对中长碳链脂肪酸对硝基苯酯水解效果好[26],重组脂肪酶TlLipA与之类似。

图4 重组脂肪酶TlLipA的底物特异性Fig.4 The activities of TlLipA toward substrates with different acyl chain lengths
2.2.5 TlLipA 的动力学参数 在含有适当酶量的反应体系中分别加入终浓度0.1~2 mmol/L 的p-NPP,于pH 8.0、65℃条件下反应10 min,测定重组脂肪酶TlLipA 酶活,由Sigma-Plot 软件拟合得到图5所示的米氏方程曲线(R2=0.99),由软件分析得该酶的米氏常数Km为0.23 mmol/L,Vmax为33.50 mmol/(L·min),经计算kcat为22.83 s-1。目前报道的嗜热耐碱脂肪酶的动力学参数如表3 所示,与来源于T.Anoxybacillus flavithermus HBB 134 的脂肪酶相比,TlLipA 的Km较大,但Vmax比其高出26倍[17]。此外,与其他脂肪酶相比,重组脂肪酶TlLipA 与底物p-NPP亲和力和反应速率都较高,具有明显优势。

图5 重组脂肪酶TlLipA反应速率和底物浓度的关系Fig.5 Relationship of reaction velocity and substrate concentration of lipase
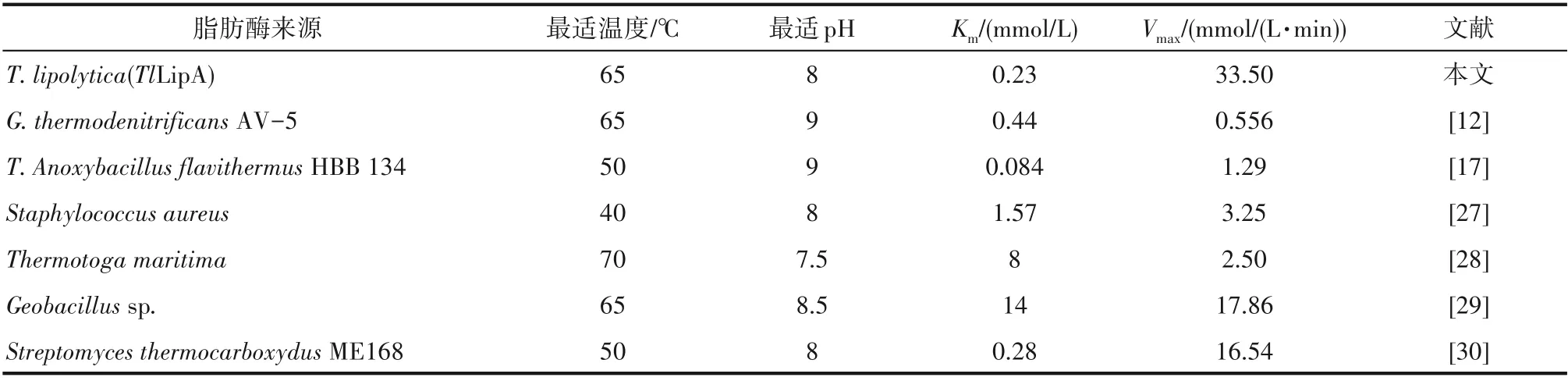
表3 各嗜热耐碱脂肪酶动力学参数比较Table 3 Comparison of kinetic parameters of various thermo-alkaline lipases
2.3 TlLipA催化制备生物柴油
以重组脂肪酶TlLipA 为生物催化剂,催化大豆油制备生物柴油,采用气相法检测,内标法定量。如图6所示,十七烷酸甲酯(2)为内标物,催化产物由棕榈酸甲酯(1)、硬脂酸甲酯(3)、油酸甲酯(4)、亚油酸甲酯(5)、亚麻酸甲酯(6)组成,结果与原料大豆油中脂肪酸种类一致,产物中亚油酸甲酯最为丰富,硬脂酸甲酯较少。

图6 气相色谱图Fig.6 Gas chromatography spectrometry of standard sample mixture and reaction production
本文初步优化了生物柴油的制备条件。由于制备过程涉及疏水底物的溶解等问题,不同溶剂体系对生物柴油的制备有着重要影响。本文选用传统有机溶剂正己烷体系、绿色廉价的深度共熔溶剂DES 体系与无溶剂体系进行比较。在体系含水率10%,重组脂肪酶TlLipA 加量为200 U/g 油,55℃、180 r/min 条件下,分别设置醇油比为3∶1 和4∶1 反应。如图7所示,以上三种溶剂体系中,无溶剂体系在不同醇油比下收率都较高,分别为68.31%和82.75%。正己烷作为溶剂的体系,收率仅为50.94%和64.24%,分析其原因,可能是由于其对副产物甘油、酰基受体甲醇的溶解度较差,且不利于酶稳定[31-32]。DES 作为反应溶剂的收率分别为51.92%和73.32%,收率也不如无溶剂体系,且DES 溶剂的回收利用不便,而无溶剂体系最为经济,因而选择无溶剂体系进行后续实验。

图7 反应溶剂体系的比较Fig.7 Comparison of reaction systems

图8 醇油比对收率的影响Fig.8 Effect of methanol to oil ratio on the yield

图9 含水率对收率的影响Fig.9 Effect of water content on the yield
在制备过程中,过量的甲醇易从脂肪酶表面剥离出必要的水分子,使其失去其良好的结构和活性,从而抑制脂肪酶活性[33-34]。本实验在无溶剂体系中,含水率10%,重组脂肪酶TlLipA 加量为200 U/g油,55℃、180 r/min条件下反应,采取分批加入甲醇的方式(间隔12 h),减少甲醇对酶的抑制作用。如图8所示,醇油比由4∶1增至5∶1时对收率进一步提高帮助不大,过量甲醇对该酶有一定抑制作用,因而醇油比4∶1为最佳。
脂肪酶制备生物柴油的过程中,过量的水存在时可能导致反应平衡向逆反应方向移动,从而导致收率下降[35]。水量过少,酶的活动空间受限,影响其与反应底物的结合,因而选择优化体系含水率。本实验在无溶剂体系中,醇油比4∶1,重组脂肪酶TlLipA 加量为200 U/g 油,55℃、180 r/min 条件下反应48 h,设置5%~60%的含水率进行比较。当体系含水率达到20%时,收率最高(图9)。由上述实验可知,在无溶剂体系中,含水率为20%,重组脂肪酶TlLipA 加量为200 U/g 油,醇油比为4∶1,在55℃催化反应48 h,生物柴油收率可达91.75%。

表4 各嗜热耐碱脂肪酶制备生物柴油比较Table 4 Comparison of preparation of biodiesel using various thermo-alkaline lipases
已报道的利用嗜热耐碱脂肪酶制备生物柴油汇总如表4 所示,本研究脂肪酶在较短时间内获得的收率最高。以上结果表明,重组脂肪酶TlLipA 能较好地应用于生物柴油的制备,且制备过程简单经济,生物柴油收率较高。在后续研究中,针对耗酶量较大和稳定性稍逊的问题,将对该酶进行定向进化等研究,以有效提高重组TlLipA 的活性和稳定性,使其更具工业化应用的潜力。
3 结 论
(1)本文将解脂嗜热互营杆菌(T. lipolytica)的脂肪酶基因源tll1 全基因合成,并通过酶切反应构建重组质粒pET28a-TLL1,在大肠杆菌中成功表达。经热处理和镍柱亲和层析获得纯酶,SDS-PAGE 显示其分子量为53×103,纯化倍数为11.11 倍,比酶活为22.11 U/mg。
(2)表征重组脂肪酶TlLipA 的酶学性质,结果表明重组脂肪酶TlLipA 的最适反应温度为65℃,在65℃保温1 h 后其相对酶活力保持51%;其最适pH 8.0,在pH 7.0~10.0 范围内有较高的稳定性。重组脂肪酶TlLipA 的酶活力主要受到金属离子Zn2+、Fe3+和化学试剂SDS、EDTA、Tween 80、AEO-7 的抑制,需要在该酶的使用过程中严格控制这些组分的浓度。该酶催化中长链脂肪酸对硝基苯酯能力较强,以p-NPP 为底物时,米氏常数Km为0.23 mmol/L,表明其对底物p-NPP的亲和性较高。
(3)将重组脂肪酶TlLipA 用于催化大豆油制备生物柴油,含水率20%,加酶量为200 U/g 油,于55℃、醇油比为4∶1 的无溶剂体系中反应48 h,生物柴油收率可达91.75%,说明该酶于生物柴油的生产有较好的适应性。与其他来源的嗜热耐碱脂肪酶相比,本文的嗜热耐碱脂肪酶TlLipA 除了具有较佳的酶学特性之外,在生物柴油的制备应用中,能在无溶剂含水体系中以较短的时间获得更高的收率,简单经济,因此该酶在生物柴油制备中更具利用前景,后续研究将进一步着重改善酶稳定性和催化效率以期更贴近工业需求。

