新型酚基深共熔溶剂的物性表征及NH3捕集性能研究
程宁宁,曾丽花,邓毓麟,彭海龙,2,黄宽,2
(1 南昌大学资源环境与化工学院,江西南昌330031; 2 南昌大学鄱阳湖环境资源与利用教育部重点实验室,江西南昌330031)
引 言
NH3是一种具有弱碱性和腐蚀性的有害气体,广泛存在于合成氨驰放气、尿素造粒塔尾气、液氨制冷剂逸出气等工业气中[1-2]。如果NH3直接排放到大气中,可能会造成一系列环境问题并严重危害人类健康。然而,NH3又是一种重要的基本化工原材料,广泛应用于化肥、医药中间体、抗菌剂等的生产[3]。因此,从工业气中捕集并回收NH3具有十分重要的意义。目前,工业上应用最广的NH3捕集方法是水洗法[4]和酸洗法[5],它们的优点是成本低、效率高,也存在着吸收剂挥发性大、过程能耗高等缺点。此外,由于吸收剂与NH3作用力过强,被吸收的NH3难以回收利用。因此,开发挥发性低且与NH3作用力适中的新型吸收剂,是推动NH3捕集技术进步的前提。
离子液体由于具有液程宽、挥发性低、热稳定性好、结构可设计等独特性质,而被认为是一类十分具有前景的气体吸收剂[6-9]。将离子液体用于气体吸收分离领域,可大大减少吸收剂的挥发损失及由此造成的潜热损失。此外,利用离子液体的结构可设计性,可将离子液体与气体作用力调控到一个适中的水平,从而实现气体的高效、可逆吸收分离。因此,离子液体为解决传统NH3捕集技术所面临的难题提供了契机。在将离子液体用于NH3吸收分离方面,Yokozeki 等[10-11]首先报道了NH3在各种常规离子液体中的溶解度。随后,研究人员发现质子型离子液体和金属基离子液体具有优异的NH3吸收分离性能[12-13],前者可与NH3形成强氢键相互作用,而后者则可与NH3形成路易斯酸碱相互作用。然而,离子液体通常成本高、黏度大,这极大地限制了它们在NH3捕集中的工业应用。
深共熔溶剂具有与离子液体相似的独特性质,因而又被称为“离子液体类似物”[14-16]。与离子液体相比,深共熔溶剂的制备非常简单,并且原料通常价廉易得、具有生物可降解性。因此,深共熔溶剂常作为离子液体替代物,用于包括气体吸收分离在内的众多领域[17-19]。深共熔溶剂通常由两种或三种组分构成,各组分之间形成氢键相互作用,这改变了各组分的电荷分布,使得深共熔溶剂的熔点要低于构成其的任一组分。构成深共熔溶剂的常见氢键受体为季铵卤盐,常见氢键供体有羧酸、多元醇、酰胺等。虽然诸多研究已报道了深共熔溶剂用于酸性气体(如CO2、SO2、H2S等)的吸收分离[20-24],而将深共熔溶剂用于碱性气体NH3吸收分离的报道仍然十分有限。例如,Akhmetshina 等[25]测定了NH3在甲基磺酸盐类深共熔溶剂中的溶解度;Duan 等[26-27]测定了NH3在氯化胆碱类深共熔溶剂中的溶解度。这些深共熔溶剂缺少对NH3具有较强作用力的功能基团,因而对NH3的吸收容量较低。为此,Yang 等[28-31]构建了弱质子酸类深共熔溶剂,Deng 等[32-36]构建了质子型盐类深共熔溶剂。这些深共熔溶剂由于对NH3具有较强的氢键或酸碱相互作用,因而具有优异的NH3吸收分离性能。
本文以氯化1-乙基-3-甲基咪唑([Emim]Cl)为氢键受体,苯酚、间苯二酚和间苯三酚为氢键供体,构建了一类新型酚基深共熔溶剂。酚类化合物是一类弱质子酸,可与NH3形成较强的氢键或酸碱相互作用。本文详细测定了酚基深共熔溶剂在不同温度下的密度和黏度,系统考察了酚基深共熔溶剂对NH3的吸收-解吸性能和吸收选择性,并深入探究了NH3在酚基深共熔溶剂中吸收的相互作用机制。
1 实验部分
1.1 试剂
NH3(≥99.99%(体积))和CO2(≥99.99%(体积))由江西华盛特种气体有限公司提供;氯化1-乙基-3-甲基咪唑([Emim]Cl,≥99%(质量)) 由上海成捷化学有限公司提供;苯酚(≥99%(质量))、间苯二酚(≥99%(质量)) 和间苯三酚(≥99%(质量)) 由上海泰坦科技股份有限公司提供。以上试剂无需提纯,均直接使用。
1.2 深共熔溶剂的制备
将[Emim]Cl 与苯酚、间苯二酚或间苯三酚以一定的比例在333.2 K 下充分混合、搅拌,当混合物形成均一透明的液体时,即得到深共熔溶剂。样品命名为[Emim]Cl+酚类化合物(x∶1),其中x 为[Emim]Cl与酚类化合物的摩尔比。样品使用前,需在333.2 K下真空干燥48 h。
1.3 分析测试仪器
卡尔费休水分仪,上海泰坦TKF-1B 型,相对偏差3%;密度仪,美国安东帕DMA 4500M 型,精度0.00005 g/cm3;黏度仪,美国博勒飞RVDV-II+PRO型,相对偏差1%;核磁共振仪,美国安捷伦400MR DD2 型,使用d6-DMSO 为溶剂以及TMS 为内标物;傅里叶变换红外光谱(FTIR) 仪,美国热电Nicolet 5700型。
1.4 气体溶解度测定
采用双釜法测定气体在溶剂中的溶解度,吸收装置详细介绍可参考相关文献[37-38]。简单来说,该装置有两个不锈钢罐,分别用作储气罐和平衡罐,其温度由水浴(精度0.1 K) 控制,压力由福建上润Wideplus-8 型传感器(精度1.2 kPa) 监测。平衡罐中放置一个磁子,通过磁力搅拌以加速气体吸收。准确称量一定量的溶剂于平衡罐中,然后对整个吸收装置进行抽真空处理。从气体钢瓶充入一定量的气体至储气罐中,此时储气罐压力为P1。打开连接储气罐和平衡罐的阀门,从储气罐充入一定量的气体至平衡罐中,储气罐压力降为P2。由于气体不断被溶剂吸收,平衡罐压力不断降低。待平衡罐压力保持1 h 不变,即可认为气体在溶剂中的吸收达到平衡,此时平衡罐压力为P3。则平衡压力为P3时气体在溶剂中的溶解度可由式(1)计算:
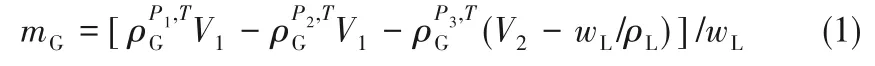
式中,mG为气体溶解度,mol/kg;T 为实验温度,K;ρG为气体密度,mol/m3;V1为储气罐容积,m3;V2为平衡罐容积,m3;wL为溶剂质量,kg;ρL为溶剂密度,kg/m3。气体密度从NIST Chemistry WebBook 获取。从储气罐充入更多的气体至平衡罐中,使气体在溶剂中的吸收达到新的平衡,即可测得不同平衡压力时气体在溶剂中的溶解度。
1.5 量子化学计算
采用高斯09软件包进行量子化学计算,所有构型都使用基于密度泛函理论的B3LYP 方法,在6-31G++(d,p)基组水平上进行优化和频率计算。为了模拟深共熔溶剂的极性环境,使用以DMSO 为介质的极化连续介质模型来进行计算。然后对计算得到的能量进行零点校正,并通过比较不同构型的能量大小来确定最优构型。
2 结果与讨论
2.1 物性表征
本文制备的新型酚基深共熔溶剂包括[Emim]Cl+苯酚(1∶1)、[Emim]Cl+间苯二酚(1∶1)、[Emim]Cl+间苯三酚(1∶1)、[Emim]Cl+间苯三酚(2∶1)和[Emim]Cl+间苯三酚(3∶1)。如图1 所示,酚基深共熔溶剂在常温下为淡黄色至黄色透明液体,而[Emim]Cl、苯酚、间苯二酚和间苯三酚在常温下均为固体。酚基深共熔溶剂的水含量较低,在0.36%~0.48%之间,对其物理性质和NH3捕集性能的影响可忽略不计。

图1 新型酚基深共熔溶剂Fig.1 Novel phenol-based DESs
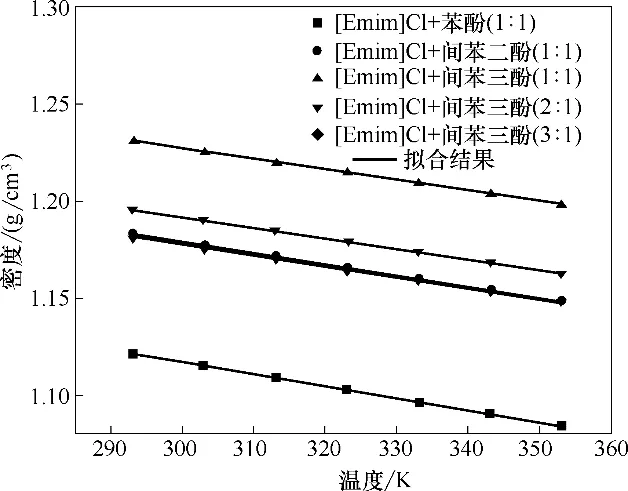
图2 不同温度下酚基深共熔溶剂的密度Fig.2 Densities of phenol-based DESs at different temperatures
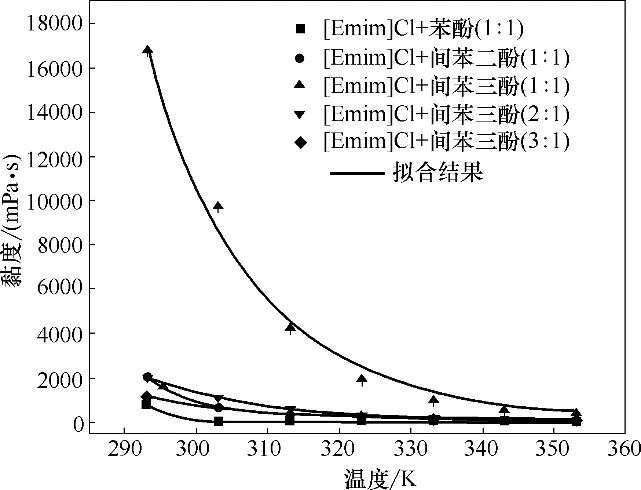
图3 不同温度下酚基深共熔溶剂的黏度Fig.3 Viscosities of phenol-based DESs at different temperatures
密度和黏度是深共熔溶剂的基础物性数据,本文详细测定了酚基深共熔溶剂在不同温度下的密度和黏度,如图2、图3所示,误差根据仪器的标准误差给出,并在图中标注误差棒,由此发现误差极小,可忽略。酚基深共熔溶剂的密度随温度升高而减小,并且几乎呈线性变化。酚基深共熔溶剂的密度随着酚类化合物中羟基数量的增多而增大,即[Emim]Cl+苯酚(1∶1) <[Emim]Cl+间苯二酚(1∶1) <[Emim]Cl+间苯三酚(1∶1),这是因为酚类化合物的羟基数量越多密度也越大。此外,酚基深共熔溶剂的密度随着[Emim]Cl 含量的增多而减小,即[Emim]Cl+间苯三酚(1∶1) >[Emim]Cl+间苯三酚(2∶1) >[Emim]Cl+间苯三酚(3∶1),这是因为[Emim]Cl 的密度比酚类化合物要小。
酚基深共熔溶剂的黏度也随温度升高而减小,但呈非线性变化。酚基深共熔溶剂的黏度随着酚类化合物中羟基数量的增多而增大,即[Emim]Cl+苯酚(1∶1) <[Emim]Cl+间苯二酚(1∶1) <[Emim]Cl+间苯三酚(1∶1),这是因为酚类化合物的羟基数量越多越易形成复杂的分子间氢键网络。此外,酚基深共熔溶剂的黏度随着[Emim]Cl 含量的增多而减小,即[Emim]Cl+间苯三酚(1∶1)>[Emim]Cl+间苯三酚(2∶1) >[Emim]Cl+间苯三酚(3∶1),这是因为酚基深共熔溶剂的[Emim]Cl含量越多羟基密度越小。密度和黏度数据分别用式(2)、式(3)进行关联:
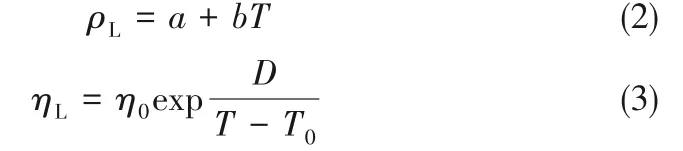
式中,ρL为深共溶溶剂密度,g/cm3;ηL为深共熔溶剂黏度,mPa·s;T 为温度,K;a,b,η0,D,T0为经验参数。关联结果如图2、图3 所示,经验参数的拟合值如表1所示。
2.2 NH3捕集性能
本文首先测定了313.2 K 下NH3在酚基深共熔溶剂中的溶解度,如图4 所示,溶解度数据见表2 和表3,溶解度误差由相平衡时实际监测的压力值±1.2 kPa 计算得出,并在图4 标注误差棒,可以发现,由于NH3溶解度较大,误差不明显,可忽略。NH3溶解度随压力的升高而增大,并且略微呈非线性变化,表明酚基深共熔溶剂与NH3之间存在较强的相互作用,这一作用力来源于酚类化合物的弱酸性。酚基深共熔溶剂的NH3溶解度随着酚类化合物中羟基数量的增多而增大,即[Emim]Cl+苯酚(1∶1) <[Emim]Cl+间苯二酚(1∶1) <[Emim]Cl+间苯三酚(1∶1),这是因为酚类化合物的羟基数量越多酸性也越强。此外,酚基深共熔溶剂的NH3溶解度随着[Emim]Cl 含量的增多而减小,即[Emim]Cl+间苯三酚(1∶1) >[Emim]Cl+间苯三酚(2∶1) >[Emim]Cl+间苯三酚(3∶1),这是因为[Emim]Cl的酸性比酚类化合物要弱得多,因此酚类化合物是NH3在酚基深共熔溶剂中吸收的关键组分。
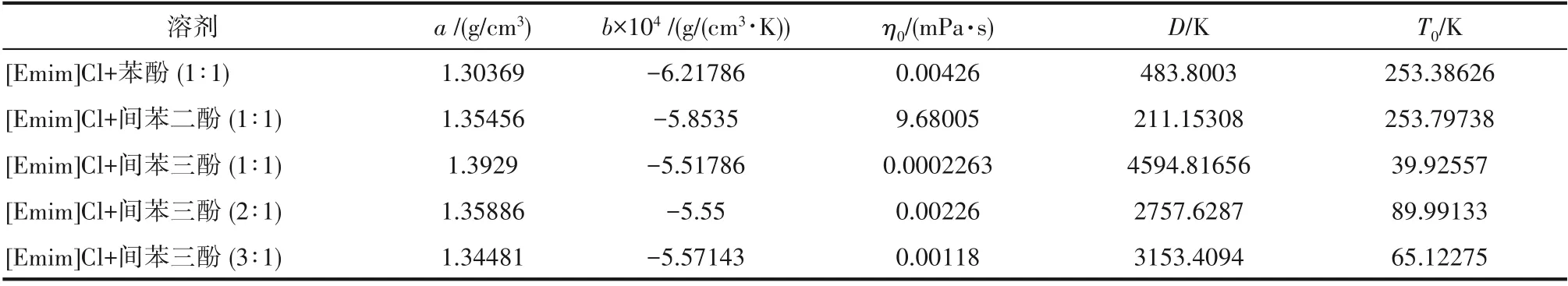
表1 式(2)、式(3)的参数拟合值Table 1 Fitted parameters for Eqs.(2)—(3)
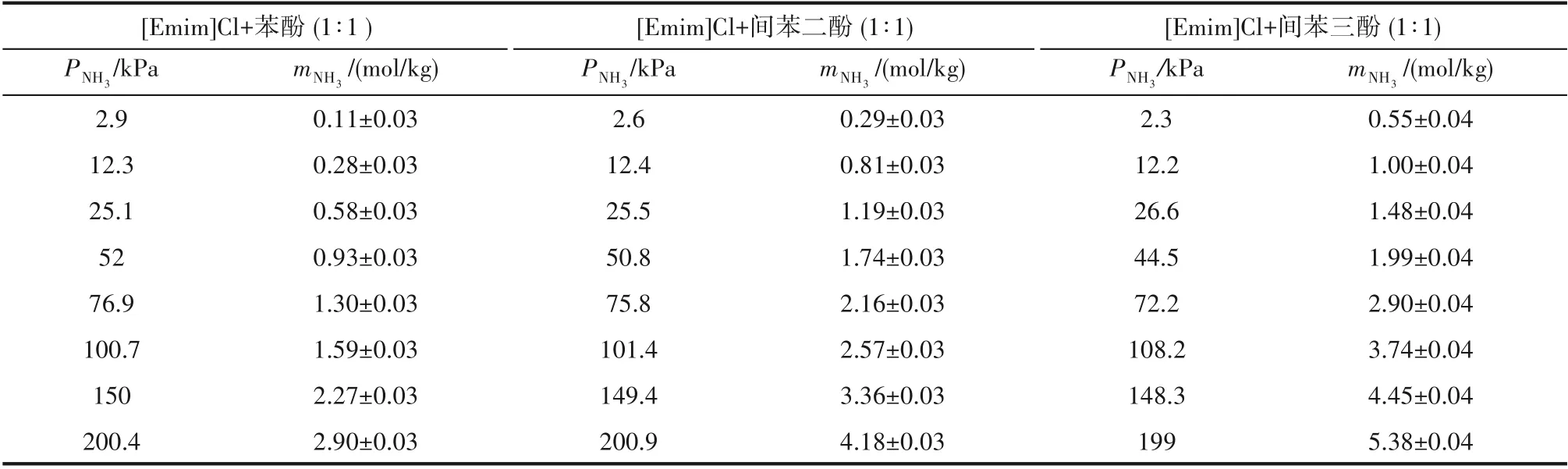
表2 [Emim]Cl+苯酚(1∶1)、[Emim]Cl+间苯二酚(1∶1)、[Emim]Cl+间苯三酚(1∶1)在313.2 K时对NH3的溶解度Table 2 Solubilities of NH3 in[Emim]Cl+phenol(1∶1),[Emim]Cl+resorcinol(1∶1),[Emim]Cl+phloroglucinol(1∶1)at 313.2 K
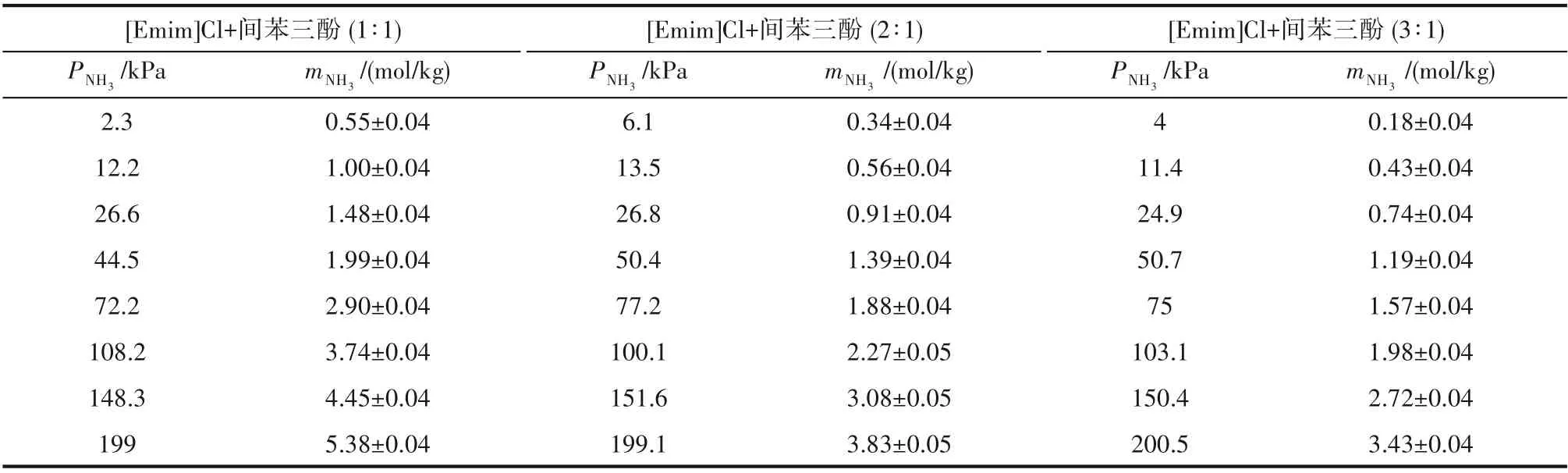
表3 [Emim]Cl+间苯三酚不同比例在313.2K时对NH3的溶解度Table 3 Solubilities of NH3 in[Emim]Cl+phloroglucinol DESs with different molar ratios at 313.2 K

图4 313.2 K下NH3在酚基深共熔溶剂中的溶解度Fig.4 Solubilities of NH3 in phenol-based DESs at 313.2 K
在本文制备的酚基深共熔溶剂中,[Emim]Cl+间苯三酚(1∶1)具有最大的NH3溶解度,在313.2 K 和108.2 kPa 下其NH3吸收容量可达3.742 mol/kg,高于多数文献报道的离子液体和深共熔溶剂[10-11,25-28,39-41],如表4 所示。本文选取[Emim]Cl+间苯三酚(1∶1)为代表来考察温度对NH3溶解度的影响,如图5 所示(误差分析方法同图4),其溶解度数据见表5。NH3溶解度随着温度的升高而减小,表明NH3在酚基深共熔溶剂中的吸收是一个放热过程。鉴于压力和温度对NH3溶解度的影响规律,被酚基深共熔溶剂吸收的NH3可在加热和减压的条件下释放出来。如图6 所示,[Emim]Cl+间苯三酚(1∶1) 经过多次循环,其NH3吸收容量从第一次开始基本保持不变,第一次循环的容量损失可能是由于解吸不完全造成的,使得解吸后的[Emim]Cl+间苯三酚(1∶1)仍然残留小部分NH3。对于解吸不完全现象,尝试将解吸温度提升为373.2 K,发现NH3残余量与解吸温度为363.2 K 时差别不大。不完全解吸可能是由于间苯三酚的酸性较强,温度为25℃时,间苯三酚酸性系数pKa=8.88,所以间苯三酚和NH3的相互作用比较大。考虑到进一步提高解吸温度会大大增加能耗,因此本文将解吸温度设定为363.2 K。

表4 对比其他深共熔溶剂和离子液体对NH3或CO2的溶解度Table 4 Comparison with other deep eutectic solvents and ionic liquids for NH3 or CO2 absorption
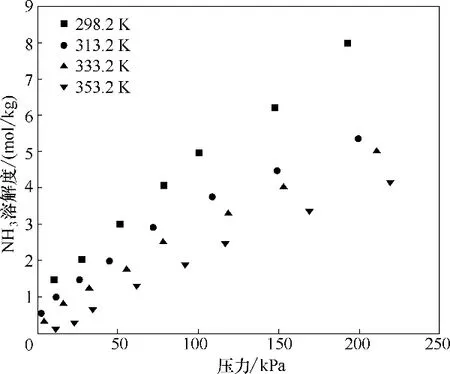
图5 不同温度下NH3在[Emim]Cl+间苯三酚(1∶1)中的溶解度Fig.5 Solubilities of NH3 in[Emim]Cl+phloroglucinol(1∶1)at different temperatures
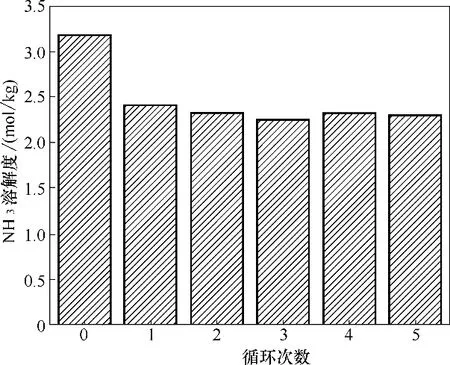
图6 NH3在[Emim]Cl+间苯三酚(1∶1)中的循环吸收(吸收条件:333.2 K、约100 kPa;解吸条件:363.2 K、约0.1 kPa)Fig.6 Recycling of NH3 absorption in[Emim]Cl+phloroglucinol(1∶1)(absorption condition:333.2 K,about 100 kPa;desorption condition:363.2 K,about 0.1 kPa)
由于含NH3工业尾气中通常还含有N2、H2、CO2等气体,因此本文还尝试测定了313.2 K 下N2、H2和CO2在[Emim]Cl+间苯三酚(1∶1) 中的溶解度,其数据见表6。发现在实验压力范围内(0~250 kPa),N2和H2在[Emim]Cl+间苯三酚(1∶1) 中的溶解度低于吸收装置的最低检测限,因此本文未给出N2和H2的溶解度数据。而CO2在[Emim]Cl+间苯三酚(1∶1)中的溶解度高于吸收装置的最低检测限,如图7 所示(误差分析方法同图4)。CO2溶解度比NH3溶解度低两个数量级,预计[Emim]Cl+间苯三酚(1∶1) 对NH3/CO2的吸收选择性在100 以上,具有优异的NH3选择性吸收能力。
2.3 NH3吸收机理
为了阐明NH3在酚基深共熔溶剂中吸收的相互作用机制,本文测定了[Emim]Cl+间苯三酚(1∶1)吸收NH3前后的1H NMR 谱图和傅里叶变换红外光谱图,如图8、图9 所示。在[Emim]Cl+间苯三酚(1∶1)的1H NMR谱图中,δ9.07处有一个信号较弱的宽峰,为酚类化合物的羟基质子峰。吸收NH3后,这一羟基质子峰向高场偏移到了δ 8.13 处,表明酚类化合物的羟基与NH3之间形成了较强的相互作用。其他质子峰未发生明显变化,表明其他基团与NH3之间作用力非常弱。由1H NMR 谱图可知,酚类化合物是NH3在酚基深共熔溶剂中吸收的关键组分,这与NH3吸收实验结果一致。而[Emim]Cl+间苯三酚(1∶1)的傅里叶变换红外光谱图在吸收NH3前后未发生明显变化,说明酚类化合物的羟基与NH3之间并未发生质子转移,它们之间可认为是一种强氢键相互作用。

表5 [Emim]Cl+间苯三酚(1∶1)在不同温度下对NH3的溶解度Table 5 Solubilities of NH3 in[Emim]Cl+phloroglucinol(1∶1)at different temperatures
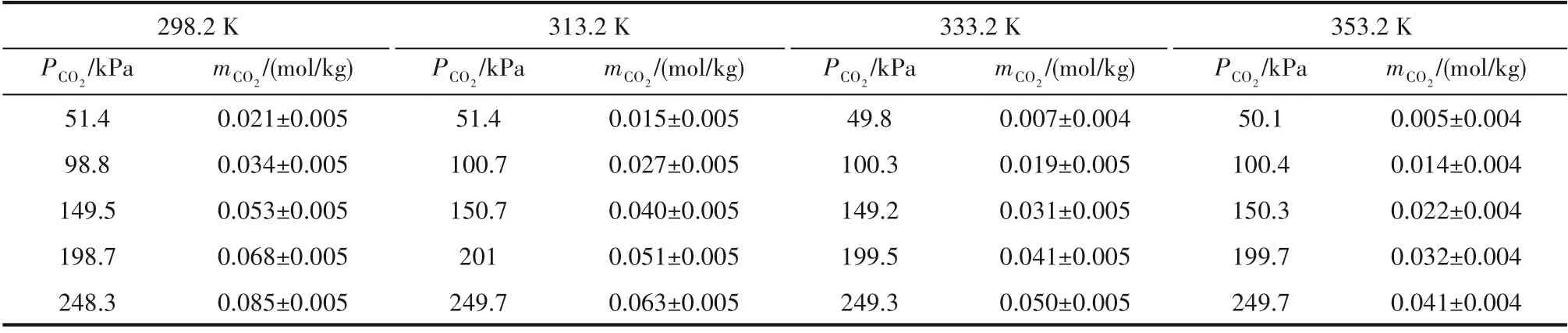
表6 [Emim]Cl+间苯三酚(1∶1)在不同温度下对CO2的溶解度Table 6 Solubilities of CO2 in[Emim]Cl+phloroglucinol(1∶1)at different temperatures
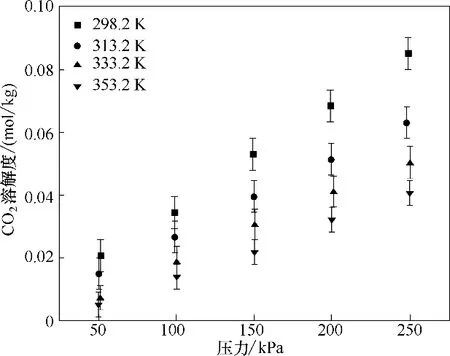
图7 不同温度下CO2在[Emim]Cl+间苯三酚(1∶1)中的溶解度Fig.7 Solubilities of CO2 in[Emim]Cl+phloroglucinol(1∶1)at different temperatures
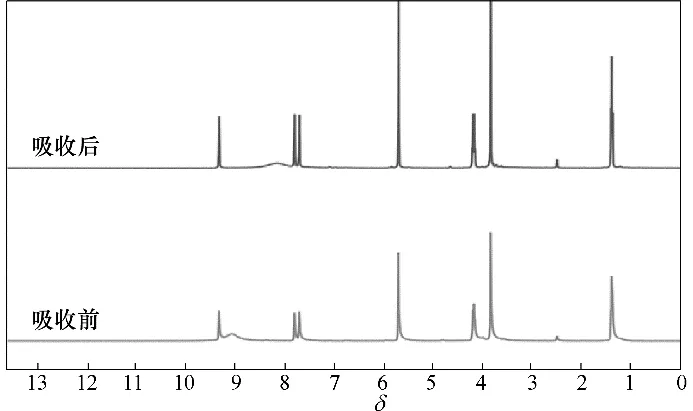
图8 [Emim]Cl+间苯三酚(1∶1)吸收NH3前后的1H NMR谱图Fig.8 1H NMR spectra of[Emim]Cl+phloroglucinol(1∶1)before and after NH3 absorption
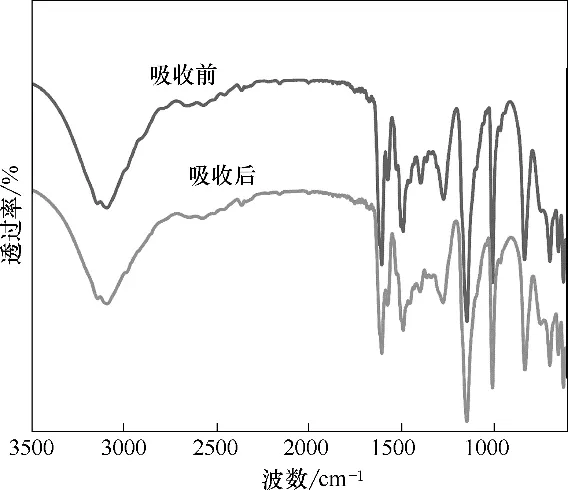
图9 [Emim]Cl+间苯三酚(1∶1)吸收NH3前后的傅里叶变换红外光谱图Fig.9 FTIR spectra of[Emim]Cl+phloroglucinol(1∶1)before and after NH3 absorption
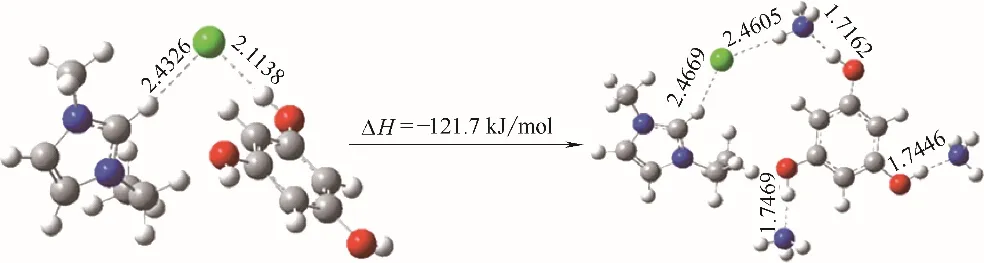
图10 [Emim]Cl+间苯三酚和[Emim]Cl+间苯三酚+NH3体系的最优构型Fig.10 Optimized configurations for[Emim]Cl+phloroglucinol and[Emim]Cl+phloroglucinol+NH3 systems
本文还采用量子化学方法对[Emim]Cl+间苯三酚和[Emim]Cl+间苯三酚+NH3体系的构型进行了优化,如图10所示。在[Emim]Cl+间苯三酚体系中,Cl-与酚羟基之间形成了氢键,这与[Emim]Cl 作为氢键受体而间苯三酚作为氢键供体的事实一致。在[Emim]Cl+间苯三酚+NH3体系中,两个NH3分子分别与两个自由酚羟基作用,另一个NH3分子同时与Cl-和酚羟基作用,总作用焓变为-121.7 kJ/mol。在量化模拟中,吸收过程简化为由有限数量的分子表示,以此来探究气体与溶剂的相互作用模式和强度。而真正的吸收过程涉及大量的分子,并且受可逆化学平衡的限制。根据量化模拟结果,[Emim]Cl+间苯三酚可同时与3 个NH3分子相作用,浓度约为11 mol/kg。而[Emim]Cl+间苯三酚与每个NH3分子的作用焓变平均为-40.3 kJ/mol,这表明[Emim]Cl+间苯三酚与NH3之间为强氢键相互作用,尚未达到不可逆化学反应的强度。虽然在298.2 K 和100.5 kPa 时,NH3在[Emim]Cl+间苯三酚中的吸收量仅为4.983 mol/kg。可以预见,当压力足够高时,NH3在[Emim]Cl+间苯三酚中的吸收量可达到理论值,这是因为压力升高有利于吸收平衡的正向移动。
3 结 论
以氯化1-乙基-3-甲基咪唑([Emim]Cl)为氢键受体,苯酚、间苯二酚和间苯三酚为氢键供键,构建了一类新型酚基深共熔溶剂。详细测定了酚基深共熔溶剂在不同温度下的密度和黏度,并系统考察了酚基深共熔溶剂对NH3的吸收-解吸性能和吸收选择性,还深入探究了NH3在酚基深共熔溶剂中吸收的相互作用机制。研究结果表明,酚基深共熔溶剂与NH3之间存在较强的相互作用,且酚类化合物是NH3在酚基深共熔溶剂中吸收的关键组分。酚基深共熔溶剂的NH3吸收容量高于多数文献报道的离子液体和深共熔溶剂,且被吸收的NH3可在加热和减压的条件下释放出来,此外酚基深共熔溶剂还具有优异的NH3选择性吸收能力。因此,酚基深共熔溶剂是一类具有潜在应用价值的NH3捕集介质。
——以高中化学“氢键”的教学为例

