血清miR-139-5p、miR-146b-5p水平在乳腺癌诊断中的临床价值
唐志金,于海文,沈 华
上海嘉定区南翔医院普外科,上海 201802
乳腺癌是普外科常见肿瘤,其发病率逐年升高,严重威胁着女性的健康。其治疗方法主要有手术、化疗和放疗等,虽然治疗的疗效得到极大改善,但复发和转移仍然得不到有效控制,是导致死亡的重要原因。乳腺癌早诊断和早治疗是提高预后的关键,临床上对乳腺癌的诊断主要依靠B超、钼靶和CT等传统检查方式,仍然缺乏特异性的检测指标[1]。微小RNA(miRNA)是近年来发现的一类调控基因表达的小分子RNA,与肿瘤的发生、发展具有密切关系,是潜在的诊断和药物治疗的靶点,同时,血液中的miRNA具有稳定性好、可长期保存和耐降解等特点,是筛查和诊断肿瘤的潜在生物标志物[2]。有研究证实,血清miR-139-5p、miR-146b-5p在乳腺癌筛查中出现异常表达[3]。本研究通过对乳腺癌患者血清miR-139-5p、miR-146b-5p进行检测,观察其在乳腺癌早期诊断中的临床价值,现报道如下。
1 资料与方法
1.1一般资料 选择2017年1月至2018年12月在本院诊治的乳腺癌患者117例为乳腺癌组,患者年龄39~79岁,平均(53.64±6.17)岁;病理类型:浸润型导管癌61例,浸润型小叶癌56例;TNM分期:Ⅰ期32例,Ⅱ期43例,Ⅲ期42例;分化程度:低分化49例,中高分化68例。选择同期在本院就诊的乳腺纤维腺瘤患者75例为乳腺纤维腺瘤组,患者年龄42~79岁,平均(54.13±7.16)岁。选择同期在本院体检健康者45例为健康对照组,年龄40~79岁,平均(53.49±8.16)岁。纳入标准:乳腺癌、乳腺纤维腺瘤患者均经病理确诊。排除标准:(1)其他部位的恶性肿瘤;(2)术前经放疗或者化疗;(3)临床资料不全;(4)血液性和免疫性疾病;(5)智力障碍或者精神性疾病。3组研究者的年龄等基线资料比较,差异无统计学意义(P>0.05),具有可比性。所有研究者均知情同意并签署知情同意书,本研究经本院伦理委员会审核通过。
1.2方法
1.2.1血清标本留取和指标的检测 患者入院时和手术后1周分别抽取肘静脉血2 mL,放置于乙二胺四乙酸抗凝管中。采用离心机将血液离心,离心半径为15 cm,3 000 r/min离心15 min,抽取上清液放置于除酶管内,置-70 ℃冰箱中保存。血清糖类抗原(CA)153水平采用酶联免疫吸附试验法,使用瑞士罗氏公司生产的全自动电化学发光免疫分析仪E-170检测,测定试剂盒及质控品为仪器配套产品。
1.2.2实时荧光定量PCR(qPCR) 总RNA的提取:采用mirVana PARIS Kit(Ambion公司,美国)试剂盒提取和纯化miRNA,在血清200 μL中加入1 000 μL的溶解试剂,静置于室温下15 min,根据试剂盒说明书提取血清中的RNA,并用DEPC溶解总RNA。通过试剂盒将RNA反转录为cDNA,根据试剂盒One Step PrimeScript miRNA cDNA Synthesis Kit,将PCR参数设定为:37 ℃ 60 min,85 ℃ 5 s。qPCR:采用TaqMan®miRNA反转录试剂盒将提取的miRNA反转录成cDNA ,根据使用说明书配制20 μL的qPCR反应体系,并进行PCR的扩增。根据设计软件primer express 3.0合成qPCR检测引物探针。miR-139-5p上游引物序列:5′-CTC TGC TCT ACA GTG CAC GTG TC-3′;下游引物序列:5′-TAT GGT TGT TCT CGA CTC CTT CAC-3′。miR-146b-5p上游引物序列:5′-CAA CCT TGA GAA CTG AAT TCC ATA-3′;下游引物序列:5′-AAA GGT TGA TCT CGT CTC TCT GTC-3′。U6的上游引物序列:5′-ATT GGA ACG ATA CAG AGA AGA TT-3′;下游引物序列:5′-GGA ACG CTT CAC GAA TTT G-3′。 采用Maxima SYBR Green qPCR Kit (Thermo scientific公司,美国),根据试剂盒说明书,设计反应条件:95 ℃进行15 min的预变性,循环参数设置为94 ℃变性15 min,在55 ℃退火30 s,并在72 ℃延伸30 s,总共反应40个循环,根据溶解曲线设置荧光信号。以U6为内参[4],结果以2-ΔΔCt表示相对表达值,其中ΔΔCt=(Ct实验组目的基因-Ct实验组U6)-(Ct对照组目的基因-Ct对照组U6)。
1.2.3观察指标 观察各组血清miR-139-5p、miR-146b-5p、CA153水平的变化及诊断效能。
2 结 果
2.13组血清miR-139-5p、miR-146b-5p和CA153水平的变化 乳腺癌组术前血清miR-139-5p、CA153水平高于乳腺纤维腺瘤组(t=11.997、6.534,均P<0.001)和健康对照组(t=14.848、18.362,均P<0.001),乳腺纤维腺瘤组明显高于健康对照组(t=3.406、32.505,均P<0.001),乳腺癌组术后血清miR-139-5p、CA153水平较术前明显降低(t=15.667、17.540,均P<0.001)。乳腺癌组的术前血清miR-146b-5p水平明显低于乳腺纤维腺瘤组(t=10.937,P<0.001)和健康对照组(t=7.637,P<0.001),乳腺纤维腺瘤组明显低于健康对照组(t=3.285,P=0.002),乳腺癌组术后血清miR-146b-5p水平明显高于术前(t=17.540,P<0.001)。见表1。

表1 3组血清miR-139-5p、miR-146b-5p和CA153水平的变化
2.2血清miR-139-5p、miR-146b-5p和CA153水平在乳腺癌中的诊断效能 与CA153比较,血清miR-139-5p(P=0.001)和 miR-146b-5p(P=0.007)对乳腺癌具有更高的诊断效能。通过对miR-139-5p和 miR-146b-5p指标的Logistic回归分析得到方程Y=1.325XmiR-139-5p-1.334XmiR-146b-5p+1.281,miR-139-5p和 miR-146b-5p联合检测的灵敏度为86.6%,特异度为89.3%,曲线下面积(AUC)为0.930,明显高于miR-139-5p(P=0.006)和 miR-146b-5p(P=0.001)单项检测,而miR-139-5p与 miR-146b-5p比较差异无统计学意义(P=0.415)。见表2。
2.3乳腺癌血清miR-139-5p和miR-146b-5p水平的相互关系 乳腺癌血清miR-139-5p水平与miR-146b-5p水平呈负相关(r=-0.765,P<0.05)。
2.4血清miR-139-5p和miR-146b-5p水平与临床指标的相关性 血清miR-139-5p和miR-146b-5p水平与淋巴转移、TNM分期和分化程度具有明显相关性(P<0.05),与年龄、肿瘤直径、雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)和病理类型无明显相关性(P>0.05)。见表3。
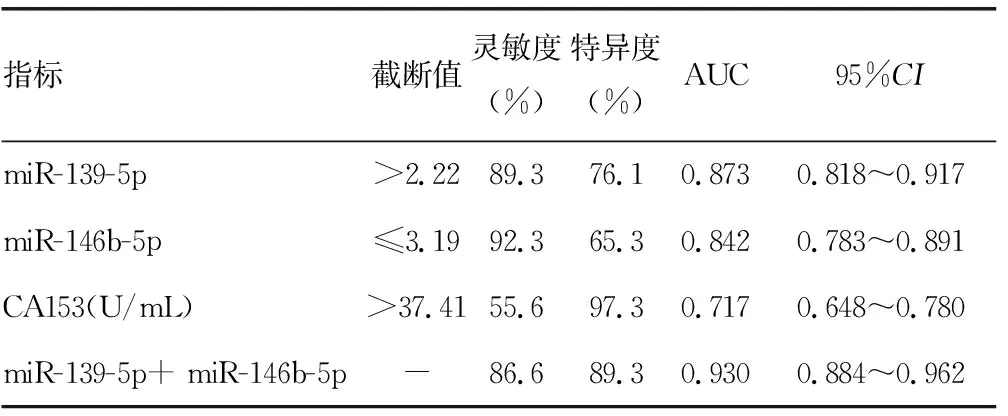
表2 血清miR-139-5p、miR-146b-5p和CA153水平对乳腺癌的诊断效能

表3 血清miR-139-5p、miR-146b-5p水平与临床指标的相关性
3 讨 论
随着对乳腺癌研究的深入,越来越多学者认为miRNA的表达在细胞生命活动信号转导调控中具有重要调控作用,可参与细胞增殖、分化和血管生成等生命活动过程。miRNA在血清等多种体液中具有不同程度表达,且表达相对稳定,多次冻融不易被分解,可以长期保存,同时具有以下特点[5-7]:(1)组织特异性,不同组织具有不同的miRNA,可以作为某一细胞的组织特异性标志物;(2)保守性,不同细胞或组织之间具有相同或者相似的miRNA序列;(3)时空特异性,不同发育阶段具有不同的miRNA表达;(4)执行一定的生物能力,对生命活动具有一定的调节作用。
本研究发现,乳腺癌患者术前血清miR-139-5p水平明显高于乳腺纤维腺瘤组和健康对照组,而乳腺纤维腺瘤组又明显高于健康对照组,乳腺癌组术后血清miR-139-5p水平较术前出现明显降低,说明miR-139-5p参与了乳腺癌的发生、发展过程。miR-139-5p在乳腺癌中的研究较少[8-9],而在其他肿瘤如结肠癌、宫颈癌和甲状腺癌中有异常表达[10-12]。在结肠癌的研究中发现,miR-139-5p在癌组织较在正常组织表达明显下降,且与肿瘤的分期相关,上调能够显著抑制结肠癌的转移潜能和药物抵抗,促进肿瘤细胞的凋亡。在一项前列腺癌的研究中发现,miR-139-5p在肝癌组织中呈低表达,而在癌旁组织中呈高表达,在前列腺癌的研究中为抑癌基因[13]。而郑奋薇等[14]研究表明,前列腺癌复发组血清miR-139-5p水平明显高于未复发组,复发转移患者血清miR-139-5p水平与肿瘤分期、Gleason评分和血清前列腺特异抗原水平具有明显相关性,并认为血清miR-139-5p水平对预测前列腺癌复发和转移具有重要的临床价值。本研究中,miR-139-5p在乳腺癌中表现为癌基因的作用,并且其表达强度与淋巴转移、TNM分期和分化程度有明显相关性,而与年龄、肿瘤直径、ER、PR、HER-2和病理类型无明显相关性。本研究结果显示,当血清miR-139-5p>2.22,其灵敏度为89.3%,特异度为76.1%,AUC为0.873,AUC明显高于CA153的0.717,说明miR-139-5p对诊断乳腺癌具有更高的灵敏度和特异度。
本研究结果显示,乳腺癌组的术前血清miR-146b-5p水平明显低于乳腺纤维腺瘤组和健康对照组,乳腺纤维腺瘤组低于健康对照组,乳腺癌组术后血清miR-146b-5p水平明显高于术前,说明miR-146b-5p是乳腺癌的保护基因,与乳腺癌的发生、发展具有一定相关性。miR-146b-5p定位于染色体10q24-26,在不同的组织表达不同,肺、脾脏和胸腺中呈高表达,在非小细胞肺癌、结肠癌和胰腺癌中呈低表达[15-17]。有研究证实,miR-146可以通过调节白细胞介素和肿瘤坏死因子等抑制天然免疫反应[18]。在一项胰腺癌的研究中发现,miR-146b-5p在6株胰腺癌细胞株中呈低表达,而在正常胰腺组织中呈高表达[19]。本研究结果证实,血清miR-146b-5p水平与淋巴转移、TNM分期和分化程度有明显相关性,而与年龄、肿瘤直径、ER、PR、HER-2和病理类型无明显相关性,说明血清miR-146b-5p表达水平是预后的重要因素。本研究结果显示,当血清miR-146b-5p≤3.19,其灵敏度为92.3%,特异度为65.3%,AUC为0.842,AUC明显高于CA153的0.717,说明其对乳腺癌的诊断效能明显优于CA153。miR-139-5p和miR-146b-5p联合检测能够明显提高乳腺癌的诊断效能,其灵敏度为86.6%,特异度为89.3%,AUC为0.930。本研究结果显示,血清miR-139-5p与miR-146b-5p呈负相关,说明miR-139-5p和miR-146b-5p两者在诊断乳腺癌方面具有一定的互补性,miR-139-5p类似于癌基因,miR-146b-5p类似于抑癌基因,其具体机制需要进一步研究。
总之,miR-139-5p和miR-146b-5p参与了乳腺癌的发生、发展过程,对乳腺癌的诊断具有较高的灵敏度和特异度。

