Survivin shRNA-APC双基因对HT-29结肠癌细胞hMLH1、hMSH2表达的影响
袁喜先 王凤荣 陈月 孙元佳 吴雯婷 张玉健
结肠癌作为全球恶性疾病死亡的第四大原因,发病率位居胃肠道肿瘤的第三位。结肠癌的发生发展是一个多时段、多基因调控的复杂过程,涉及细胞增殖和凋亡的不平衡、原癌基因和抑癌基因的失衡、错配修复(MMR)功能障碍等多个因素,其中MMR对结肠癌的影响成为越来越多学者关注的热点。MMR蛋白存在于原核生物、真核生物及人类细胞中,MMR系统编码的一系列蛋白质在维持基因组稳定性中发挥重要作用,hMLH1与hMSH2在人类DNA MMR中起重要作用。本课题组前期实验中成功构建细胞增殖因子短截型核糖核酸(Survivin shRNA)慢病毒载体、腺瘤性结肠息肉病(APC)有效片段慢病毒载体;成功构建Survivin shRNA-APC双基因共表达稳转株;HT-29结肠癌细胞裸鼠皮下转移瘤造模成功;并且已经证明Survivin shRNA-APC双基因可以抑制HT-29结肠肿瘤的增殖,促进凋亡,降低Survivin的表达[1-4]。但目前Survivin shRNA-APC双基因稳转株对MMR基因影响的相关研究尚未进一步深入,因此本实验选取hMLH1与hMSH2作为研究对象,观察双基因对MMR蛋白hMLH1和hMSH2表达的影响,探讨Survivin shRNA-APC对裸鼠皮下移植瘤的抑制情况。
材料与方法
1.材料:选取40只无特定病原体(SPF)级雌性裸鼠,体质量为(20±1.5)g,随机分为5组,每组8只。实验材料和试剂包括:Survivin shRNA-APC双基因稳转细胞株、Survivin shRNA单基因稳转株、APC单基因稳转株、空载稳转株、人类HT-29结肠癌细胞均为本课题组前期实验获得;兔抗人hMLH1、hMHS2抗体、免疫组化所需试剂盒、RNA快速提取试剂盒、聚合酶链反应(PCR)反转录试剂盒、PCR扩增试剂盒hMLH1引物、hMSH2引物、β-ctin引物均购自武汉博士德生物技术有限公司。主要仪器和设备包括:ABI PRISM 7300型PCR扩增仪购自Applied Biosystems公司,Allegra 64R高速冷冻离心机购自长沙湘仪离心机仪器有限公司,iQ5型荧光定量PCR仪(biome)全自动石蜡包埋机(Leica)、连续切片机(Leica)购自德国Leica公司,光学显微镜购自日本Olympus公司。
2.方法
(1)细胞培养:常规操作培养HT-29细胞。将Survivin shRNA-APC双基因载体稳转株、Survivin shRNA单基因稳转株、APC稳转细胞株、载稳转细胞株置于20%的胎牛血清DMEM培养基中重悬,标记后置于37 ℃、5%CO2及湿度饱和的培养箱里繁育,选取处于指数期生长的细胞备用。
(2)动物分组及模型建立:将40只裸鼠按无菌及规范流程喂养2周后,随机分为5组:Survivin shRNA-APC双基因组(双基因组)、Survivin shRNA组、APC组、空载组和空白对照组(空白组),每组8只。动物模型建立:取处于对数期的5组细胞株分别于显微镜下计数,后加入磷酸盐缓冲液(PBS)重悬使细胞浓度达到2×107个/ml,分别在对应的5组实验动物中注入0.2 ml Survivin shRNA-APC双基因载体稳转细胞株、Survivin shRNA单基因载体稳转细胞株、APC稳转株、HT-29结肠癌细胞及空载稳转株,将HT-29结肠癌细胞接种于裸鼠左前腋下,在相同条件下饲养裸鼠并观察成瘤情况。待4周后各组裸鼠均已成瘤,采用颈椎脱臼法杀死裸鼠,剥取瘤块,多聚甲醛固定,石蜡包埋切片,用于后续免疫组化和实时荧光定量PCR(real-time PCR)检测hMLH1、hMHS2的表达。
(3)移植瘤的生长抑制情况评估:每天观察裸鼠接种后的一般状况及移植瘤生长情况,以皮下结节体积≥0.10 cm3为成瘤标准。于皮下注射后第7 d开始,每隔7 d用游标卡尺测量1次移植瘤的长径和短径,并于注射后7 d、14 d、21 d、28 d统计各组裸鼠移植瘤的体积。移植瘤体积(cm3)=0.5×移植瘤长径(cm)×[移植瘤短径(cm)]2。于皮下注射后的第4周处死裸鼠后剥离皮下移植瘤,测量计算移植瘤的体积、重量,分别计算移植瘤的生长抑制率,公式如下:体积抑制率(IRV,%)=[1-V1(cm3)/V2(cm3)]×100%,质量抑制率(IRW,%)=[1-W1(cm3)/W2(cm3)]×100%,其中,V1为观察组移植瘤的平均体积,V2为空载组移植瘤的平均体积,W1为观察组移植瘤的平均质量,W2为空载组移植瘤的平均质量。
(4)real-time PCR检测hMLH1 mRNA、hMSH2 mRNA的表达:将5组裸鼠移植瘤组织用液氮研磨匀浆,严格遵循RNA快速提取试剂盒的操作步骤提取总RNA。用反转录PCR试剂盒进行反转录获得模板cDNA;将其中2 μl的cDNA严格按照PCR扩增试剂盒的步骤进行扩增。hMLH1扩增引物:上游引物:5’-CAGAGGAAGATGGTCCCAAAG-3’;下游引物:5’-GGCTAGTCGAAGAATGAAGATAGG-3’。hMSH2扩增引物:上游引物:5’-TCATCACTGTCTGCGGTAATC-3’;下游引物:5’-GGTATCTTCAACAGAACCCTGAA-3’。β-actin引物:上游引物:5’-CACCCCAGCCATGTACGTTG-3’;下游引物:5’-GTCACCGGAGTCCATCACGA-3’,β-actin作内参。通过每个反应管内的荧光信号到达设定的阈值时所经历的循环数(Ct值)计算各组hMLH1、hMSH2mRNA的相对含量,相对含量用2-△△Ct表示,公式如下:△△Ct=(实验组目的基因平均Ct值-实验组β-actin平均Ct值)-(空载组目的基因平均Ct值-空载组β-actin平均Ct值)。
(5)免疫组化检测hMLH1、hMSH2的表达:严格按照免疫组化试剂盒操作说明步骤进行染色,空白组用PBS缓冲液替代一抗。首先对组织切片行脱蜡复水处理,然后对内源性过氧化物酶淬灭后行抗原表位修复,再加入一抗与二抗后进行免疫反应,随后行化学染色,最后脱水封片进行结果观察。半定量分析操作如下:①根据上色细胞占总细胞的百分比计分,在载片里选择5个存在差异的视野,每个视野选用200个结肠癌细胞进行计算,阴性表达计0分,阳性表达细胞数≤30%计1分,31%~50%计2分,51%~80%计3分,>81%计4分;②根据癌细胞上色程度计分,棕褐色计3分,棕黄色计2分,浅黄色计1分,无上色计0分;③两者相乘的积为表达强度,结果≤3分计为阴性;≥4分计为阳性。将组内每只裸鼠转移瘤组织切片的hMLH1、hMHS2蛋白表达程度的总平均数作为蛋白表达指数进行组间比较。

结 果
1.各组裸鼠生长情况及移植瘤体积比较:实验期间无裸鼠死亡。随着时间推移裸鼠皮下均成瘤。空白组和空载组裸鼠体态逐渐消瘦,灵敏性降低,活动减少,而Survivin shRNA组和双基因组裸鼠无明显异常改变。同一时间APC组、Survivin shRNA组、双基因组的移植瘤体积明显小于空白组和空载组,且双基因组明显小于APC组和Survivin shRNA组(P<0.05);空载组和空白组比较差异无统计学意义(P>0.05)。见表1。
2.各组裸鼠移植瘤IRV及IRW比较:与空载组比较,APC 组、Survivin shRNA 组、双基因组裸鼠的移植瘤IRV及IRW明显增加,且双基因组较APC 组和Survivin shRNA组增加更明显(P<0.05);空载组和空白组比较差异无统计学意义(P>0.05)。见表2。
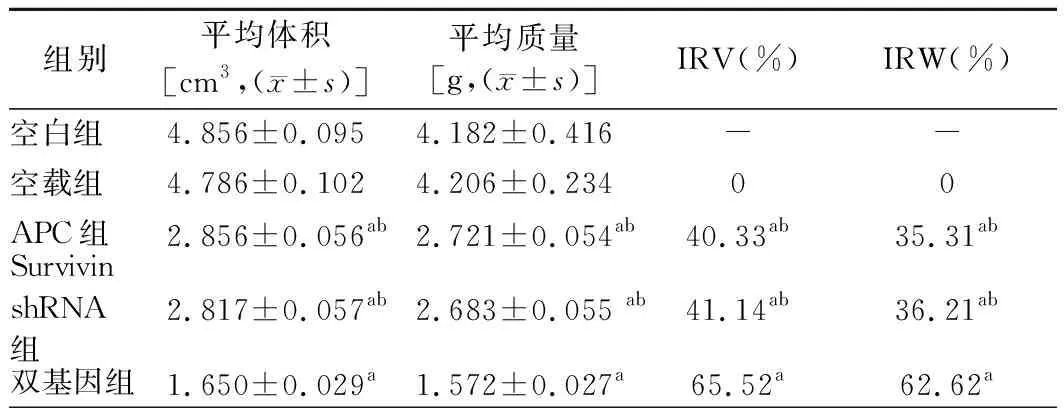
表2 各组裸鼠移植瘤IRV及IRW比较 (n=8)
3.各组裸鼠移植瘤组织中hMLH1 mRNA和hMSH2 mRNA表达水平比较:Survivin shRNA组、APC组、双基因组裸鼠移植瘤组织中hMLH1 mRNA和hMSH2 mRNA相对含量较空载组明显升高,且双基因组明显高于Survivin shRNA组和APC组(P<0.05);空载组与空白组hMLH1 mRNA和hMSH2 mRNA相对含量比较差异无统计学意义(P>0.05)。见表3。
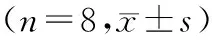
表3 各组裸鼠移植瘤组织中hMLH1 mRNA和hMSH2 mRNA表达水平比较
4.各组裸鼠移植瘤组织中hMLH1和hMSH2蛋白表达情况:hMLH1和hMSH2蛋白均多位于移植瘤组织细胞核内,空白组和空载组表现为少量的淡黄色或黄色颗粒,双基因组中棕黄色或棕褐色颗粒相对多,Survivin shRNA组染色程度介于两者之间,见图1、2。与空白组和空载组比较,APC组、Survivin shRNA组及双基因组的hMLH1和hMSH2蛋白表达明显增多,且双基因组hMLH1和hMSH2蛋白含量明显高于APC组和Survivin shRNA组(P<0.05);空白组和空载组hMLH1和hMSH2蛋白含量比较差异无统计学意义(P>0.05)。见表4。
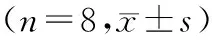
表4 各组裸鼠移植瘤组织中hMLH1和hMSH2蛋白表达水平比较
讨 论
DNA MMR是一种可以辨别和修复DNA复制和重组过程中可能出现的核苷酸错误及修复某些形式DNA损伤的系统[5]。MMR功能异常不仅导致细胞异常增殖,且还会导致分化过程中细胞器的异常改变,尤其是影响正常细胞的结构和功能。因此,MMR基因突变和功能异常会导致DNA复制精确率降低,发生复制错误和微卫星不稳定(MSI)。MSI是由于MMR基因功能异常改变或丧失,无法纠正在遗传复制过程中由于DNA“链滑”或在有丝/减数分裂期染色体的不对称交换造成的复制错误,导致广泛存在于生物基因组中的微卫星重复序列长度易发生变化,产生遗传不稳定性[6]。MMR过程中必须参与的基因是hMLH1、 hMSH2,具有十分重要的作用,hMLH1、 hMSH2蛋白表达降低和功能缺失可引起基因组MSI,MSI使全部基因组稳定性降低、自身突变细胞增多,导致复制错误不断积累,使原本有序的细胞生长与凋亡发生紊乱,从而失去对异常增殖细胞的抑制作用,促进肿瘤发生。有研究显示,雌激素通过上调结肠细胞内源性错配修复基因的表达水平,增强结肠细胞DNA错配修复的能力,进一步防止DNA复制错误积累放大[7]。
MMR系统最早发现于原核生物中[8],随后在真核生物和人类细胞中也发现了与MMR密切相关的同源基因。MMR的可能发生机制如下:hMSH2与hMSh6形成异源二聚体hMutSα,hMSH2与hMSH3结合形成异源二聚体hMutSβ,两个异源二聚体均可识别新合成的DNA核苷酸链上的碱基错配,并与错配位点结合。hMLH1与hPMS1结合形成hMutLα异源二聚体,与hMutSα或hMutSβ结合形成一种暂时的复合物,从而启动错配修复,并与错配修复有关的酶相互配合,切除错误碱基的DNA链,合成正确的DNA链,完成DNA MMR。越来越多研究发现,在食管、胃、结肠、膀胱、宫颈、乳腺等恶性肿瘤中可见hMLH1、hMSH2基因低表达,推测hMLH1与hMSH2基因可能参与了肿瘤的发生发展[9-10]。有文献表明,MMR作用最敏感的组织是结肠上皮,其次是子宫内膜、胃黏膜、肾、卵巢和小肠,MMR的丧失促进了结肠上皮细胞的异常增殖[11]。hMLH1蛋白和hMSH2蛋白生成的复合体可以有效并特异性与DNA链上一个错配基因结合,在DNA修补中起重要作用。hMLH1能够纠正错误搭配的核苷酸,维持基因的稳定性,被誉为“DNA损伤的传感器”,hMSH2是最早发现也是研究MMR基因时关注的热点之一,是MMR系统中的“管家基因”,具有识别错配的功能。
APC是一个多功能蛋白,其突变会导致细胞核中的β-catenin不能降解,进一步激活下游Survivin的表达[12]。Survivin是凋亡抑制家族中最小的一个因子,也是肿瘤发展的核心因子,其在健康生物体的不同组织中均未见表达,但在几乎所有类型的恶性肿瘤(包括膀胱、乳腺、胃、食道、肝脏、子宫、卵巢和血液恶性肿瘤等)中明显高表达。因此,Survivin是一种众所周知的抗癌干预靶点,一些Survivin抑制剂和与Survivin相关的分子治疗正在趋向成熟。
有研究表明,在肺癌和直肠癌中hMLH1与Survivin基因表达存在显著负相关[13]。国外研究证明,hMLH1可以直接与c-myc结合,c-myc可以受Survivin的调控[14-15],可能是hMLH1与Survivin相关的直接证据。以上研究与本实验结论一致。本实验结果显示,单基因组(Survivin shRNA与APC)及双基因组中hMLH1和hMSH2蛋白及mRNA表达量均升高,且双基因组中hMLH1、hMSH2蛋白及mRNA增加更明显。双基因组移植瘤的IRV及IRW也较单基因组明显增高,进一步表明双基因组通过上调hMLH1、hMSH2表达对裸鼠移植瘤的生长起抑制作用,并且与单基因组相比,其对移植瘤的抑制效果更为明显。
综上所述,Survivin shRNA-APC双基因共表达稳转株可以在核酸和蛋白水平通过沉默Survivin的表达来上调对HT-29结肠癌细胞中hMLH1、 hMSH2表达, hMLH1和hMSH2表达可以使错误的DNA链被降解和修复,合成正确的DNA链,可能通过提高结肠细胞DNA MMR的能力,从而防止DNA复制错误积累放大,进一步抑制肿瘤生长,这为Survivin shRNA-APC双基因抑制结肠癌的治疗提供了新思路,hMLH1、hMSH2有望成为临床治疗的新靶点,但其具体作用机制尚不明确,需要进一步探索。本研究仍存在一定的局限性,如实验方法较单一,可以继续监测MSI,未来还可用基因族谱等方法和技术去探究 Survivin shRNA-APC双基因下游的相关靶点和具体发生机制。

