血清肿瘤标志物检测在评估NSCLC化疗疗效中的应用价值
张华梁 杨芝萍
[摘要] 目的 探討血清肿瘤标志物检测在评估非小细胞肺癌(Non-small cell lung cancer,NSCLC)化疗疗效时的应用价值。 方法 选择2019年1~11月在我院呼吸科收治的晚期非小细胞肺癌患者30例作为研究对象,设为观察组,所有患者均经过组织病理学检查确诊,且患者均行化疗治疗,对于鳞癌患者给予吉西他滨联合顺铂(Gemcitabine/cisplatin,GP)化疗方案,对于非鳞癌患者给予培美曲塞联合卡铂(Pemetrexed/Carboplatin,PC)方案化疗,疗程完毕后从完全缓解(Complete response,CR)、部分缓解(Complete response,PR)、疾病进展(Progressive disease,PD)、疾病稳定(Stable disease,SD)评估患者近期疗效。选择该时间段体检人群30例设为对照组。检测两组血清同源蛋白2(Anterior gradient 2,AGR2)、可溶性白细胞介素-2受体(Soluble interleukin-2 receptor,SIL-2R)水平、胸苷腺酶1(Thymidine kinase 1,TK1)水平、癌胚抗原(Carcinoembryonic antigen,CEA)、糖类抗原19-9(Glucoprotein antigen 199,CA19-9)及血清癌抗原125(Glucoprotein antigen 125,CA125)水平;并分析血清肿瘤标志物与患者预后的相关性。 结果 观察组患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均高于对照组(P<0.05);观察组患者均顺利完成疗程内化疗,化疗后患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于化疗前(P<0.05);观察组患者不同疗效下CR+PR率为43.33%,PD+SD率为56.56%。观察组CR+PR患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于PD+SD患者(P<0.05);晚期非小细胞肺癌患者化疗预后与AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平呈负相关(P<0.05)。 结论 检测晚期非小细胞肺癌患者血清肿瘤标志物对患者的疗效和预后有一定的预测意义。
[关键词] 晚期非小细胞肺癌;血清肿瘤标志物;化学治疗;预后评估
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-9701(2020)25-0025-04
The application value of serum tumor marker detection in evaluating the efficacy of NSCLC chemotherapy
ZHANG Hualiang1 YANG Zhiping2
1.Department of Respiratory Medicine, Jiaxing First Hospital in Zhejiang Province, Jiaxing 314000, China; 2.Department of Oncology, Jiaxing First Hospital in Zhejiang Province, Jiaxing 314000, China
[Abstract] Objective To explore the application value of serum tumor marker detection in evaluating the efficacy of non-small cell lung cancer(NSCLC) chemotherapy. Methods Thirty patients with advanced non-small cell lung cancer admitted to the Department of Respiratory Medicine of our hospital from January to November 2019 were selected as the observation group. All patients were diagnosed by histopathological examination and all patients received chemotherapy treatment. Patients with squamous cell carcinoma were given Gemcitabine/Cisplatin(GP) chemotherapy, and patients with non-squamous cell carcinoma were given Pemetrexed/Carboplatin(PC) chemotherapy. The short-term efficacy of patients was assessed in terms of complete response(CR), partial response(PR), progressive disease(PD), stable disease(SD) after the course of treatment. Thirty patients with physical examination at this time period were selected as the control group. Serum homologous protein 2(anterior gradient 2,AGR2),soluble interleukin-2 receptor(SIL-2R) levels, and thymidine kinase 1(TK1), Carcinoembryonic antigen(CEA), Glucoprotein antigen 199(CA19-9) and Glucoprotein antigen 125(CA125) levels between the two groups were detected. The correlation of serum tumor markers and patient prognosis was analyzed. Results The levels of AGR2, SIL-2R, TK1, CEA, CA19-9 and CA125 in the observation group were higher than those in the control group(P<0.05). The patients in the observation group all successfully completed the intra-therapy chemotherapy. The levels of AGR2, SIL-2R, TK1, CEA, CA19-9 and CA125 in the patients after chemotherapy were lower than those before chemotherapy(P<0.05). The CR+PR rate of the observation group was 43.33% and the PD+SD rate was 56.56%. The levels of AGR2, SIL-2R, TK1, CEA, CA19-9, and CA125 in CR+PR patients of the observation group were lower than those in PD+SD patients(P<0.05). The prognosis of chemotherapy was negatively correlated with AGR2, SIL-2R TK1,CEA, CA19-9 and CA125 levels in patients with advanced non-small cell lung cancer(P<0.05). Conclusion The detection of serum tumor markers in patients with advanced non-small cell lung cancer has a certain predictive significance for the efficacy and prognosis of patients.
[Key words] Advanced non-small cell lung cancer; Serum tumor markers; Chemotherapy; Prognosis assessment
肺癌是临床上常见的恶性肿瘤,具有发病率高、死亡率高等特点[1]。Ye等[2]研究表明:近50年肺癌在诸多国家发生率呈上升趋势,且男性居所有恶性肿瘤首位,女性居第二位。肺癌发病机制复杂,普遍认为与吸烟、职业和环境接触、遗传因素、电离辐射及既往肺部慢性感染等有关,且多数患者确诊时已经丧失手术治疗机会[3]。化疗是晚期非小细胞肺癌患者中常用的方法,化疗方案包括PC、GP等,均能提高患者生存质量[4]。但是全身静脉化疗具有较强的副作用,再加上治疗过程中缺乏有效的评估、预测指标,导致患者耐受性较差。肿瘤标志物是恶性肿瘤细胞增殖、生长过程中释放出的物质,能反映肿瘤的发生、发展,加强晚期非小细胞肺癌患者血清肿瘤标志物能了解患者疾病严重程度[5-6]。研究表明[7-8]:将血清肿瘤标志物用于晚期非小细胞肺癌患者化疗中能评估患者预后,指导临床治疗,但是该方案尚需验证。因此,本研究以2019年1~11月收治的晚期非小细胞肺癌患者30例及同期入院健康体检者30例作为研究对象,探讨晚期非小细胞肺癌患者化疗前后血清肿瘤标志物的改变及临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选择2019年1~11月收治的晚期非小细胞肺癌患者30例作为研究对象,设为观察组,男19例,女11例,年龄39~78岁,平均(56.89±6.78)岁;KPS评分61~88分,平均(73.34±3.51)分;TNM分期:Ⅲ期17例,Ⅳ期13例;病理类型:鳞癌10例,腺癌8例,大细胞癌5例,未分化癌7例。选择该时间段体检人群30例设为对照组,男15例,女15例,年龄35~81岁,平均(53.11±10.59)岁。两组的性别、年龄等一般临床资料比较,差异无统计学意义(P>0.05)。
1.2 纳入及排除标准[9]
观察组纳入标准:①符合《中国常见肿瘤诊治规范》中非小细胞肺癌临床诊断标准;②患者能耐受化学治疗;③未合并其他如糖尿病、高血压、免疫系统疾病、慢性阻塞性肺疾病、哮喘等慢性病患者。排除标准:①合并精神异常或化疗过程中伴有严重毒副反应需要终止治疗者;②病情持续恶化,预计生存期<3个月者;③合并其他部位恶性肿瘤。对照组均为同时段在我院进行健康体检者。本研究通过医院医学伦理委员会审查,所有入组患者均签署知情同意书,获得知情同意。
1.3 方法
化疗前完善相关检查,确定患者肿瘤分型,鳞癌患者给予GP化疗方案:第1、8天取吉西他滨(哈尔滨誉衡药业股份有限公司,国药准字H20040958)1250 mg/m2,静滴;第1天静滴顺铂[费森尤斯卡比(武汉)医药有限公司,国药准字H20044945]75 mg/m2,每21天为1个化疗周期;对于非鳞癌患者给予PC方案化疗。第1天静滴培美曲塞(山西振东泰盛制药有限公司,国药准字H20080249)500 g/m2,静滴;第1天静滴顺铂75 mg/m2,每21天为1个化疗周期(共化疗3个周期)[10]。
1.4 观察指标
1.4.1 疗效标准 参考美国RECIST1.1腫瘤客观疗效评价标准[11]:①所有目标病灶消失,任何病理性淋巴结(无论是否为目标病灶)的短轴值必须<10 mm判定为CR;②以临界半径的总和为参照,所有目标病灶半径的总和至少减小30%判定为PR;③以目标病灶半径的总和最小值为参照(包括最小值等于临界值的情况),所有目标病灶半径的总和至少增加20%判定为PD;④以目标病灶半径的总和最小值为参照,既达不到缓减标准、也达不到恶化标准者判定为SD。
1.4.2 肿瘤标志物 观察组化疗前、化疗后取空腹静脉血5 mL,对照组到医院体检当天取空腹静脉血5 mL,25 min离心,速度5500 rpm,离心半径60 cm,血清分离完毕后放置在-30℃冰箱中备用。采用酶联免疫吸附试验测定两组梯度同源蛋白2(AGR2)、可溶性白细胞介素-2受体(SIL-2R)水平;采用免疫印迹增强化学发光法测定两组血清胸苷腺酶1(TK1)水平;采用免疫发光法完成癌胚抗原(CEA,参考值0~10 μg/L)、糖类抗原19-9(CA19-9,参考值0~40 KU/L)及血清癌抗原125(CA125,参考值<35 U/mL)水平[12-13]。
1.5 统计学方法
采用SPSS18.0软件处理,计数资料采用[n(%)]表示,行χ2检验,计量资料采用(x±s)表示,行t检验,相关性检验采用Pearson相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组血清肿瘤标志物水平比较
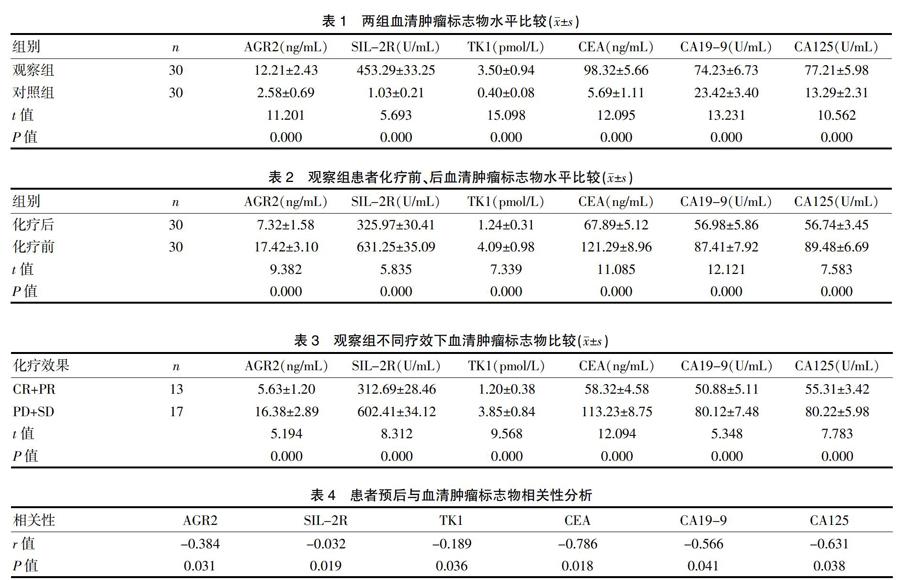
观察组晚期非小细胞肺癌患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均高于对照组(P<0.05)。见表1。
2.2 观察组患者化疗前、后血清肿瘤标志物水平比较
观察组患者均顺利完成疗程内化疗,化疗后患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于化疗前(P<0.05)。见表2。
2.3 观察组不同疗效下血清肿瘤标志物比较
观察组患者不同疗效下CR+PR率为43.33%,PD+SD率为56.56%。观察组CR+PR患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于PD+SD患者(P<0.05)。见表3。
2.4 患者预后与血清肿瘤标志物相关性分析
SPSS Pearson相关性分析结果表明,晚期非小细胞肺癌患者化疗预后与AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平呈负相关(P<0.05)。见表4。
3 讨论
肺癌是严重威胁人类健康的恶性肿瘤,且随着人们居住环境的恶化及人口老龄化的加剧,导致晚期肺癌发生率呈上升趋势[14]。手术是非小细胞肺癌患者的首选治疗方案,通过手术切除病灶组织,能延长患者寿命,延缓病情持续发展。但是,由于肺癌发病早期临床症状缺乏典型性,多数患者确诊时已经是晚期,导致患者丧失手术治疗时机。近年来,化疗在晚期非小细胞肺癌患者中得到应用,且效果理想[15]。化疗是晚期非小细胞肺癌患者中常用的治疗方法,且根据肺癌类型多以GP和PC化疗方案为主,能延长患者寿命,提高患者生存质量。但是,化疗属于是一种全身治疗方法,在杀死肿瘤细胞的同时会存在严重的毒副反应,再加上临床缺乏有效的预测、评估方法,导致患者治疗预后较差[16]。
肿瘤标志物是由肿瘤细胞产生或在肿瘤刺激下机体分泌的能在肿瘤组织、血液或排泄物中检出的物质[17]。Lerner等[18]研究表明,肿瘤标志物能反映肿瘤的进展状态,有助于评估患者预后,指导临床治疗。本研究中,观察组晚期非小细胞肺癌患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均高于对照组(P<0.05)。由此可见,晚期非小细胞肺癌患者常伴有血清肿瘤标志物的升高,参与疾病的发生、发展。AGR2属于一种分泌型蛋白,该蛋白在正常人体中表达水平相对较低,但是在肺癌组织中常呈高表达。国内学者研究表明,AGR2在晚期非小细胞肺癌患者中呈高表达,能参与肿瘤的发生、发展。SIL-2R是机体淋巴细胞的活化标志物,在肿瘤的发生、发展中均呈高表达,并且在恶性肿瘤中由于细胞无限增殖,是最为重要的细胞行为;TK1也是晚期肺癌患者中常用的肿瘤标志物,其表达水平能反映肿瘤的增殖程度。国内学者研究表明[19],由于晚期非小细胞肺癌患者细胞增殖过程相对活跃,能在外周血中检测出TK1呈高表达。本研究中,观察组患者均顺利完成疗程内化疗,化疗后患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于化疗前(P<0.05)。由此可见,晚期非小细胞肺癌患者化疗前、后血清肿瘤标志物呈低表达,能抑制病情的发展,利于患者恢复。
CEA是一种糖蛋白,多表达于结肠癌、胚胎结肠黏膜上,该糖蛋白在正常人体中表达水平较低,但是肺癌患者由于其极性消失,CEA反流进入淋巴或血压中,导致血清CEA水平升高,且当CEA水平超过20 μg时提示可能具有恶性肿瘤。研究表明,晚期非小细胞肺癌患者中CEA水平呈高表达。CA125属于一种糖蛋白抗原,能识别单克隆抗体,是上皮性卵巢癌、子宫内膜癌患者中重要的标志物,多用于卵巢癌的诊疗中。Wang等[20]研究表明,CA125表达水平还与肿瘤的复发有关,用于肺癌患者中能评估其预后,指导临床治疗;CA19-9是一种与消化系统肿瘤有关的抗原,正常人群中CA19-9表达水平较低,但是在晚期非小细胞肺癌患者中呈高表达。本研究中,观察组患者不同疗效下CR+PR率为43.33%,PD+SD率为56.56%。观察组CR+PR患者AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平均低于PD+SD患者(P<0.05)。说明晚期非小细胞肺癌患者中血清肿瘤标志物呈低表达,加强不同血清肿瘤标志物测定能评估患者预后,指导临床治疗。研究表明,将AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平測定用于晚期非小细胞肺癌患者有助于提高肺癌的诊断敏感性,且用于晚期非小细胞肺癌化疗治疗中能了解患者预后。本研究中,SPSS Pearson相关性分析结果显示,晚期非小细胞肺癌患者化疗预后与AGR2、SIL-2R、TK1、CEA、CA19-9及CA125水平呈负相关(P<0.05)。
综上所述,加强晚期非小细胞肺癌患者血清肿瘤标志物能了解患者恢复情况,且与患者预后具有一定的相关性,监测其血清肿瘤标志物水平变化有助于评估患者预后,及时调整临床治疗方案。
[参考文献]
[1] 孙银萍,王福立.级联激活的免疫细胞联合化疗治疗晚期非小细胞肺癌效果观察[J].山东医药,2017,57(6):48-50.
[2] Ye Q,Lin J,Feng J. The effects of carboplatin and etoposide on advanced small cell lung cancer and serum tumor markers in correlation with long-term survival rate[J].Pakistan Journal of Pharmaceutical Sciences,2018,31(6):2779-2782.
[3] 陈文武,毛良平,牟方红,等.克唑替尼靶向治疗的非小细胞肺癌患者血清肿瘤标志物水平变化及意义[J].山东医药,2017,57(29):62-64.
[4] Duan J,Yang Z,Liu D,et al. Clinical efficacy of bevacizumab combined with gemcitabine and cisplatin combination chemotherapy in the treatment of advanced non-small cell lung cancer[J].J BUON,2018,23(5):1402-1406.
[5] Tomita M,Ayabe T,Maeda R,et al. Serum carcinoembryonic antigen Level predicts cancer-specific outcomes of resected non-small cell lung cancer with interstitial pneumonia[J].World Journal of Oncology,2018,9(6):136-140.
[6] 张楠,李铁军,李鲲鹏,等.血清肿瘤标志物谱及趋化因子蛋白在肺癌中的表达及预测价值研究[J].重庆医学,2017,46(25):3484-3485.
[7] Feng LX,Wang J,Yu Z,et al. Clinical significance of serum EGFR gene mutation and serum tumor markers in predicting tyrosine kinase inhibitor efficacy in lung adenocarcinoma[J]. Clinical and Translational Oncology,2019, 21(8):1005-1013.
[8] Bai Y,Shen W,Zhu M,et al. Combined detection of estrogen and tumor markers is an important reference factor in the diagnosis and prognosis of lung cancer[J]. Journal of Cellular Biochemistry,2019,120(1):105-114.
[9] Zhang Z,Zhou S.Serum EGFR gene mutation status via second-generation sequencing and clinical features of patients with advanced lung cancer[J]. International Journal of Clinical and Experimental Pathology,2018,11(7):3551-3555.
[10] Abtahi S,Malekzadeh M,Nikravan G,et al. Comments on the measurement of lung cancer tumor markers in workers of a glass wool company[J]. The International Journal of Occupational and Environmental Medicine,2018,9(3):158-165.
[11] 陈艳,向敏,王熙才,等.非小细胞肺癌患者外周血有核细胞miR-205-5p水平及其临床意义[J].中国肿瘤生物治疗杂志,2017,24(12):1414-1418.
[12] 郭晓斌,李晓,冯可青.老年早期非小细胞肺癌患者外周血中鳞状细胞癌相关抗原、癌胚抗原及细胞角蛋白19血清片段21-1水平的变化[J].中国老年学杂志,2017, 37(4):920-921.
[13] Lu CY,Loomer S,Ceccarelli R,et al. Insurance coverage policies for pharmacogenomic and multi-gene testing for cancer[J].Journal of Personalized Medicine,2018,8(2):19-24.
[14] Abtahi S,Malekzadeh M,Nikravan G,et al. Measurement of lung cancer tumor markers in a glass wool company workers exposed to respirable synthetic vitreous fiber and dust[J].The International Journal of Occupational and Environmental Medicine,2018,9(1):23-30.
[15] Liu J,Zhang W,Gu M,et al. Serum SP70 is a sensitive predictor of chemotherapy response in patients with advanced nonsmall cell lung cancer[J]. Cancer Medicine,2018, 7(7):2925-2933.
[16] 龚正,龚萍,金柱,等.艾愈胶囊或复方斑蝥胶囊联合盐酸埃克替尼治疗晚期NSCLC[J].中成药,2017,39(11):2263-2269.
[17] Zhuo M,Chen H,Zhang T,et al. The potential predictive value of circulating immune cell ratio and tumor marker in atezolizumab treated advanced non-small cell lung cancer patients[J].Cancer Biomarkers,2018,22(3):467-476.
[18] Lerner L,Winn R,Hulbert A. Lung cancer early detection and health disparities:The intersection of epigenetics and ethnicity[J]. Journal of Thoracic Disease,2018,10(4):2498-2503.
[19] 吴伟东,丁锋,易永盛,等.非小细胞肺癌患者血浆miRNA-506水平变化及其意义[J].山东医药,2017,57(23):55-57.
[20] Wang J,Jiang W,Zhang T,et al. Increased CYFRA 21-1,CEA and NSE are prognostic of poor outcome for locally advanced squamous cell carcinoma in lung:A nomogram and recursive partitioning risk stratification analysis[J]. Translational Oncology,2018,11(4):999-1006.
(收稿日期:2020-04-20)
[基金項目] 国家自然科学基金项目(81650012)

