黄花菜染色体制片及荧光原位杂交技术体系的建立
武江,李森,李子瑜,武丹阳
(山西农业大学 园艺学院,山西 太谷030801)
黄花菜(Hemerocallis citrinaBarni)又名金针菜、忘忧草,属药食同源的观赏植物[1]。黄花菜在我国栽培历史悠久,广泛分布于湖南、甘肃、山西和陕西等地[2],由于其经济价值可观,现成为多地区农民增收和调整种植结构的优选栽培作物[3]。但是,由于黄花菜为多年生草本植物,杂交育种周期长,且生产中大多采用分株等无性繁殖方式,育种进展缓慢,急需通过分子育种的手段加速育种进程,培育新优高产品种。细胞学图谱、遗传连锁图谱、物理图谱及全基因组序列等遗传学研究平台的建立可促进黄花菜功能基因和分子遗传育种方面的研究。
荧光原位杂交(FISH)技术主要用于解答染色体和基因组水平的结构变化、变异以及进化问题[4]。该技术将目的基因片段定位于动植物细胞的中期和减数分裂粗线期染色体上,是细胞遗传学和基因组学研究的重要手段之一。将FISH应用于构建物种的染色体细胞遗传图谱,对提升基因组组装质量起着重要的辅助作用[5]。目前在许多作物中基于高分辨率FISH构建的物理图谱已有报道,如玉米[6]、白菜[7]、黄瓜[8]、番茄[9]、棉花[10]、土豆[11]、木瓜[12]等,为确定分子标记在染色体上的物理位置、基因组测序与组装提供了准确信息。
由于园艺植物进化和驯化历史悠久,通常具有较高的杂合率和倍性[14]。前期研究工作发现,黄花菜同样具有大染色体、大基因组[15]且遗传背景复杂等生物学特性。目前,课题组已构建黄花菜的种内和种间2张细胞遗传图谱,通过展现遗传标记在染色体上的实际距离,可为基因组测序及序列装配提供重要基础资源。如何实现黄花菜的遗传图谱与物理图谱的整合,成为一个亟待解决的技术难题。要攻破这一难题,首先要解决黄花菜荧光原位杂交体系的构建,本研究将为黄花菜细胞遗传学研究和基因组研究的深入开展提供技术基础。
1 材料与方法
1.1 试验材料
大同黄花菜(H.cv.‘DatongHuanghua’)栽培于山西农业大学园艺站。选择天气晴朗、阳光充足的情况,于上午8:00-10:00进行取样。
1.2 试验方法
1.2.1 根尖细胞中期染色体切片制备
将整株植物挖出栽种于温室沙床上促进其侧根生长,夏季时约7 d之后,其它季节约14 d之后,可获得幼嫩且健壮的根尖。将根尖剪下装入预冷蒸馏水的玻璃瓶中,置于冰盒内带回实验室。
(1)预处理
将材料浸泡于浓度为2.9μg·mL-1八羟基喹啉溶液中,于4℃黑暗条件下分别处理2 h、3 h、4 h和5 h。
(2)固定与保存
将材料移入新鲜配置的卡诺氏固定液中,4℃条件下固定24 h以上。若长期保存则转入−20℃温度下70%酒精溶液中。
(3)酶解
经过固定处理的材料放入4%纤维素酶和2%果胶酶混合液中37℃条件下酶解。果胶酶购自Japan Yakult公司(日本,京都),纤维素酶购自Sigma公司(美国,圣克拉拉)。设置酶解时间梯度为140 min、150 min、160 min和170 min。
(4)制片
火焰干燥法参照高和琼等[16]报道的方法。将材料放于干净的载玻片中央,镊子敲至浆状,滴加卡诺固定液使材料分散。将载玻片置于酒精灯上迅速烘烤后,于空气中晾干待用。
(5)镜检拍照
使用相差显微镜Nikon BX41于20倍镜下检测和拍照,质量合格切片放入−20℃冰箱中用于待用。
1.2.2 花粉母细胞粗线期染色体切片制备
在现蕾期选取2~3 mm,4~5 mm,6~7 mm不同龄段的幼嫩花蕾为试验材料。
(1)固定与保存
将材料移入卡诺固定液于4℃条件下处理24 h。后将固定液换成70%乙醇,置于−20℃条件下长期保存备用,并定期更换70%乙醇。
(2)粗检
使用解剖针剥去花萼、花瓣,取3、4个花药置于载玻片,加一滴卡宝品红,用镊子压碎花药,加盖玻片后使用普通光学显微镜Olymbus CX33于20倍下进行镜检和拍照。
(3)酶解
将材料放入4%纤维素酶和2%果胶酶混合液中37℃条件下酶解180 min、200 min、220 min、240 min,酶解过程中每隔一段时间轻弹离心管,尽可能使花粉粒酶解均匀。
(4)制片
传统火焰干燥法:取多个花药于载玻片上,同根尖制片步骤获得制片。
改良火焰干燥法:花药敲碎去杂后向载玻片加1滴乙酸,放置于50℃摊片机上干燥,期间用镊子不停拨动。1~2 min后加2滴60%酒精,酒精灯火焰干燥制片。
(5)镜检拍照及储存方法如根尖制片中步骤。
1.2.3 荧光原位杂交体系的建立
拟南芥45S rDNA和5S rDNA探针序列由江苏师范大学韩永华教授惠赠。使用直接标记法由生工生物工程有限公司合成探针。
荧光原位杂交技术参数的筛选:
(1)载玻片的处理
使用2种载玻片进行对比:将载玻片浸泡于铬酸洗液(5%重铬酸钾浓硫酸溶液)中24 h以上,取出清洗后置于无水乙醇中浸泡4 h,晾干备用;使用新的载玻片直接用于染色体制片。
(2)烘片
本试验设计了50℃、60℃2个温度,烘片时间分别为0.5 h、1.0 h、1.5 h和2.0 h。
(3)染色体标本的变性温度和时间
设定60℃、70℃、80℃和90℃4个温度梯度,时间设定1、2、3和4 min 4个处理。
(4)杂交后洗脱强度的筛选
将杂交后的载玻片放入1×TNT(10 mmol·L-1Tris-HCl;150 mmol·L-1NaCl;0.5%Tween20;pH=7.8~8.2)中置于摇床上70 r·min-1洗脱3次,每次5 min,在第二步的洗脱过程中设置洗脱温度为:室温、37℃、42℃3个梯度。
荧光原位杂交及信号检测的方法参照HAN等人报道的方法[17],具体步骤如下:
(1)烘片
将玻片置于60℃烘箱中处理1.5 h。
(2)变性
玻片滴加100μL 70%FAD变性液,盖上盖玻片,80℃变性2 min。
(3)脱水
揭掉玻片,立即放入−20℃预冷的70%、95%、100%梯度酒精溶液中各脱水5 min。
(4)取出切片,室温下空气干燥。
(5)杂交
将20 mL杂交液滴加到玻片上,盖上盖玻片,放入杂交盒中37℃条件下过夜(杂交液体系:FAD10μL、20×SSC(3 mol·L-1NaCl;0.3 mol·L-1柠檬酸钠;pH=7.0)2μL、ssDNA 2μL、45S rDNA 1μL、5S rDNA 1μL、50%硫酸葡聚糖4μL)。
(6)洗脱
将杂交后的玻片放入1×TNT中置于摇床上70 r·min-1洗脱3次,每次5 min,其中二级洗脱在37℃条件下洗脱,其余在室温条件下洗脱。
(7)复染
切片在室温黑暗条件下晾干,每张切片加20 μL 2μg·mL-1的DAPI(含10%VectaShield)复染。
(8)信号检测和拍照
在荧光显微镜(LEICA DM6 B)下使用紫外、蓝光和绿光激发滤光块组合分别观察检测染色体上的红色和绿色探针杂交信号,使用冷式数位机(CCD)摄相头拍摄记录。
2 结果与分析
2.1 根尖中期细胞染色体制片结果
2.1.1 不同预处理条件筛选结果
预处理的目的在于阻断细胞分裂时纺锤体微管的形成,积累更多的中期分裂相,同时使染色体进一步凝缩,在后期易于得到良好制片。结果表明,八羟基喹啉溶液处理4 h时染色体形态清晰、凝缩程度适宜、利于染色体分散(图1B)。预处理时间低于4 h时,染色体较长,易缠绕,制片效果差(图1A);预处理时间5 h时,染色体凝缩过度,难以区分非同源染色体间的形态特征,同时也不利于探针与靶位点的结合(图1C)。
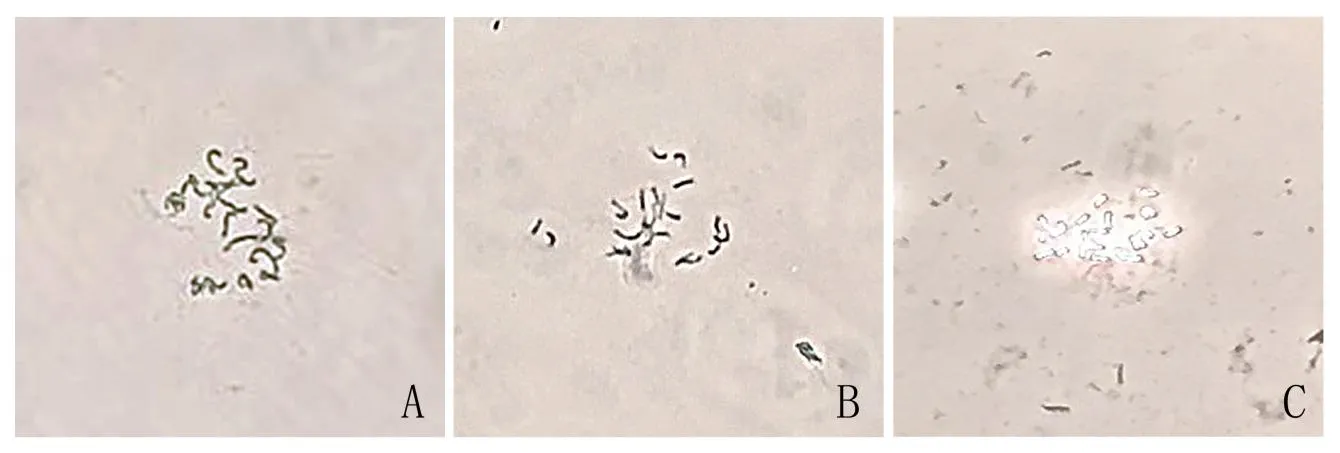
图1 不同预处理条件下染色体凝缩情况Fig.1 Chromosomes condensation at different preprocessing condition
2.1.2 不同酶解时间筛选结果
经过酶液处理,可以去除植物细胞壁对染色体的束缚,同时避免浓厚细胞质的影响,利于染色体分散。结果表明,酶解160 min时,染色体分散度好,背景清晰无干扰(图2C)。酶解低于160 min时,酶解不充分,有细胞壁和细胞质残留(图2A);酶解高于160 min时,染色体遭到不同程度的破坏,无法得到良好制片(图2B)。黄花菜根尖中期染色体制片筛选出的最佳体系为2.9μg·mL-1浓度的八羟基喹啉溶液处理4 h,混合酶液(纤维素酶∶果胶酶=2∶1)37℃酶解160 min。
2.2 花粉母细胞粗线期染色体制片结果
2.2.1 不同龄段花蕾筛选结果
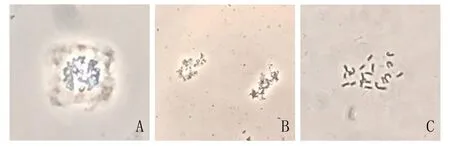
图2 不同酶解时间下染色体情况Fig.2 Chromosomes on different enzymolysis time
在花蕾发育早期,通过采集不同长度花蕾并观察花药内花粉母细胞的细胞学特征,以确定花粉母细胞集中在粗线期时对应的花蕾长度。由图3可以得出,花蕾处于2~3 mm龄段时,花药内花粉母细胞多处于分裂间期和减数分裂细线期(图3B)。花蕾处于4~5 mm龄段时,花粉母细胞多处于粗线期或粗线期之前(图3C),此时细胞内核仁明显,与细线期相比,由于同源染色体联会二价体开始收缩变粗并相互缠绕,适合作为花粉母细胞粗线期染色体制片材料。当花蕾生长至4~5 mm时,花粉母细胞大多已进入减数分裂Ⅰ中期和后期(图3D)。超过6 mm的花蕾,花粉母细胞已进入四分体时期甚至发育成花粉粒。

图3 花粉母细胞减数分裂不同时期细胞学特征Fig.3 Cytological characteristics of pollen mother cells at different stages of meiosis
2.2.2 不同酶解时间筛选结果
如图4所示,在酶解220 min左右时,染色体分散度良好,染色质浓度低且背景较为清晰,易于分辨染色体行为,酶解效果较好(图4A)。酶解小于220 min时,染色体分散程度低、细胞质浓度大,甚至细胞壁未被充分酶解,制片效果较差(图4B);酶解大于220 min时,出现了染色体变形、断裂甚至消失的情况,难以分辨染色体形态,酶解效果差(图4C)。
2.2.3 制片条件优化筛选
传统的火焰干燥法效果如图5A所示,视野中的细胞存在大片未被酶液消化的细胞壁和细胞质杂质,表明酶解或者处理不充分;改良后的制片效果如图5B所示,花粉母细胞细胞壁已消失,细胞质组分少,细胞分裂时期形态清晰可辨,背景干扰较小,属于合格制片。
综上结果,黄花菜花粉母细胞粗线期染色体制片筛选出的最佳体系为:采集4~5 mm龄段花蕾,卡诺固定液4℃固定24 h后,混合酶液(纤维素酶∶果胶酶=2∶1)37℃酶解220 min,使用改良火焰干燥法,可得理想制片。
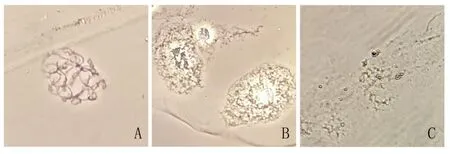
图4 不同酶解时间下染色体情况Fig.4 Chromosomes at different enzymolysis time
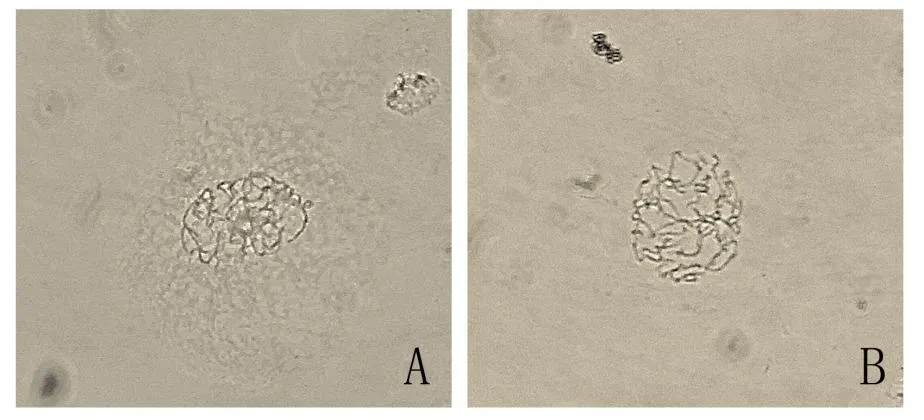
图5 使用不同方法获得的染色体制片Fig.5 Chromosome slides obtained by different methods
2.3 FISH体系的建立及杂交结果
2.3.1 染色体固定方法筛选的结果
结果表明,经过铬酸溶液处理过的载玻片,在50℃下烘片2 h,或在60℃下烘片1.5 h左右均可有效避免染色体在后续步骤中的脱落。其它条件下均容易导致切片上染色体的不完整。
2.3.2 染色体变性条件筛选的结果
结果表明,当切片染色体在70℃下变性3~4 min或者在80℃条件下变性2 min时,染色体均能够解链与探针杂交,且在显微镜下观察保持了较好的形态;在60℃条件下,探针变性不彻底,在后期杂交不上;而超过在90℃下切片上染色体形态表现为膨胀辨别不清。
2.3.3 杂交后洗脱强度的筛选结果
结果表明,以45S rDNA和5S rDNA序列做探针时,二级洗脱使用1×TNT在37℃条件下获得的原位杂交信号比较稳定,背景干扰很小,杂交信号清晰;洗脱温度太高或太低,均会造成非特异信号和背景信号。
3 结论与讨论
在植物FISH实验中应用最多的探针分子是重复DNA序列,其中最典型的是核糖体DNA(rDNA)[18]。由于其在基因组序列上的拷贝数多,在FISH中靶位点多,检出率较高,重复性好,因而常在 建 立 物 种FISH体系中使用[19~21]。本试验首次将拟南芥45S rDNA和5S rDNA序列定位于黄花菜中期和减数分裂粗线期染色体上,但由于信号位点有限,尚不能实现同时识别全套染色体。在今后研究工作中,需要进一步开发黄花菜全基因组范围的串联重复序列、单拷贝序列及oligo等多种类探针序列,充分发挥FISH技术在图谱整合和辅助基因组组装的优势,同时开展萱草属植物的FISH研究,通过探针序列在近缘物种间的分布特征揭示其进化关系。
为保证充足的根尖实验材料,本研究首次利用温室沙培的方法成功实现根尖周年取材,避免了一次性大量取材长时间保存而影响制片效果。同时,由于花期较为集中,花蕾材料容易受到季节的限制,本研究通过确定粗线期花粉母细胞对应的花蕾长度,大大提高了制片效率。这为进一步开展后续黄花菜的FISH研究提供了重要的技术前提。
在荧光原位杂交技术中,仅获得分散良好的中期和粗线期分裂相的染色体制片远远不能满足实验要求。黄花菜的细胞质浓厚,富含果胶、酚类等高分子次生代谢物质,制片过程中酶解的难度较大,杂质不易处理,将严重影响杂交过程中探针的渗透能力和杂交的信噪比。本研究采用改良的火焰干燥法进行制片,通过增加乙酸处理环节,有效降低了胞质粘度,促进细胞质清洁,摸索出一套适用于黄花菜FISH的制片技术,该技术体系适用于黄花菜后续的FISH技术研究工作。FISH技术在黄花菜上的成功运用,不仅弥补了传统核型分析中单纯依靠染色体形态进行分类的局限,更为黄花菜染色体研究、物理图谱研究及分子育种奠定了技术基础。
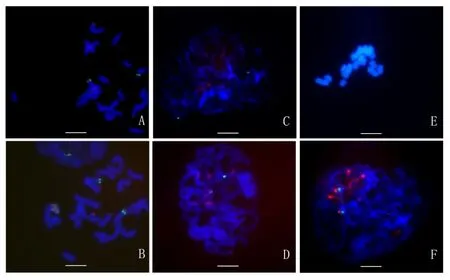
图6 黄花菜荧光原位杂交结果Fig.6 Fluorescence in situ hybridization results of H.citrina

