聚焦卷土重来的电池热
山东 孙 晶
仔细研读近几年各地高考试卷,近乎是“电”的世界,形态各异的新型原电池层出不穷。而2019年10月8号的诺贝尔化学奖公布以后,锂电池更成为了“风口浪尖上的明星物质”。获2019年诺贝尔化学奖的三位科学家在锂离子电池领域的开发,使得锂离子电池在全球范围内得到广泛运用,从根本上改变了人们的日常生活,由于锂离子电池中不含有重金属镉,与镍镉电池相比,大大减少了对环境的污染,他们更是为我们创造了一个绿色环保的世界,对人类可持续发展做出了杰出的贡献。那么预计在2020年的高考中,锂电池和其他种类的电池更是不可忽视的一个命题热点。
纵览近几年的原电池命题主要涉及其反应原理、电极判断、电极名称、电极反应和计算等多重知识点,且对于原电池的考查层层递进。笔者现对以下几个角度予以剖析,供大家参考领悟。
一、原电池、盐桥电池和有交换膜的电池
1.三池结构对比

(1)盐桥的作用:原电池装置由装置①到装置②的变化是由盐桥连接两个“半电池装置”,其中盐桥的作用有三种:①隔绝正、负极反应物,避免直接接触,导致电流不稳定;②通过离子的定向移动,构成闭合回路;③平衡电极区的电荷。
(2)离子交换膜的作用:由装置②到装置③的变化是“盐桥”变成“质子交换膜”。离子交换膜是一种选择性透过膜,允许相应离子通过,离子迁移方向遵循电池中离子迁移方向。
2.图解原电池的闭合回路形成原理

二、考查形式追踪解读
考查角度1.燃料电池

( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
D.放电时,电路中通过2 mol电子,消耗氧气22.4 L(标准状况)
【答案】C

【变式】某化学小组拟设计微生物燃料电池将污水中的乙二胺氧化成对环境友好的物质,工作原理如图1所示(a、b均为石墨电极)。下列分析正确的是
( )

图1

B.质子交换膜处H+由右向左移动
C.该电池在微生物作用下将化学能转化为电能
D.开始放电时b极附近pH不变
【答案】C

【方法技巧】燃料电池电极反应方程式的书写技巧
燃料电池是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。由于电池总反应式与燃料燃烧方程式相似而得名,由于条件不同,燃料并非真的燃烧。另外,燃料电池的考查重点是不同的电解质溶液,如酸性、碱性、中性、熔融碳酸盐、熔融氧化物等,其书写关键可以归结为一句话:“什么环境下用什么离子平衡电性。”如正极反应式书写:

考查角度2.典型二次电池

( )
A.图中e-及Li+移动方向说明该电池处于放电状态
B.该电池中a极不能接触水溶液
C.充电时a极连接外接电源的正极

【答案】C


( )

B.0.1 mol K2FeO4发生反应,转移电子数约为 1.806×1024
C.充电时K2FeO4发生氧化反应
【答案】D

【变式2】一种碳纳米管新型二次电池的装置如图3所示。下列说法中正确的是
( )

图3
A.离子交换膜选用阳离子交换膜(只允许阳离子通过)

C.导线中通过1 mol电子时,理论上负极区溶液质量增加1 g
D.充电时,碳电极与电源的正极相连
【答案】B

【方法技巧】突破二次电池的四个角度

考查角度3.电极可变的可逆电池

( )
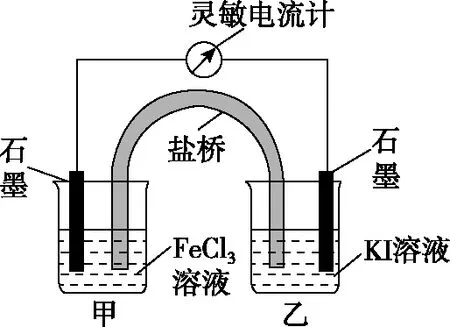
图4
A.反应开始时,乙中发生氧化反应
B.反应开始时,甲中Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
【答案】D
【解析】因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,故A正确;由总反应方程式知,Fe3+被还原成Fe2+,则发生还原反应,故B正确;当电流计读数为零时,说明没有电子发生转移,则反应达到平衡,故C正确;当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作负极,而乙中石墨作正极,故D错误。

下列说法不正确的是
( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【答案】D
【解析】甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以K+向FeCl3溶液迁移,A项正确;反应开始时,乙中I-失去电子,发生氧化反应,B项正确;当电流计读数为零时,说明没有电子发生转移,反应达到平衡,C项正确;当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,D项错误。

考查角度4.电化学学科交叉计算
【例4】(2015·全国卷Ⅱ·26节选)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。
(1)该电池的正极反应式为____________________,电池反应的离子方程式为____________________。
(2)维持电流强度为0.5 A,电池工作5分钟,理论上消耗锌________g。(已知F=96 500 C·mol-1)


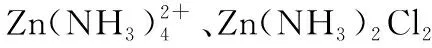
(2)0.05

【例5】(2013·新课标Ⅰ·28改编)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为____________________。



【变式】新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子(O2-)在其间通过。如图6所示,其中多孔电极不参与电极反应。

图6
(1)该电池的负极反应式为____________________。
(2)如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量表达式为________C。(1个电子的电量为1.6×10-19C)

(2)0.5 mol×6×1.6×10-19C·mol-1×6.02×1023或2.890×105

【方法技巧】学科交叉的计算主要公式
化学与物理结合的计算,主要涉及两个公式:①Q=It=n(e-)F,F计算时一般取值96 500 C/mol。②W=UIt。
——电表改装实验的深度思考

