由2019江苏卷19题的研究引发的思考
江苏 徐 军
在高考“化学工业流程题”中,常用(NH4)2CO3溶液或NH4HCO3溶液或NH4HCO3和NH3·H2O混合溶液作沉淀剂沉淀金属阳离子,三种沉淀剂沉淀的产物都是难溶的碳酸盐,使用不同沉淀剂的依据是什么,常常会使我们产生困惑,针对这一问题,结合今年江苏卷19题,本文作一深入探讨。
一、高考题的链接
【例1】(2019·江苏卷·19节选)实验室以工业废渣(主要含CaSO4·2H2O,还含少量SiO2、Al2O3、Fe2O3)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如下:
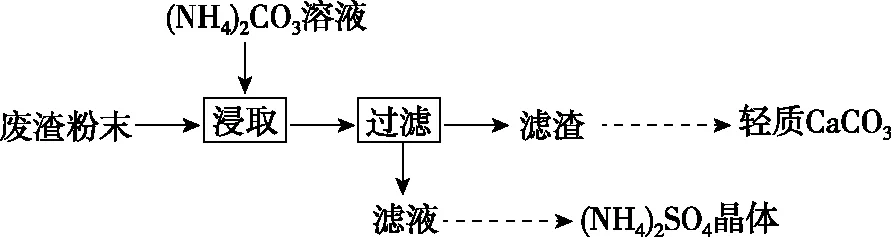
(2)将氨水和NH4HCO3溶液混合,可制得(NH4)2CO3溶液,其离子方程式为____________________;浸取废渣时,向(NH4)2CO3溶液中加入适量浓氨水的目的是____________________________。
(3)废渣浸取在如图所示的装置中进行。控制反应温度在60~70℃,搅拌,反应3小时。温度过高将会导致CaSO4的转化率下降,其原因是_________________
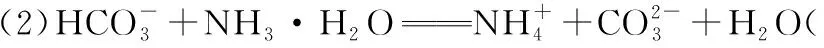
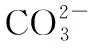
(3)温度过高,(NH4)2CO3分解
本题是以工业废渣为原料,实验室制取轻质CaCO3和(NH4)2SO4晶体为背景,设计实验流程图,所考查的问题是以真实工业生产情境为依据编制的。这类试题可以看成是以沉淀剂制备难溶碳酸盐,并同时得到副产品,属于常见的题型,在各地高考试题中都有体现。为了能深度理解命题者对这类试题的命意的依据,以2019江苏卷19题考查的工业生产情境的问题为依据,作深层次探讨,从而拓宽我们的视野。
二、问题的提出
1.对NH4HCO3溶液和NH3·H2O混合生成(NH4)2CO3做理论上的探讨:

氨水和NH4HCO3混合溶液中存在下列平衡:
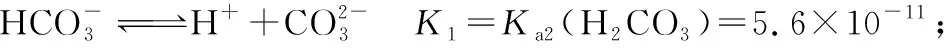
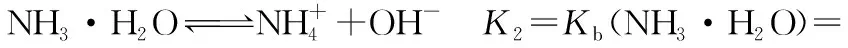

由①+②-③得④:
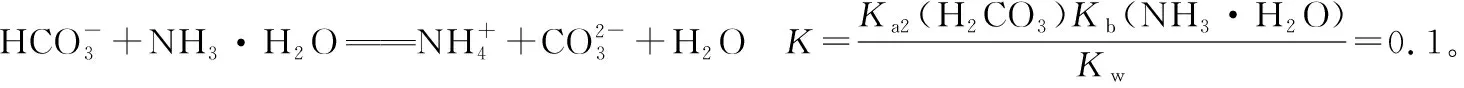
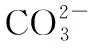
2.对(NH4)2CO3溶液中离子的存在做理论上的探讨:
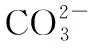
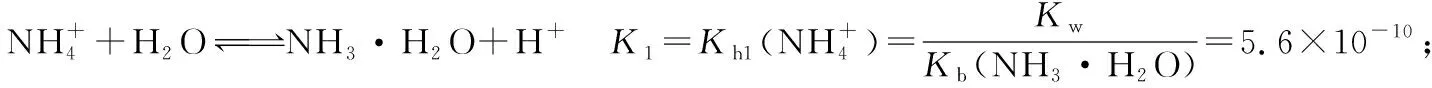
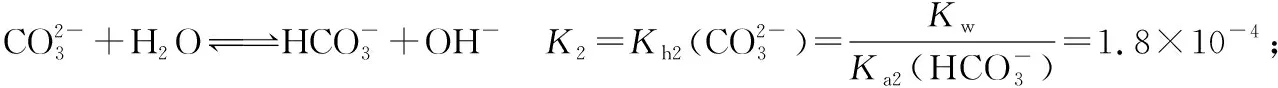

由①+②-③得:
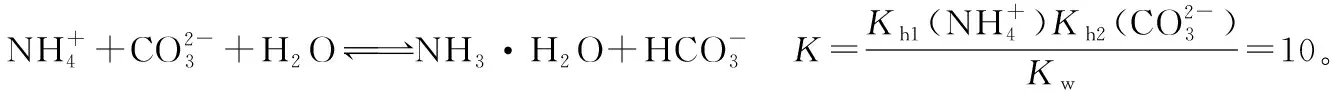


3.(NH4)2CO3固体存在吗?

【结论】不存在真正意义的(NH4)2CO3固体和溶液,用(NH4)2CO3溶液作沉淀剂只是命题者的臆想。
4.NH4HCO3作为沉淀剂原因的探讨:
为什么不用可溶的正盐溶液,如Na2CO3、Na3PO4作沉淀剂制备难溶正碳酸盐、正磷酸盐?因为用Na2CO3、Na2PO4作沉淀剂除生成碳酸盐等正盐外,还可形成碱式盐,一般认为,金属氢氧化物溶解度很小者,则形成正碳酸盐;若金属碳酸盐和氢氧化物溶解度相差有限,形成碱式碳酸盐[4]。
要探讨NH4HCO3作为沉淀剂的原理,以1.0 mol/L NH4HCO3溶液中离子浓度大小分析:
因为c(NH3·H2O)=c(H2CO3),所以
解得:c(H2CO3)=c(NH3·H2O)=3.465×10-2mol/L
再求溶液中c(H+)和c(OH-):
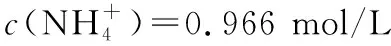
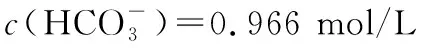
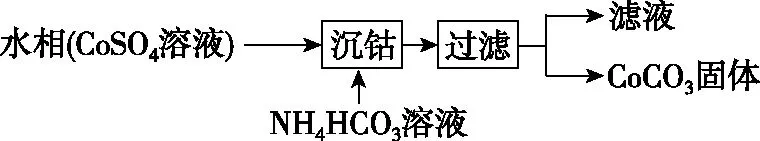
图1
5.废渣浸取控制反应温度在60~70℃的原因:
(1)NH4HCO3受热分解反应的机理[5]
目前,对于碳酸氢铵溶液的分解,会发生如下三个反应,分别为



为研究不同温度下的碳酸氢铵溶液的分解机理,取100 mL 1.11 mol/L的溶液,分别在60℃、70℃、80℃、90℃下进行分解实验,假设反应前后溶液的体积不发生变化,反应结束后溶液的组成如表1所示。
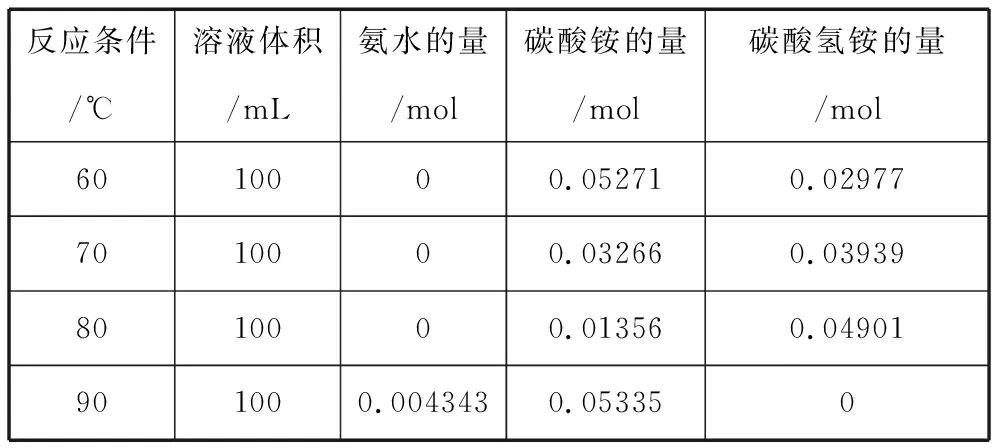
表1 不同温度下碳酸氢铵溶液分解后的溶液组成
由表可以看出,在60~80℃范围内,反应后溶液中没有氨水存在,所以在此温度范围内,碳酸氢铵溶液的分解主要是在碳酸氢铵和碳酸铵之间进行转化,也就是主要发生反应①。温度在90℃时,反应后溶液中存在较多的氨水,表明反应②、③所占的比重在加强。
(2)NH4HCO3受热分解反应受温度的影响[6]
CO2解析比率=

氨损耗比率=

为了研究温度对碳酸氢铵溶液热分解过程的影响,考察了四个温度(分别为60℃、70℃、80℃、90℃)对1.11 mol/L的碳酸氢铵溶液的CO2解析比、铵的损失的影响。不同温度下碳酸氢铵溶液热分解特性如图2所示,不同温度下铵的损失如表2所示。
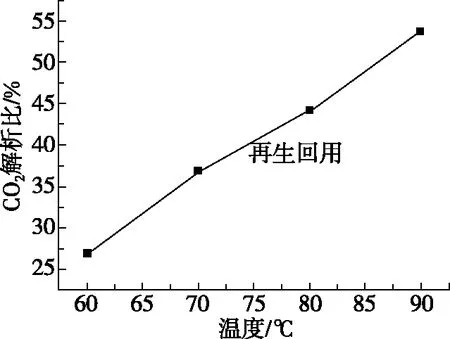
图2 不同温度下碳酸氢铵溶液CO2解析比
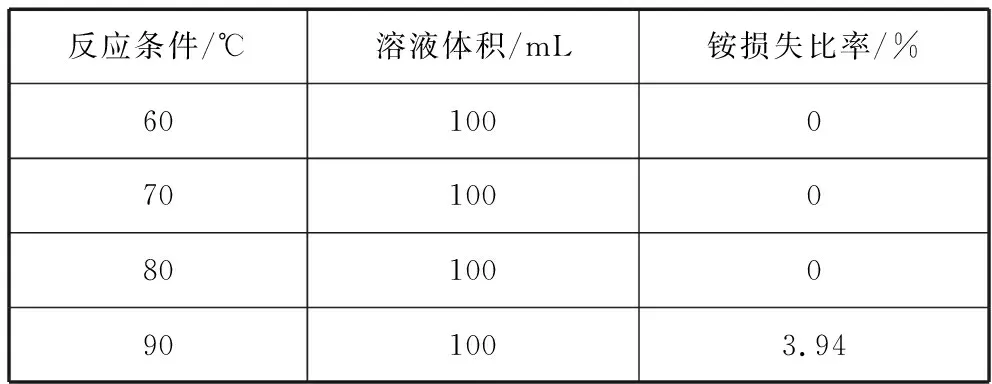
表2 不同温度下碳酸氢铵溶液铵损失比率
由图2可以看出,随着温度的升高,碳酸氢铵溶液解析CO2的比率增大。原因是碳酸氢铵的分解是吸热反应,反应温度升高,有利于反应平衡向正向移动。
由表2可以看出,在60~80℃范围内,铵几乎没有损失,而在90℃时,铵有一定程度的损失。原因是在60~80℃范围内,碳酸氢铵溶液分解主要是碳酸氢铵和碳酸铵之间进行转化,几乎没有氨的生成,也就基本不存在铵的损失。而在90℃时,反应②、③所占比重加强,有较多氨生成,而氨具有很强的挥发性,导致一定程度的铵损失。很明显,工业上采用60~70℃,一方面加快反应速度,促使反应向沉淀转化的方向进行,另一方面,铵几乎没有损失,但是带来一个问题是,溶液中有部分碳酸氢根转化成了CO2,碳酸氢铵溶解度(21.7 g/100 g)较低,通常在加热状态下也只能配制成浓度为3 mol/L左右的碳酸氢铵溶液,这样用碳酸氢铵作沉淀剂,会产生大量的废水,继而导致后续废水处理成本较高,如果用碳酸氢铵和氨水混合作沉淀剂,沉淀过程中产生的CO2又可被氨水吸收,重新生成碳酸氢铵,提高了原料的利用率,过滤后的滤液重新回收利用,能够大幅降低沉淀废水的产出量和CO2的排放量,进而减少废水的治理成本。如果温度过高,达到90℃,碳酸氢铵发生分解,原料的利用率下降。工业上釆用60~70℃,不仅仅加快反应速度,还防止温度过高,碳酸氢铵发生分解,碳酸氢铵和氨水混合溶液作沉淀剂,提高原料利用率。例如:2019全国卷Ⅰ26题,用碳酸氢铵和氨水混合溶液沉淀Mg2+。试题部分如下:
一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图3:
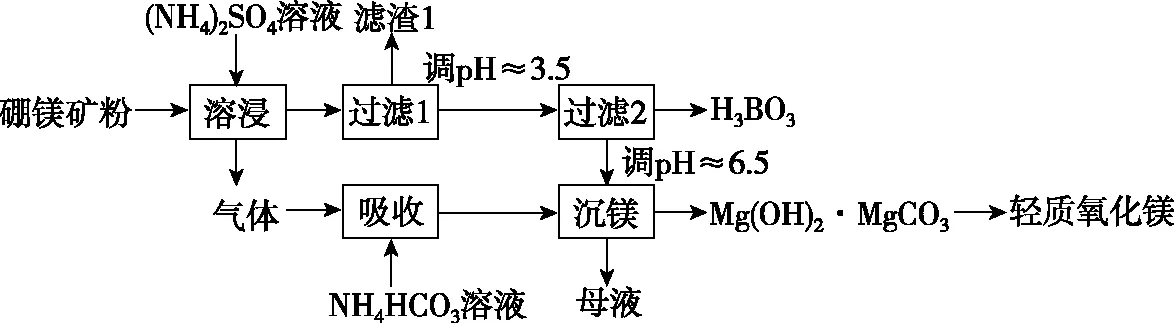
图3
用碳酸氢铵溶液和氨水混合沉淀Mg2+,同时调节pH,确保Mg(OH)2和MgCO3按1∶1沉淀,至于为什么要生成Mg(OH)2·MgCO3,是因为同离子效应,复盐的溶解性一般都小于组成它的单盐,Mg(OH)2·MgCO3比Mg(OH)2和MgCO3更难溶,因而沉淀Mg2+更完全。煅烧Mg(OH)2·MgCO3生成轻质氧化镁同时放出CO2,和开始溶浸时产生的NH3又生成NH4HCO3,实现了循环利用。
三、结论
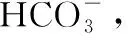
因此,这类试题的命题者必然会从这几个方面设置问题:沉淀平衡、反应原理、条件的控制、原料的循环利用,只要理解了上面所讲的几个问题,对解决这类题就会得心应手,应付自如。

