漫谈催化剂在化学反应原理综合题中的考查
湖南 周学兴 王 静
工业生产追求高效、绿色等,需要合适的生产条件,催化剂在实际生产中扮演着极其重要的角色,近年来,催化剂在化学反应原理题中考查频率高,在高中化学教学中指引学生进行深度学习,笔者旨在介绍深度学习下的质量作用定律、速率与温度、活化能与速率、温度与速率、催化剂与温度的关系以及催化剂的选择性、曲线中催化剂与温度的关系等内容,以期为高中化学教学中有关催化剂的深度教学给予一定的指引。
一、催化剂的发现与发展
催化剂最早由瑞典化学家贝采里乌斯发现。1836年,他在《物理学与化学年鉴》杂志上发表了一篇论文,首次提出化学反应中使用的“催化”与“催化剂”概念。根据国际纯粹化学与应用化学联合会(IUPAC)1981年的定义:催化剂是一种改变反应速率但不改变反应总标准吉布斯自由能的物质。这种作用称为催化作用,涉及催化剂的反应称为催化反应。
催化剂种类繁多,按状态可分为液体催化剂和固体催化剂;按反应体系的相态可分为均相催化剂和多相催化剂,均相催化剂有酸、碱、可溶性过渡金属化合物催化剂和过氧化物催化剂,多相催化剂有固体酸催化剂、有机碱催化剂、金属催化剂、金属氧化物催化剂、络合物催化剂、稀土催化剂、分子筛催化剂、生物催化剂、纳米催化剂等;按照反应类型又分为聚合、缩聚、酯化、缩醛化、加氢、脱氢、氧化、还原、烷基化、异构化等催化剂;按照作用大小还分为主催化剂和助催化剂。此外还有生物催化,酶就是一种生物催化剂。
二、高考题中的催化剂
在以真实情境为背景,解决实际问题为目的,基础知识为线索,落实核心素养的高考命题框架下,催化剂的考查将继续是高考的热点。催化剂在工业生产中扮演着重要的角色,从反应速率角度思考既不能太快又不能太慢,讲究生产效率,即成本的最低化和收益的最大化有机结合。工业生产大多数反应都有副反应,高考中化学反应原理综合题主要集中考查化石燃料衍生产物的综合利用、污染物(如氮氧化物)的综合治理、新型能源(如氢气)的开发利用等领域。近五年,催化剂或活化能相关概念在高考化学真题中的考查情况,见表1。
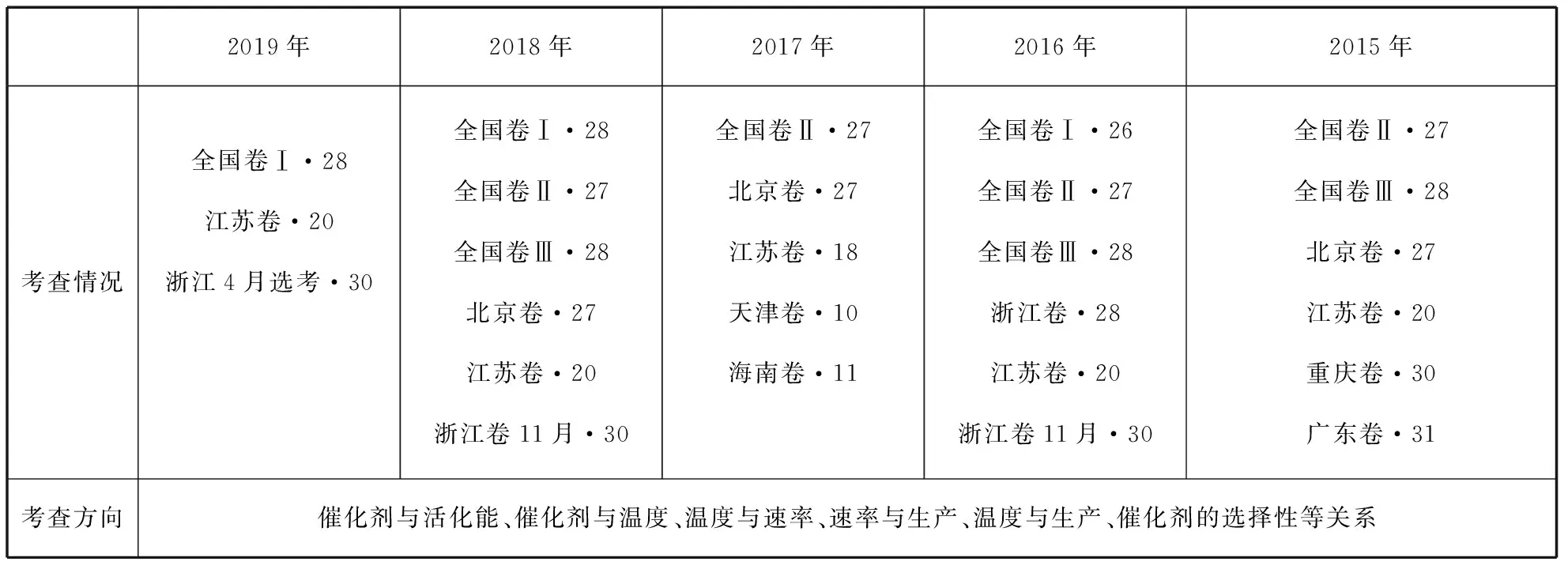
表1 2015~2019年高考真题催化剂相关知识考查情况汇总
催化剂的考查离不开化学平衡内容的考查,化学平衡的考查需要构建基本的解题模型,见图1。

图1 化学平衡的解题模型
催化剂在图1中扮演的角色,主要是通过影响化学反应速率,达到工业生产和实验目的。同时催化剂的活性,又受到外界因素,主要是温度的影响。有关催化剂的知识模型,见图2。

图2 催化剂的知识模型
有关催化剂的深度学习,有助于学生在反应原理题中,认识催化剂与工业生产的关系,迅速解决实际生产问题,尤其是有关的图象问题。

(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
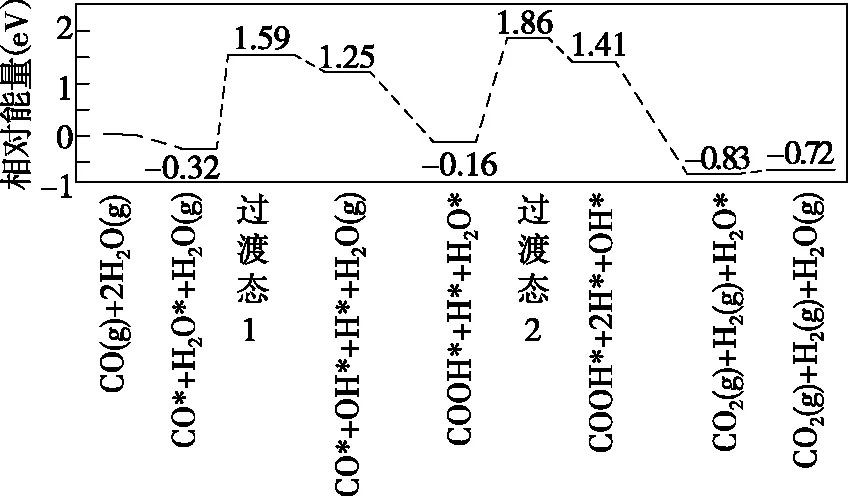
可知水煤气变换的ΔH________(填“大于”“等于”或“小于”)0。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:____________________。

该题表明,催化剂参与反应的过程是很复杂的,通过参与反应可实现活化能(能垒)的改变,图象中最大能垒为中间产物“COOH*+H*+H2O*”转化为过渡态2的能量变化,即2.02 eV。该反应活化能最大,反应速率应最慢,为整个反应历程中决定反应速率的步骤,称为控速步。
教师对反应原理的机理部分知识的深度教学与学生对反应原理的机理部分知识的深度学习是很有必要的。欲从容解决催化剂在高考中的考查情况,还需落实以下几个关键知识点。
1.速率与生产的关系
实际生产过程中,研究工作者与生产者需要综合考虑生产效率——转化率高、速率快、产品质量高,其中速率高与转化率(或产率)高存在辩证统一的关系。速率快,可保证单位时间内转化率(产率)的增加,这样可以让投资者收益效率提升,但是并非一味提升速率,若是转化率低,需要投入更多的原料才有更高的收益。有些反应转化率高,但速率较慢,需要采取措施增大速率。有的反应本身较快,但需要改变外界条件促进反应正向进行。实际生产者会尽可能兼顾速率和转化率。
实际工业中合成氨与硫酸工业的生产条件的选择,很好地说明了速率与收益、转化率与收益、成本与收益的关系。
2.质量作用定律

瑞典物理化学家阿仑尼乌斯[S.A.Arrhenius(1859-1927)]根据大量实验和理论验证,提出反应速率与温度的定量关系式:
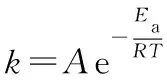

大多数反应都符合阿仑尼乌斯经验式。式中:A为指前因子,与速率常数k有相同的量纲;Ea叫做反应的活化能(也称阿仑尼乌斯活化能),常用单位为kJ·mol-1;A与Ea都是反应的特性常数,基本与温度无关,均由实验求得;T表示绝对温度,R表示气体常数,取8.314 J·mol-1·K-1。
(1)活化能——Ea
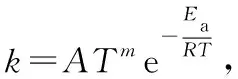
(2)活化能与速率的关系
【例2】(2014·浙江卷·27节选)煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:


请回答下列问题:
(3)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是________。

A
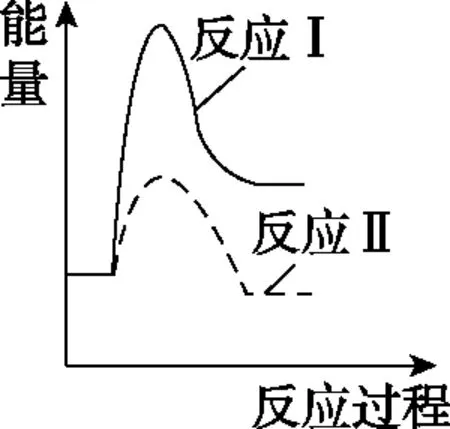
B
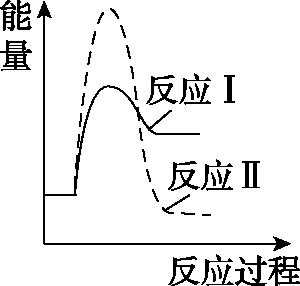
C

D
【答案】C
该问深度考查了速率与活化能的关系,一般而言,活化能低(能垒低),速率快(类似于加入催化剂,降低活化能,反应速率加快)。由式①可知,温度、浓度不变,活化能低,速率常数大,结合质量作用定律可知,速率将加快。
设未加催化剂时的某反应的活化能为Ea1,加入催化剂后为Ea2,由式②可知:
可转换为:
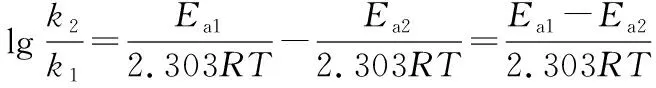

可见,其他条件一定时,活化能的大小,对速率常数的影响极大,继而影响化学反应速率。
(3)温度与速率的关系
【例3】(2018·全国卷Ⅱ·27节选)CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如表:

积碳反应CH4(g)C(s)+2H2(g)消碳反应CO2(g)+C(s)2CO(g)ΔH/(kJ·mol-1)75172活化能/(kJ·mol-1)催化剂X3391催化剂Y4372
①在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如下图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)。
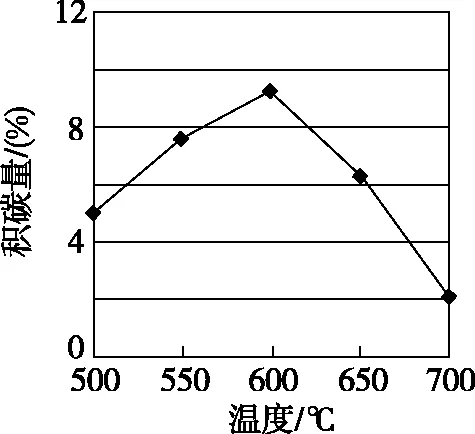
A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
【答案】AD
该题运用常规思维,通过图象信息——“随着温度升高,积碳量先增多,后减少”,不难推出D项正确,从活化能角度思考,一开始积碳反应活化能低,反应速率快;温度升高,活化能大的反应受到温度的影响程度大,即增大程度(倍数)大,最终消碳速率“赶超”积碳速率。为何改变温度,活化能大的速率变化程度大呢?
根据阿仑尼乌斯经验式,可知不同温度下,速率常数的关系如下:
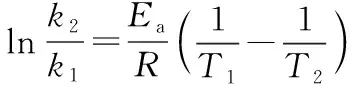
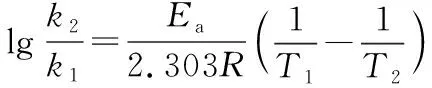
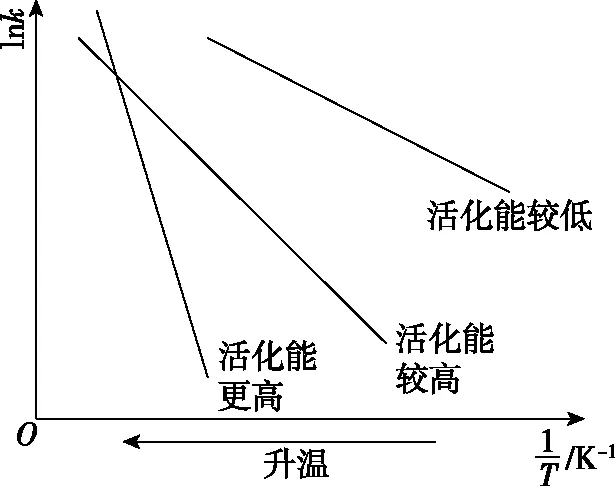
由数据和图象可见,其他条件一定时,相同反应,温度升高,速率常数增大。不同反应,活化能大,速率常数(反应速率)受到温度的影响大。但活化能大的反应,初始反应速率一般较慢,这样就与活化能小的反应存在“追击”问题,如例3,碳的物质的量先增加后减小。
3.催化剂与温度的关系
催化剂需要合适的温度,温度过低,活性低;温度过高,催化剂可能失活。但温度升高,速率是加快的,可能还会影响平衡移动。
【例4】(2018·江苏卷·20节选)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。
(1)用水吸收NOx的相关热化学方程式如下:



(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为________mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图甲)。
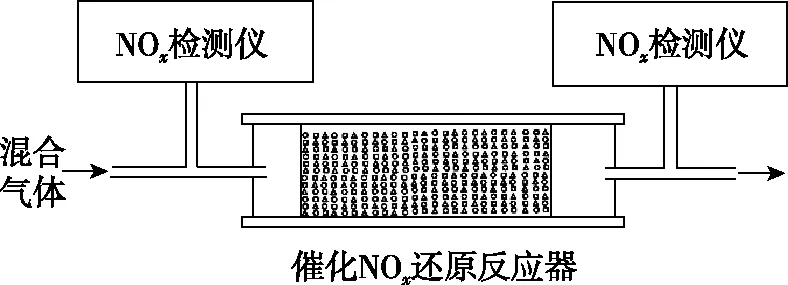
甲

乙
反应相同时间NOx的去除率随反应温度的变化曲线如图乙所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是____________________;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是_________________
【答案】(1)-136.2
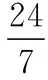
该题较好的考查了速率与产率、速率与温度、速率与催化剂、催化剂与温度的辩证关系。温度升高,可提升速率,并且影响化学平衡,对于放热反应而言,温度高,不利于转化率;对于吸热反应而言,速率和产率双重促进。但温度过高,成本高。催化剂的活性受到温度的影响,在一定温度范围内,催化剂活性随着温度升高而升高,温度继续升高,催化剂活性降低,类似动物体内的酶。
4.催化剂的选择性
【例5】某实验室控制CO2和H2初始投料比为1∶2.2,进行如下实验:


在相同压强下,经过相同反应时间测得如下实验数据:
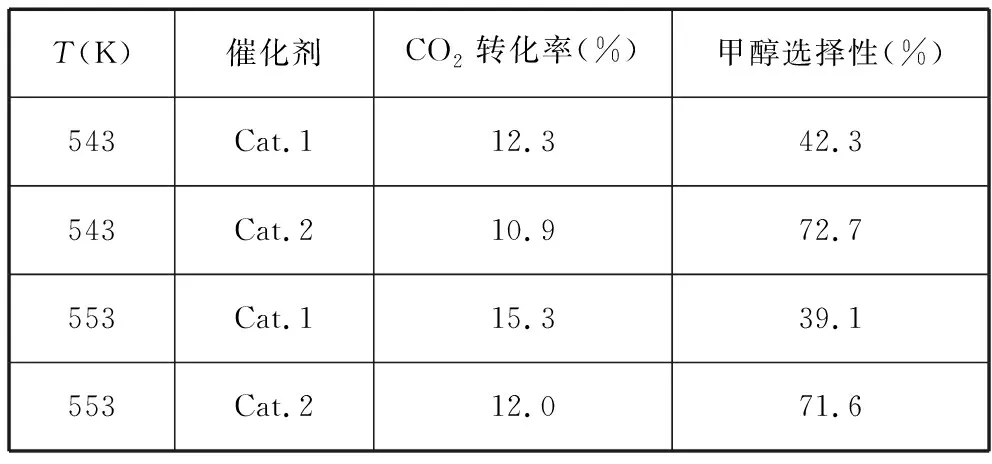
T(K)催化剂CO2转化率(%)甲醇选择性(%)543Cat.112.342.3543Cat.210.972.7553Cat.115.339.1553Cat.212.071.6
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比。
(1)有利于提高CO2转化为CH3OH平衡转化率的措施有________。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
【答案】D
科研工作者,在进行可逆反应产率、转化率、催化剂选择性研究的过程中,基本要求反应相同时间,在单一变量(温度、催化剂、投料比)的前提下,展开数据测定,然后测绘图象或表格。催化剂的选择性与生物催化剂——酶的专一性类似,一定温度下,无机催化剂的选择性主要指对目标反应的速率的催化效果。选择性好,等同于催化效果好。
通过上述分析可知,催化剂对反应速率的影响较大,实际生产中,往往需要找到合适的催化剂(选择性好)。对于许多副反应的生产体系,催化剂的选择格外重要。
三、总结
根据学业水平考试的目的,化学学业水平考试命题必须坚持以化学学科核心素养为导向,准确把握“素养”“情境”“问题”和“知识”4个要素在命题中的定位与相互联系,构建以化学学科核心素养为导向的命题框架。
在新高考背景下,无论是过渡时期还是将来的高考命题的命题框架,如图3所示。
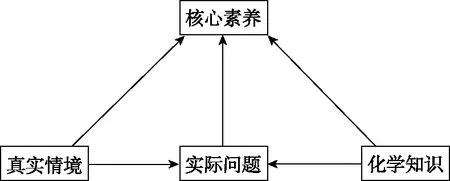
图3 高考命题基本框架
反应原理综合题,以实际生产问题或生产试验研究为测试载体,以真实的生产问题或研究问题为测试任务,以化学知识(外界因素与速率的关系、外界因素与平衡移动的关系、平衡常数相关计算)为解决问题的工具,以核心素养(变化观念与平衡思想、证据推理与模型认知、科学精神与社会责任)为测试宗旨。
郑长龙教授提出:目前教师的“两退化”特别明显,一位教师从事初中教学时间久了,就退化到初中水平,高中教师从事教学时间久了,就退化到高中水平。一线教师要认识到这种现象,并通过不断提升自身知识和思想格局避免陷入这两种退化。教师对化学平衡内容的深度学习、深度教学,有助于自身素养的提升,同时有助于学生核心素养的提升,让高中知识更具真实性、完整性,在处理高中化学知识的角度上更全面、更具科学性,对教材的深化更具科学性、可行性,在一定程度上也有助于学生突破近年难度相对较大的化学反应原理综合题。

