由“地方卷”看“全国卷”——铁及其化合物考点归纳及预测
江苏 季宗宝 赵王侠
新教材中对“铝及其化合物”知识有所删减,更加突出了“铁及其化合物”知识的重要性,铁元素在生活生产中有着极其重要的应用,性质上也具有多变性,是较活泼金属的代表元素,在高考中占有重要的地位,在高考试卷中的分值也越来越高。笔者对近几年全国卷Ⅰ、卷Ⅱ、卷Ⅲ及其他省市的试卷进行了统计,铁及其化合物几乎每年都会以选择题或者大题形式出现,如2019年的全国卷Ⅰ、江苏卷等都进行了考查,因此要引起高度重视。“铁及其化合物”内容丰富、知识面广,下面对“铁及其化合物”进行全面梳理、归纳总结,主要通过对江苏、北京、天津等省市及部分全国卷的历年高考真题进行分类解析,以此对2020年的全国卷进行初步的预测。
一、重点知识梳理
1.Fe的化学性质

Fe化学方程式(离子方程式)与强氧化剂:Cl2、Br22Fe+3Cl2△2FeCl3与弱氧化剂:S、I2、稀盐酸、稀硫酸、硫酸铜溶液、氯化铁溶液Fe+S△FeSFe+2H+Fe2++H2↑Fe+Cu2+Cu+Fe2+Fe+2Fe3+3Fe2+与O2、水蒸气3Fe+2O2点燃Fe3O43Fe+4H2O(g)高温Fe3O4+4H2(g)与浓H2SO4、浓HNO3发生钝化
特别提醒:
①铁与硫酸铜溶液反应为印刷电路板的反应原理,铁与氯化铁溶液反应可用于除去氯化亚铁溶液中的Fe3+。
②要特别注意Fe3O4中Fe的化合价为+2和+3。
③钝化是一个短暂的氧化还原反应,一不能认为不反应,二更不能认为铁能溶解于浓硫酸、浓硝酸中,这是一个常考的重要考点。
2.铁的两种氢氧化物:


类别Fe(OH)2Fe(OH)3颜色状态白色沉淀红褐色沉淀化学性质Fe(OH)2+2H+Fe2++2H2O4Fe(OH)2+O2+2H2O4Fe(OH)3Fe(OH)3+3H+Fe3++3H2O 2Fe(OH)3△Fe2O3+3H2O 相互转化4Fe(OH)2+O2+2H2O4Fe(OH)3白色→灰绿色→红褐色
特别提醒:
①Fe2O3俗名为铁红,是铁锈的主要成分,可用作颜料。
②Fe(OH)2的沉淀pH范围为7.6~9.6,Fe(OH)3的沉淀pH范围为2.7~3.7,工业上除去溶液中的Fe2+往往先通过氧化剂(如H2O2)将其氧化为Fe3+,再通过调节pH生成沉淀以达到除杂的目的。
3.Fe2+和Fe3+的鉴别:
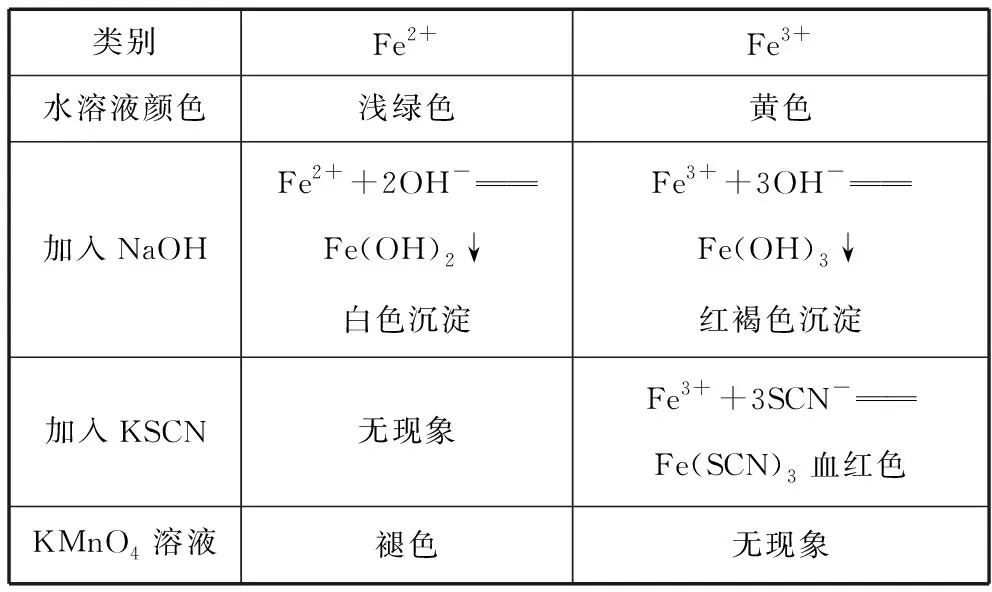
类别Fe2+Fe3+水溶液颜色浅绿色黄色加入NaOHFe2++2OH-Fe(OH)2↓白色沉淀Fe3++3OH-Fe(OH)3↓红褐色沉淀加入KSCN无现象Fe3++3SCN-Fe(SCN)3血红色KMnO4溶液褪色无现象
特别提醒:
①Fe(SCN)3为络合物,书写离子方程式时,既不可以拆开,也不能写沉淀符号。
②检验Fe2+时,先加入KSCN,无现象,再通入氯水时,溶液呈血红色,即可说明有Fe2+存在,注意先后顺序。
4.Fe3+水解
①Fe3+易水解,可利用FeCl3水解生成Fe(OH)3胶体来净水。
②制备无水FeCl3时,应在HCl气流中加热蒸干FeCl3溶液。
5.结构
Fe的电子排布式:1s22s22p63s23p63d64s2
Fe2+的电子排布式:1s22s22p63s23p63d6
Fe3+的电子排布式:1s22s22p63s23p63d5
二、题型解析
根据对2019年全国各地的试题分析,发现对铁及其化合物的考查角度越来越多样化,下面对考查角度进行分类解析。
1.在阿伏加德罗常数中考查
【例1】(高考题重组)设NA为阿伏加德罗常数的值。下列有关叙述正确的是
( )
A.(2018·全国卷Ⅱ·11B)100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目为0.1NA
B.(2018·全国卷Ⅰ·10A)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
C.(2016·全国卷Ⅰ·8C)1 mol Fe溶于过量硝酸,电子转移数为2NA
D.0.1 mol的铁在0.1 mol的Cl2中完全燃烧转移电子数为0.2NA
【答案】D
【解析】Fe3+在溶液中发生水解生成Fe(OH)3,故Fe3+数目少于0.1NA,A错误;FeCl3水解是可逆反应,且1个Fe(OH)3胶粒由多个Fe(OH)3聚合而成,故胶粒数目少于0.1NA,B错误;1 mol Fe溶于过量硝酸生成硝酸铁,电子转移数为3NA,C错误;铁在Cl2中完全燃烧生成FeCl3,但是由于Cl2少量,只有0.1 mol,故转移电子数为0.2NA,D正确。
易错分析及预测:
以上主要以Fe和Fe3+的基本性质为基础,融入阿伏加德罗常数,考查Fe在不同反应中的电子转移情况,以及Fe3+在水溶液中会发生微弱水解,且水解反应是可逆反应。对于D项,不理解的同学有很多,其实在化学反应转移电子数的计算时,不仅要关注元素自身得失电子情况,还要注意各反应物量的情况,要依据量少的物质进行计算,如D项,此时转移的电子数只能为0.2NA,若是0.1 mol Fe与足量氯气反应,则转移的电子数为0.3NA,要注意加以区分,这种考查形式在各地高考试题中还未出现,因此是Fe结合阿伏加德罗常数考查的重要方向。
2.在实验操作题中考查
【例2】(高考题重组)下列实验操作能达到实验目的的是
( )
A.(2016·全国卷Ⅱ·13改编)将NaOH浓溶液滴加到饱和FeCl3溶液中,制备Fe(OH)3胶体
B.(2019·江苏卷·13改编)向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色,说明X溶液中一定含有Fe2+
C.(2016·全国卷Ⅰ·10C)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D.(2018·江苏卷·12)向CuSO4溶液中加入铁粉,有红色固体析出,说明Fe2+的氧化性强于Cu2+的氧化性
【答案】C

【例3】(2018·天津卷·4节选)由下列实验及现象推出的相应结论正确的是
( )

实验现象结论A某溶液中滴加K3[Fe(CN)6]溶液产生蓝色沉淀原溶液中有Fe2+,无Fe3+
【解析】生成的蓝色沉淀为铁氰化亚铁沉淀,说明原溶液中一定含有Fe2+,但无法排除原溶液中含有Fe3+,故A错误。
【例4】(2019·天津卷·4节选)下列离子方程式能用来解释相应实验现象的是
( )

实验现象离子方程式B向沸水中滴加饱和氯化铁溶液得到红褐色液体Fe3++3H2OFe(OH)3↓+3H+D氧化亚铁溶于稀硝酸FeO+2H+Fe2++H2O
【解析】向沸水中滴加饱和氯化铁溶液生成氢氧化铁胶体,故B错误;氧化亚铁溶于稀硝酸中,因为硝酸具有强氧化性,所以生成Fe3+,故D错误。
易错分析及预测:
检验Fe2+时,先加入KSCN时无现象,再通入氯水,有血红色出现,才可说明有Fe2+存在,滴加K3[Fe(CN)6]溶液来鉴别Fe2+,不能排除溶液中含有Fe3+。由以上几个真题可以看出Fe(OH)3胶体的制备、氯化铁溶液的配制,以及Fe2+、Fe3+的检验是考查的热点,可能会重复考查,但是设问形式可能有所变化,可能以表格形式出现,也有可能将实验现象与离子方程式相结合,如2019年的天津卷,这要引起我们注意。
3.对物质的性质、用途、转化及制备进行考查
【例5】(2016·江苏卷·3节选)下列有关物质的性质与用途具有对应关系的是
( )
C.Fe2(SO4)3易溶于水,可用作净水剂
【解析】Fe2(SO4)3用作净水剂是因为铁离子水解生成氢氧化铁胶体,吸附水中悬浮的杂质,C错误。
【例6】(2018·天津卷·3节选)下列叙述正确的是
( )
B.铁管镀锌层局部破损后,铁管仍不易生锈
【解析】铁管镀锌层局部破损后形成原电池,锌比铁活泼,作负极,铁作正极被保护起来,因此铁管仍不易生锈,B正确。
【点评】从以上三题可以看出,铁及其化合物的性质和用途也是高考的常考考点之一,注意性质和用途的对应关系。
【例7】(2019·江苏卷·9节选)在给定条件下,下列选项所示的物质间转化均能实现的是
( )
【解析】电解NaCl溶液可以得到Cl2,但是Cl2与铁加热反应生成的是FeCl3,故A错误。
易错分析及预测:
Fe3+、Al3+易水解生成胶体,可吸附沉降用作净水剂,但不能杀菌消毒。从以上几题可以看出铁及其化合物的性质、用途及转化知识,江苏卷几乎每年都考查到。铁及其化合物之间的转化,对于全国卷来说也是一个重要的参考。
4.在离子共存中进行考查
【例8】(高考题重组)常温下,下列各组离子在指定溶液中能大量共存的是
( )
A.(2017·江苏卷·9A)无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-

【答案】D

易错分析及预测:
此类题目在地方题中经常出现,尤其在江苏卷中是每年必考的类型,但也朝着综合性方向发展,此类题目主要结合Fe2+的还原性、Fe3+的氧化性及双水解的特点进行考查,虽然近年全国卷不在以单个题目形式出现,但知识点依然很重要,且不排除以个别选项出现。
5.在物质结构题中进行考查

(2)Fe2+基态核外电子排布式为_________________
【解析】(2)Fe2+基态核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6。
【例10】(2018·全国卷Ⅱ·35节选)硫及其化合物有许多用途,相关物质的物理常数如表所示:

H2SS8FeS2SO2SO3H2SO4熔点/℃-85.5115.2沸点/℃-60.3444.6>600(分解)-75.516.810.3-10.045.0337.0
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________。

【例11】(2019·全国卷Ⅱ·35节选)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(2)Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为____________。
【解析】(2)Fe在失电子时首先失去4s轨道上的电子,Sm3+的价层电子排布式为4f5。
易错分析及预测:
铁的物质结构在高考题中是常考的对象,以后还会围绕Fe、Fe2+和Fe3+的电子排布式进行考查,但要注意的以下两点:一是失电子时是先失去4s轨道上的电子,再失去3d轨道上的电子;二是注意题目要求是写基态原子电子排布式、轨道排布式还是价层电子排布式。
6.结合化学计算进行考查
【例12】(2019·江苏卷·18)聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为______________________________;水解聚合反应会导致溶液的pH________。

①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)。


【点评】本题有很强的代表性,以Fe2+为切入口,以新的情境探究Fe2+和Fe3+的性质、相互转化以及Fe3+的水解,并通过滴定来计算样品中铁元素的质量分数,正所谓“新瓶换旧酒,换汤不换药”,同学们在解题时一定要认真读题。此题属于“起点高,落点低”,融入到化工生产中,其实还是着重对基础知识的考查。
7.结合电化学进行考查


①作负极的物质是________。
②正极的电极反应式是_________________
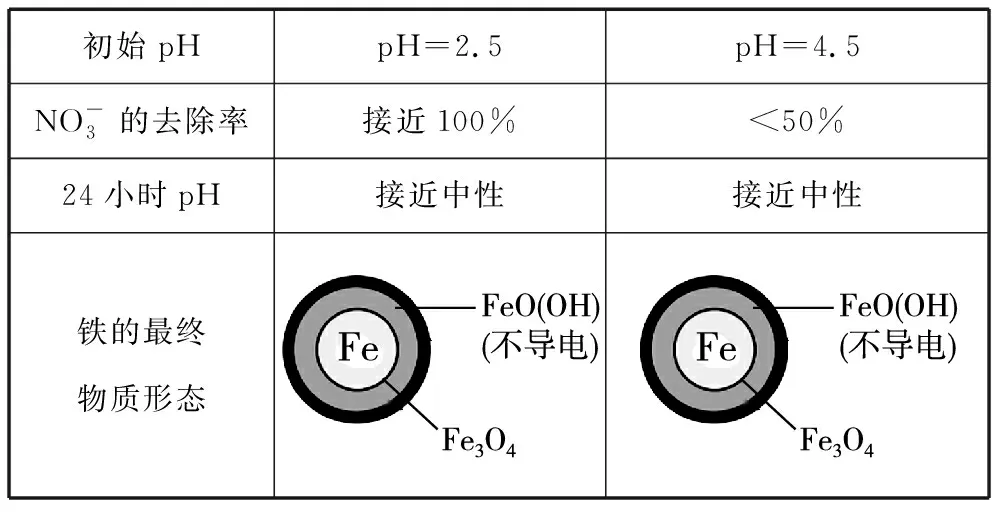
初始pHpH=2.5pH=4.5NO-3的去除率接近100%<50%24小时pH接近中性接近中性铁的最终物质形态


Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示。可得到的结论是_________________

pH=4.5(其他条件相同)


初始pHpH=2.5pH=4.5NO-3的去除率约10%约3%1小时pH接近中性接近中性

(2)FeO(OH)不导电,阻碍电子转移
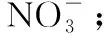
(4)初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足

【点评】本题难度较大,情境新,题目异,当年得分率比较低,其实本题的核心在考查铁及其化合物的基本性质的基础上,考查学生的读图能力,信息获取与加工、化学实验探究、从化学视角分析解决问题和化学学科思维等能力,引导学生认识化学科学的意义和本质,运用化学知识解决实际问题,真正落实提高学生化学学科“证据推理”的核心素养。
三、考情预测
对于“铁及其化合物”的考查,在2020年全国各地的试卷中一定会再次出现,估计还是以情境题的形式,以铁矿石或铁盐的材料出现在实验探究题或者化工流程题中,如2018年江苏卷第18题和2018年北京卷第28题,很可能再次结合电化学知识进行考查,如2016年北京卷的题目,但是无论题目形式如何变化,还是牢记“万变不离其宗”,做好基础知识的储备,训练考生的读图能力及信息获取与加工能力,提升考生的化学学科核心素养。
【即时训练】(2019·江苏苏锡常镇三检)LiFePO4是一种电动汽车电池的电极材料,实验室以绿矾和磷酸为原料制备LiFePO4的流程如图所示:

(1)“溶解”和“反应1”步骤不能互换的原因是_________________
(2)“反应1”的离子方程式是_________________

(4)LiFePO4需要在高温下成型才能作为电极,高温成型时要加入少量活性炭黑,其作用是①
;
②____________________。
(5)利用LiFePO4作电极的电池稳定、安全、对环境友好,放电时工作原理如图所示。放电时电极b的电极反应式为_________________
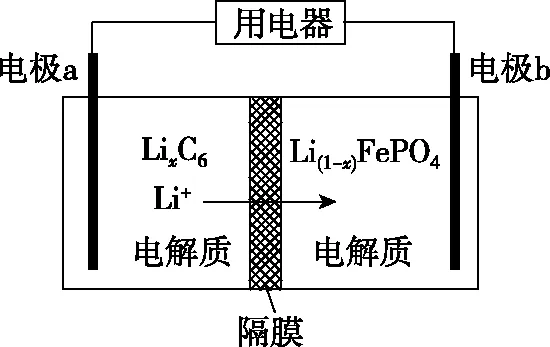
【答案】(1)可能导致FePO4中混有较多Fe(OH)3(2分)

(3)9∶7 (2分)
(4)①改善成型后LiFePO4(或电极)的导电作用 (2分)
②与空气中O2反应,防止LiFePO4中的Fe2+被氧化 (2分)


