基于化工生产实际的转化率的复习研究
河北 韩万中
化学学科的重要价值在于人们可以根据化学反应原理控制和利用化学反应,通过化工技术和手段获取人类生活和生产所需要的能量和物质。主要反应物的转化率大小是化工生产的一种目标追求,是衡量化工生产效率的重要评价指标。高中化学反应原理模块的课程结构表明,转化率是建立在限度和速率基础上的高级概念,具有真实的客观存在和应用,具有特定的认识角度、认识路径、推理判断,有利于学生构建认知模型和经验图示,有利于促进知识的结构化、功能化,具有良好的素养发展价值。
在高三复习化学反应原理模块中发现,转化率的考查多以化工生产的真实原理和过程为背景,利用文字、曲线、表格等形式,考查学生获取、整合和应用信息的能力,分析和解决化学问题的能力,但涉及转化率(或产率)-温度问题,因其多变量、多反应、多方向表征,能力要求较高,学生得分率普遍较低。因此,教师通过创设问题情景,搭建思维支架,帮助学生剖析转化率的变化规律,破解异常,回归到基本的反应原理上,培养学生的“变化观念和平衡思想”“证据推理与模型认知”素养,进而得出解决问题的思维抽象模型。
一、学生应有的对转化率的基本认识思路
人教版教材正文中有关转化率的叙述出现了2次。其中《必修2》指出“化学反应的限度决定了反应物在该条件下的最大转化率”,说明了平衡转化率可以表示一定温度下某反应的限度;“在生产和生活中,人们希望促进有利的化学反应(提高反应物的转化率即原料的利用率,加快反应速率等)……”,说明了转化率是可以调控的,可以使反应朝着符合人们预期的方向进行,体现条件控制的魅力。
《选修4》指出“K值越大,说明平衡体系中生成物所占的比例越大……即该反应进行得越完全,反应物转化率越大”。在这里必须指出来,这个说法是有条件的,教师可启发学生从课本给出的例题进行拓展和推理:


起始浓度/mol·L-1ab0 0
变化浓度/mol·L-1xxxx
平衡浓度/mol·L-1a-xb-xxx
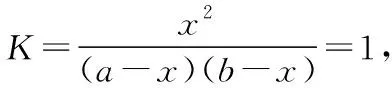
从上述计算过程可以看出:对于某一特定反应,根据一定温度下的平衡常数计算该条件下反应物的平衡转化率,还需要起始态的反应物浓度,且转化率随反应物浓度的不同而改变。至此,教师可以再搭建逆向思维平台:对于某反应,其反应物的平衡转化率越大,反应的平衡常数越大吗?学生会领悟到温度不变时,反应物起始浓度不同,转化率不同,但平衡常数相等,即在一定温度下,化学平衡常数是一个定值,但认为平衡转化率也是一个定值就是错误的。化学平衡常数与反应平衡转化率虽然均可表示化学反应的限度,但二者并非严格意义的正相关,平衡常数只是温度函数,平衡转化率可受投料配比、温度、压强等多种因素影响。
【例1】(2019·全国卷Ⅱ·28节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:


图1
可知反应平衡常数K(300℃)________(填“大于”或“小于”)K(400℃)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=________________________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是_________________
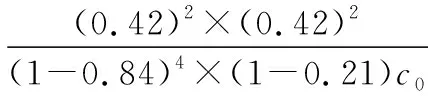
【解析】三条曲线均为平衡转化率-温度的单调减函数,说明升高温度,平衡转化率降低,即反应物减少,平衡向逆反应方向移动,根据勒夏特列原理ΔH<0,所以K(300℃)大于K(400℃)。对于两种反应物参加的反应,在其他条件不变时,增加一种反应物的浓度可提高另一种反应物的转化率。本例题中降低进料浓度比c(HCl)∶c(O2),HCl的平衡转化率增大,因此曲线Ⅰ、Ⅱ、Ⅲ对应的进料c(HCl)∶c(O2)分别是1∶1、4∶1、7∶1。结合图1相关数据,列出三段式求解即可。
二、指导学生区分有关转化率的两种情况
对于放热反应,升高反应温度,平衡向着逆反应方向移动,故而反应物的转化率下降,正如例1中的转化率-温度曲线趋势;相反,对于吸热反应,升高反应温度,平衡向着正反应方向移动,反应物的转化率上升,学生对分析这一类问题的思维模型建立较好。此处的转化率指的是平衡转化率,由于很多反应到达平衡需要较长的时间,因此,实际生产中往往使用的是建立平衡过程中的某时段的转化率,而非极限状态的平衡转化率,这一点在复习和模考时是很多学生忽视的,也是教师评讲试题时学生普遍存在认知障碍的地方。

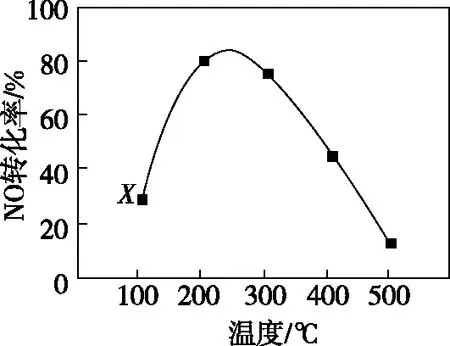
图2 不同温度下NO的转化率
【答案】<
【解析】判断反应热时,学生难以理解的是:在曲线增函数部分,由升高温度转化率增大得出正反应吸热的结论;在减函数部分,由升高温度转化率减小得出正反应放热的结论。学生都知道没有那一个反应既是放热反应又是吸热反应的,所以认知发生冲突。至此,教师可带领他们审读题干,咬文嚼字,寻找题眼,这时很多学生会发现“相同时间”这个关键词。“相同时间”里有什么秘密呢?在坐标系中,x轴是温度,y轴是NO转化率,曲线前半段由于温度较低,反应速率小,在“相同时间”内反应尚未达到平衡状态,因此,升高反应温度,速率增大,NO转化率呈上升型变化,注意这个转化率不是对应温度下的平衡转化率,而是某时段的转化率;曲线后半段,则因温度较高,反应速率较大,在“相同时间”内反应达到平衡状态,甚至还余有发生平衡移动的时间,NO的转化率是对应温度下的平衡转化率,下一步怎样判断反应热,其思维方式与例1类似。
由于人教版《选修4》通本没有提及平衡前某时段的转化率一词,因而学生一遇到转化率就“默认”为是平衡转化率,给分析转化率-温度相关问题带来困惑和纠结。本题的分析和解答了学生平衡转化率与转化率是两个不同的概念,要善于识别区分。
对于例2图中各点,如果保持反应温度不变,延长反应时间至达到平衡,其平衡转化率情况如图3中的虚线所示。

图3 虚线表示平衡转化率随温度的变化关系
观察图3,若虚线表示相同条件下平衡转化率随温度的变化关系,那么例2中相同温度下实线与虚线的差别就是反应时间。延长反应时间能够提高NO转化率,但很多化学反应达到化学平衡都需要相当长的时间,因此在实际的生产中,工程师并不单纯地追求平衡转化率,而是统筹考虑限度和反应速率,以期得到单位时间的最大产量。比如像ΔH<0的化学反应,温度对其平衡转化率与速率的影响不一致,怎样在恒压、相同投料、催化相同时间的前提下,通过控制温度变量测定转化率,从而确定最佳温度,正是例2实验研究的实际意义所在。
催化剂是现代化学中关键而神奇的物质之一。例2中的化学反应也使用了催化剂,学生在观察分析例2中曲线时,对催化剂与转化率间的关系理解存在误区。一部分学生认为,因为催化剂同倍率改变正、逆反应速率,不能使平衡移动,所以不能改变转化率。另一部分学生则认为化学反应从开始到平衡的建立需要一定的时间,使用催化剂缩短到达平衡的时间,单位时间内转化反应物的物质的量(或物质的量浓度)是增大的,所以使用催化剂可以增大转化率。这两类同学说的都有正确的方面。催化剂加快反应速率的原因是改变了反应路径,不改变反应方向和限度,所以不改变平衡转化率,此类同学分析中没有强调平衡转化率。但在建立平衡过程中使用催化剂则能提高相同反应时间段的转化率,这里的转化率不是平衡转化率,此类同学分析中的转化率应当是非平衡时的转化率。
化工生产追求生产效率,往往更加侧重以催化剂为主导的速率,并且催化剂的活性受温度影响很大,因此生产中的选择的实际转化率可能不是该温度下的平衡转化率。平衡转化率与实际转化率的差距,就是理想状态与反应实际操作水平的差距,二者产值越大,说明操作水平越低,增产潜力越大。
教学时,教师可以通过创设问题情景,引导学生建构可逆反应在平衡建立过程中的转化率变化的思维模型,深化理解优化反应条件的意义增强了工业生产的时间及效率观念,学生能够理解化学反应条件优化的意义,真正区分平衡转化率和转化率这两个概念。
三、认识转化率与产率的不同
《高中化学课程标准(2017年版)》特别强调“创设真实且富有价值的问题情景,促进学生化学学科素养的形成和发展”,要“将核心概念与情景、活动和问题解决融为一体”。基于此,近几年高考真题、模拟试题中情景式题目增多,其中不乏一些化工实际的新概念或陌生术语,常给学生审题过程中引起困惑,如平衡产率与平衡转化率有何区别,同时,由于化工原理非常复杂,常存在平行反应、连串反应等,造成转化率与产率的不一致,转化率高但产率不一定高,这类问题的分析和解决对学生能力和素养的要求更高。
【例3】(2017·全国卷Ⅱ·27改编)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备,回答下列问题:


图4 产率与温度关系图
丁烯产率在590℃之前随温度升高而增大的原因可能是______________________________;590℃之后,丁烯产率快速降低的主要原因可能是_________________
【答案】590℃之前,升高温度,使反应向正反应方向进行,丁烯产量增多;或温度升高,反应速率加快,单位时间产生丁烯更多
590℃之后,丁烯裂解生成短碳链烃类的速率加快,使副产物增多
【解析】本题可谓例2的姊妹篇。例2中的化学反应为放热反应,转化率-温度曲线呈现先升后降趋势,其中平衡转化率-温度曲线为下降型;本题中的丁烷催化脱氢是一个正反应吸热的反应,如果讨论转化率与温度的关系,则转化率及平衡转化率均随温度的变化呈上升型。然而,本题图象给出的则是产率-温度曲线,很多学生会想产率与转化率能画等号吗?

本题中,丁烯产率在590℃之前随温度升高而增大,从平衡的角度出发,反应吸热,升高温度平衡向正反应方向移动,因此产率升高,与平衡转化率增大基本一致;从速率的角度出发,升高温度化学反应速率加快,单位时间内生成的丁烯增多,产率增大,与转化率基本一致。590℃之后,丁烯产率快速降低,用平衡移动无法解释,结合图象信息和题干文字叙述可以发现丁烯高温裂解生成短碳链烃是产率降低的主要原因。需要指出的是,在没有其他信息的情况下,升高温度使催化剂活性降低,也是一个可能的原因。
【例4】(2019·江苏卷·20节选)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:




图5 CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化
(1)温度高于300℃,CO2平衡转化率随温度升高而上升的原因是_________________
(2)220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有_________________
【答案】(1)反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度
(2)增大压强,使用对反应Ⅱ催化活性更高的催化剂

总之,平衡转化率常定量表示化学反应的限度,但受催化剂的活性温度、副反应发生等因素限制,工业设计时并不无限延长反应时间来追求平衡转化率,而以催化剂"提速"和保证高选择性为双重前提的非平衡态的转化率更有实际意义,这是分析实际生产中的相关转化率问题的基本认知模型。核心素养是在真实任务情境中借助实际问题的分析和解决逐步培育起来的,相信通过教师的精心设计教学,让枯燥的概念与生动的化工实际融合,问题引领、任务驱动,类似转化率等理论性问题会在学生的积极体验、迁移、推理、建模和应用中得到有效解决的。

