替莫唑胺联合放疗对非小细胞肺癌脑转移瘤患者生存期的影响
王晓宏
(河南科技大学第一附属医院放疗科,洛阳 471003)
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌类型的80%,包括腺癌、鳞癌、大细胞癌等,特点是癌细胞生长分裂速度缓慢、扩散转移较晚,75%的患者发现时已至中晚期,早期临床表现为痰血、胸部胀痛、低热、咳嗽等,晚期出现疲乏、体重减轻、呼吸困难等情况,患者5年生存率较低[1-2]。放疗对NSCLC有较好的治疗效果,短期全脑放疗可控制局部病灶进展,但患者长期接受放疗可引发放射性肺炎、放射性脊髓炎等不同程度的不良反应,预后情况通常较差,而未接受完整的放疗方案,易出现局部复发与远处转移的情况。因此,在放疗中通常需要给予药物进行辅助治疗,提升放疗效果。替莫唑胺为抗肿瘤药,可用于放疗中联合治疗与放疗后辅助治疗[3-4]。基于此,本研究探讨莫唑胺联合放疗在NSCLC脑转移瘤患者中的应用效果。现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年5月~2018年2月本院收治的64例NSCLC脑转移瘤患者临床资料,根据治疗方式不同分为对照组(常规治疗联合放疗,32例)与观察组(替莫唑胺联合放疗,32例)。观察组:男性19例,女性13例;年龄47~62岁,平均(54.45±4.84)岁;肿瘤大小2~5 cm,平均肿瘤(3.17±0.29) cm;原发病理:腺癌11例、鳞癌14例、腺鳞癌7例;脑转移瘤个数3~8个,平均(4.82±1.36)个;病理分期:Ⅱb期14例、Ⅲa期9例、Ⅲb期5例、Ⅳ期4例;简易精神状态检查表(mini-mental state examination,MMSE)评分为23~29分,平均(27.27±0.56)分;表皮生长因子受体(epidermal growth factor receptor,EGFR)突变10例,合并颅外转移灶17例。对照组:男性18例,女性14例;年龄49~63岁,平均(54.39±4.79)岁;肿瘤大小2~5 cm,平均肿瘤(3.21±0.24) cm;原发病理:腺癌11例、鳞癌15例、腺鳞癌6例;脑转移瘤个数3~10个,平均(4.95±1.42)个;病理分期:Ⅱb期13例、Ⅲa期9例、Ⅲb期6例、Ⅳ期4例;MMSE评分为24~29分,平均(27.31±0.52)分;EGFR突变8例,合并颅外转移灶16例。统计学对比两组一般资料,差异无统计学意义(P>0.05),具有可对比性。所有患者临床资料均由本院妥善保管且经患者同意翻阅。本研究经本院医学伦理委员会批准。
1.2 入选标准
纳入标准:① 经X线检查、细胞学检查确诊为NSCLC脑转移瘤,且影像学显示至少有1个脑转移灶者。② 血常规检查正常者。③ 卡氏评分(Karnofsky performance status,KPS)>60分者。④ 血小板计数≥100×109/L,中性粒细胞计数≥1.5×109/L,血尿素氮<10.65 mmol/L,男性肌酐<199.5 μmol/L,女性肌酐<159 μmol/L者。
排除标准:① 预计生存期少于3个月者。② 严重肝肾功能障碍者。③ 有颅脑放疗史者。
1.3 方法
所有患者放疗前均检查血常规、尿常规、肝肾功能,无明显异常后接受放疗,放疗期间密切观察各项指标,若出现明显异常,遵医嘱给予适当干预。对照组给予放疗,使用计算机断层扫描术(CT)对脑部进行扫描定位,确定照射范围,6MV X线连续照射,3 Gy/次,5次/周,治疗2周,总剂量30 Gy;同时给予地塞米松磷酸钠注射液(鼎复康药业股份有限公司,国药准字H41020797,规格:1 ml∶5 mg)5 mg与甘露醇注射液(六安华源制药有限公司,国药准字H34020992,规格:100 ml∶20 g)250 ml,静脉滴注,qd,直至放疗结束。观察组在对照组基础上给予替莫唑胺胶囊(北京双鹭药业股份有限公司,国药准字H20110153,规格:20 mg),放疗期间75 mg/m2·d,bid,放疗结束后停药4周再给药,28天为1周期,每服药5天后停药23天,第1周期剂量为150 mg/m2·d,耐受良好者2~6周期可将剂量调整为200 mg/m2·d,共治疗6个周期。两组均给予随访1年。
1.4 评价指标
随访1年后:① 比较两组疗效,参照1979年世界卫生组织(WHO)肿瘤客观疗效[5]评价,完全缓解(complete response,CR):磁共振成像检查病灶完全消失;部分缓解(partial response,PR):病灶体积缩小50%以上;稳定(stable disease,SD):病灶体积缩小25%~50%;进展(progressive disease,PD):病灶体积增大20%,或有新病灶出现。总有效率(%)=(CR例数+PR例数)/总例数×100。② 比较两组生存期,包括总生存时间(overall survival,OS):放疗开始至随访死亡时间或最后随访时间、无进展生存时间(progression-free survival,PFS):放疗开始至患者颅内病灶进展或无进展死亡时间。③ 比较两组治疗前后体质状况变化,参照KPS评分[6]评价,总分0~100分,分数越高表明健康状况越好。④ 比较两组不良反应,包括恶心、头痛、呕吐、骨髓抑制等。
1.5 统计学方法
2 结果
2.1 临床疗效
观察组治疗总有效率(84.38%)高于对照组(62.50%),差异有统计学意义(P<0.05),见表1。
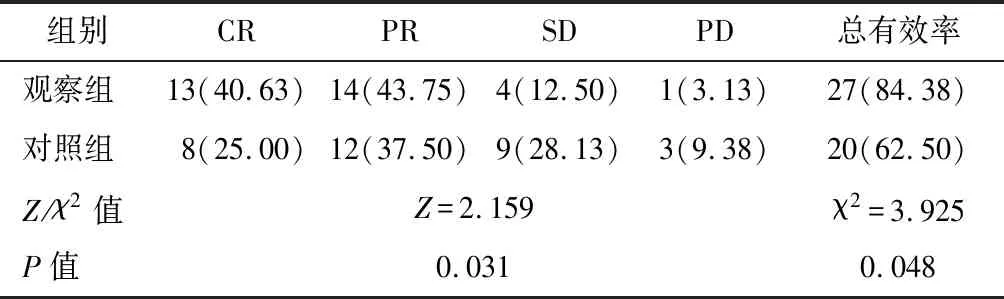
表1 两组临床疗效比较n=32,n(%)
2.2 生存时间
观察组OS与PFS高于对照组,差异有统计学意义(P<0.05),见表2。
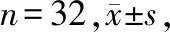
表2 两组患者生存时间对比个月
2.3 体质状况
治疗前,两组KPS评分比较,差异无统计学意义(P>0.05);治疗后,两组KPS评分提升,且观察组KPS评分高于对照组,差异有统计学意义(P<0.05),见表3。
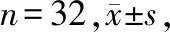
表3 两组体质状况比较分
2.4 不良反应
观察组不良反应发生率(9.38%)低于对照组(31.25%),差异有统计学意义(P<0.05),见表4。
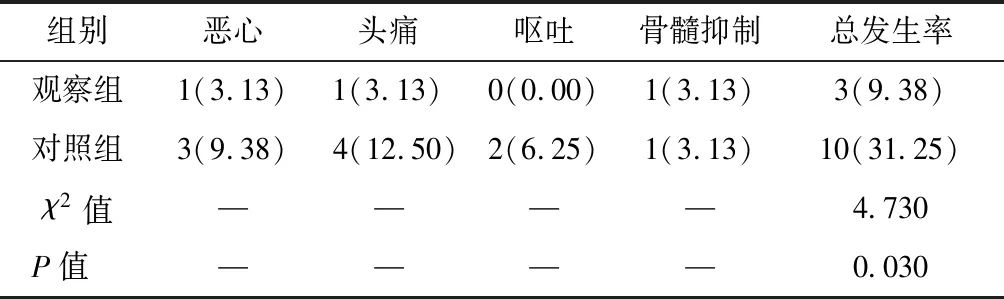
表4 两组不良反应比较n=32,n(%)
3 讨论
NSCLC脑转移瘤是一种较为凶险的疾病,虽然手术治疗是一种直接有效的方法,但对患者身体素质要求较高。若肿瘤体积较大或有转移情况,手术切除难度较大。放疗对患者身体要求较低,不受血脑屏障、原发灶控制情况等限制,是治疗NSCLC脑转移瘤的常用方法,可有效缩小肿瘤面积,缓解神经系统症状。但放疗可对脑部其他正常组织产生影响,发生脑水肿、病灶内组织坏死及血管改变等情况,致使颅内压升高,通常需限制患者摄水量,给予地塞米松、甘露醇等利尿剂干预,减轻不良反应,但放疗对患者生活质量的影响仍值得关注[7-8]。研究显示,放疗同时给予肿瘤抑制药物可延长患者生存期,改善患者体质状况,但肿瘤抑制药物也可产生一定不良反应[9]。因此,选择一种安全性高的辅助治疗药物对NSCLC脑转移瘤患者尤为重要。
替莫唑胺是一种化疗药物,可治疗恶性成胶质细胞瘤,常作为放疗联合用药[10]。本次研究结果显示,观察组治疗总有效率高于对照组,OS与PFS高于对照组,KPS评分高于对照组,不良反应发生率低于对照组,表明替莫唑胺联合放疗可提升临床疗效,延长NSCLC脑转移瘤患者生存期,同时提高其体质状况,控制不良反应发生。分析其原因为替莫唑胺口服后可经胃肠道快速吸收,在生理pH下,自发转换出活性化合物5-(3-甲基三氮烯-1-)咪唑-4-酰胺[5-(3-methyltriazene-1-)imidazole-4-amide,MTIC],MTIC为烷化剂,具有DNA甲基化作用,主要作用于鸟嘌呤O6与N7,其生物利用度高,药动学不受年龄影响,常见不良反应包括骨髓抑制等,但并无累及效应且程度可逆,通过调整用药剂量可有效控制不良反应。单纯的放疗因受照射剂量的限制,并不能充分达到肿瘤致死量,但在放疗期间给予替莫唑胺联合治疗后,可提高局部控制率且放疗可对血脑屏障造成一定破坏,常规化疗药物透过率较低,替莫唑胺相对分子质量小,可轻易穿过血脑屏障,达到充足的药物浓度,在治疗后作为辅助用药,可稳固放疗效果,提升临床疗效,延缓疾病进展,延长患者生存期[11-12]。
综上所述,替莫唑胺联合放疗可提升临床疗效,延长NSCLC脑转移瘤患者生存期,同时可提高其体质状况及较好控制不良反应的发生,值得临床推广应用。

