缺血再灌注损伤介导MRP2 表达下调对DCD 供体肝移植术后胆红素代谢的影响
徐王刚,曾 仲,段 键,黄汉飞,李 珍
(昆明医科大学第一附属医院器官移植科,云南昆明 650032)
肝移植患者于术后早期常出现黄疸,血清总胆红素增高为表现的并发症,其原因与胆红素转运障碍引起胆汁淤积有关[1-2]。胆汁的生成与转运需要线粒体供能,并由位于肝细胞细胞膜及胆细胞膜上的转运蛋白完成转运。如果转运蛋白功能下降或供能出现障碍,就会出现结合胆红素转运障碍,引起高结合胆红素血症。本研究瞄准肝结合胆红素排泌过程中发挥了独特重要作用的转运蛋白—多药耐药 相 关 蛋 白 2(multidrug resistance protein 2,MRP2),采用肝移植患者肝组织,观察MRP2 的表达。肝缺血再灌注导致的氧化应激作用是供肝损伤的主要原因之一[3]。通过研究冷保存和缺血再灌注对MRP2 表达的影响,发现缺血再灌注损伤对肝胆红素排泌系统可能发生的损伤作用。
1 对象与方法
1.1 研究对象
收集昆明医科大学第一附属医院器官移植中心2015 年6 月至2018 年10 月完成的DCD 供体肝移植24 例,其中,男性16 例,女性8 例,年龄21~60 岁,中位年龄38 岁。接受移植的受体原发病分类:14 例为肝炎后肝硬化失代偿期,2 例为酒精性肝硬化失代偿期,6 例为原发性肝癌(BCLC 分期A-B 期)。肝移植供体及受体术前总胆红素值均小于34.4 mmol/L。移植手术方式:背驮式肝移植21 例,经典肝移植3 例。器官热缺血时间在3~5 min,冷缺血时间4~12 h。
1.2 研究方法
(1) 监测移植受者术前术后肝功能情况,包括血清总胆红素(TBIL)、直接胆红素(DBIL) 水平;(2) 取材:供肝在获取后冷保存时及移植术后完成血管吻合开放血流后分别取肝组织活检送病理检查。同时分别在冷保存和开放血流后剪取直径3~4 mm 的组织块,置于2 mL 冻存管,做好标记,置于-70°C 液氮管保存;(3) 光镜组织学检查和电镜肝组织学检查:组织标本经固定、包埋、聚合、半薄切片、光学定位、切片、染色,行光镜及电镜观察;(4) RT-PCR 检测MRP2 基因mRNA 表达: (1) 肝组织总RNA 的提取;(2) 引物设计:参照Genebank 网站的基因系列,采用Primer Premier 软件设计引物,MRP2 引物长度283 bp,内参β-actin 长度318 bp;(4) 逆转录合成cDNA;(5) PCR 反应:94 ℃变性30 s;63 ℃退火30 s;72℃延伸30 s;共循环35 次;(6) PCR 产物结果检测。
1.3 统计学处理
使用SPSS 统计软件,结果以均数±标准差表示,多组间两两比较用卡方检验,两两比较用t检验进行统计处理,以P<0.05 为差异有统计学意义。
2 结果
2.1 胆红素水平监测结果
总胆红素(TBIL) 术后第1 天起,TBIL 较术前明显升高(P=0.01),但随时间推移呈逐渐下降趋势,术后第12 天TBIL 下降至术前水平,见图1。DBIL/TBIL 比值 术前DBIL/TBIL 比值为(41.23±1.81) %,术后1 d DBIL/TBIL 比值升高为(59.25 ±1.87) %,两者比较有统计学差异(P=0.032),见图2。
2.2 光镜下观察移植前(冷缺血) 及移植后(再灌注) 肝组织标本病理切片结果
肝移植前(冷缺血) 光镜观察可见肝窦的扩张及肝细胞发生气球样变性(图3),部分细胞核核固缩、核染色质边聚(图4)。肝移植后(再灌注) 光镜观察见肝细胞肿胀、气球样变性较冷缺血期明显加重,核固缩增加,细胞排列不整齐(图5);肝细胞索呈紊乱排列分布,汇管区可见有大量的炎性细胞浸润,见图6。
2.3 电镜下观察肝移植供肝移植前(冷缺血) 及移植后(再灌注) 肝组织标本
肝移植前(冷缺血) 电镜观察可见染色体在肝细胞的细胞核内出现边聚现象(图7);线粒体排列分布混乱、线粒体体积增大、线粒体嵴减少或消失(图8);肝细胞内发现多形性胆红素颗粒,直径约0.5~2.5 μm(图9);毛细胆管未见异常,毛细胆管内未见胆红素颗粒。肝移植后(再灌注)电镜观察可见细胞器肿胀较移植前加重,线粒体呈气球样改变(图10);细胞核内染色体边聚;细胞内胆红素颗粒较移植前增多(图11);但毛细胆管内仍未见胆红素颗粒,见图12。
2.4 MRP2 在肝移植术前术后mRNA 水平的表达变化
分光光度法测量MRP2 及β-actin 条带灰度值,结合内参β-actin 表达量,了解MRP2mRNA表达情况,统计分析显示:肝移植术后肝组织中MRP2mRNA 表达较肝移植术前明显减少(P<0.001,见图13。
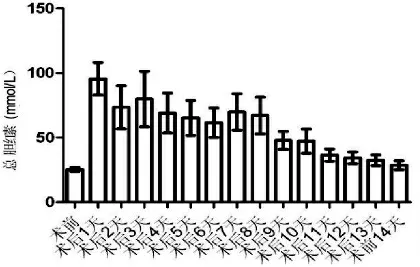
图1 肝移植术前术后胆红素变化趋势Fig.1 Change of bilirubin before and after liver transplantation
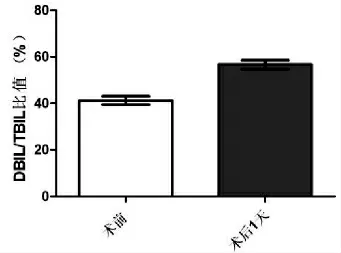
图2 术前术后DBIL/TBIL 比值的比较Fig.2 Comparison of DBIL/TBIL ratio before and after operation
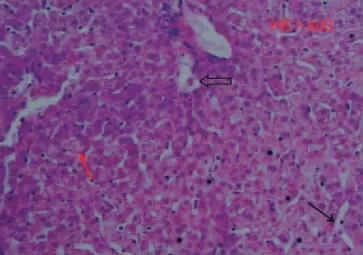
图3 肝窦的扩张(黑箭头) 及肝细胞发生气球样变性(红箭头) (×400 倍)Fig.3 Hepatic sinus expansion (black arrow) and hepatocyte ballooning degeneration (×400倍)
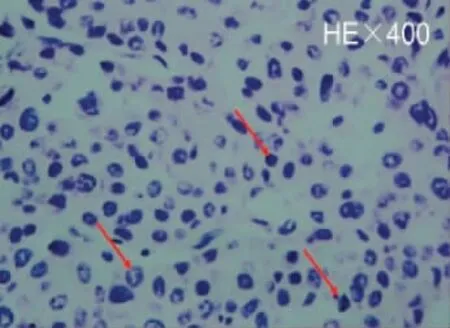
图4 细胞核核固缩(红箭头) (×400 倍)Fig.4 Nuclear condensation (red arrow) (×400 倍)
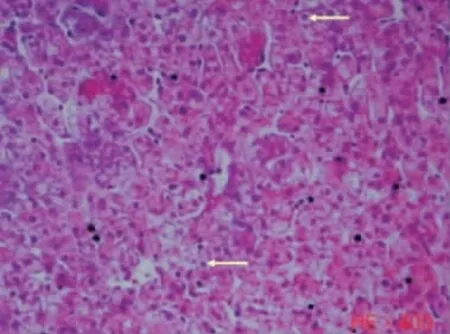
图5 肝细胞气球样变性加重(红箭头) (×400 倍)Fig.5 Aggravation of balloon-like degeneration in hepatocytes (red arrow) (×400 倍)
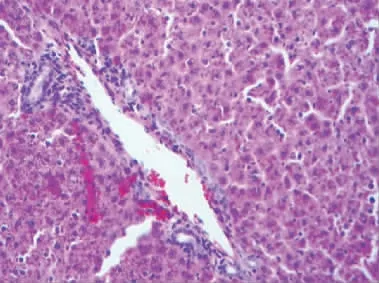
图6 汇管区炎性细胞浸润(×400 倍)Fig.6 Inflammatory cells infiltrate the portal area(×400 倍)

图7 染色体边聚(红箭头) (×10 000 倍)Fig.7 Chromosome edging (red arrow) (×10 000倍)
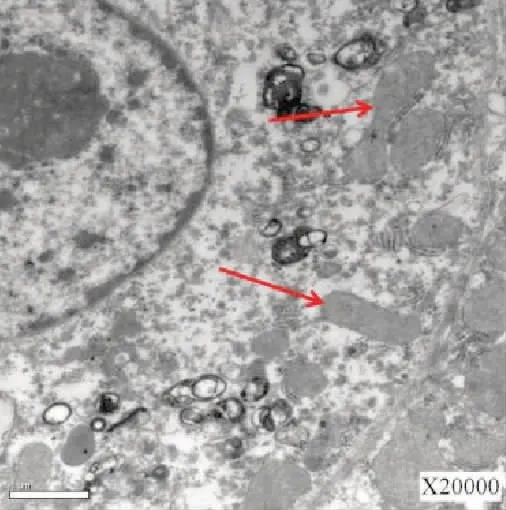
图8 线粒体体积增大(红箭头) (×20 000)Fig.8 Increased mitochondrial volume (red arrow)(×20 000)
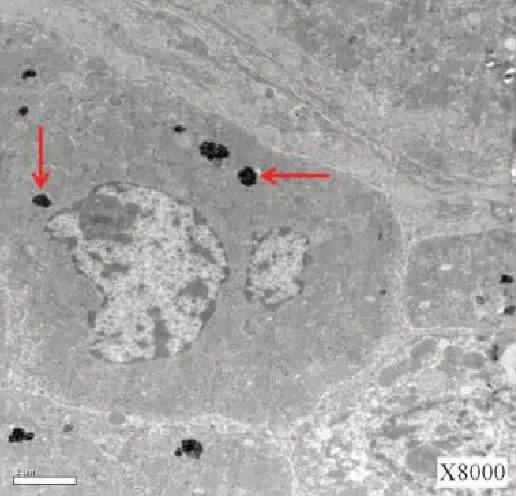
图9 肝细胞内发现胆红素颗粒(红箭头) (×8 000)Fig.9 Bilirubin granules found in hepatocytes (red arrow magnified) (×8 000)

图10 线粒体肿胀加重(红箭头) (×10 000)Fig.10 Increased mitochondria swelling (red arrow magnified) (×10 000)
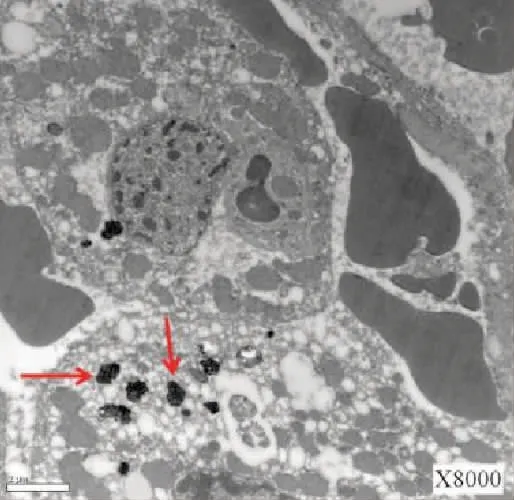
图11 细胞内胆红素颗粒较移植前增多(红箭头) (×8 000)Fig.11 Increased bilirubin particles in cells compared with that before transplantation (red arrow magnified) (×8 000)
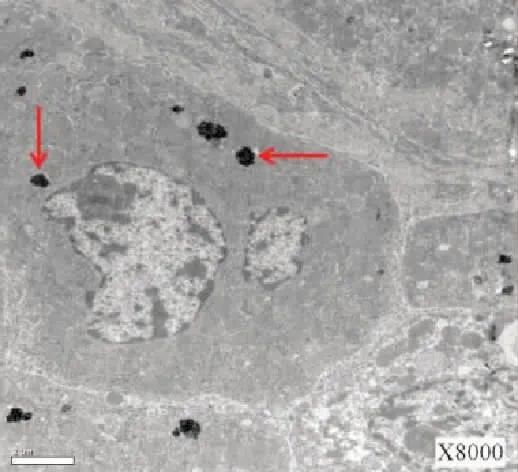
图12 毛细胆管内仍未见胆红素颗粒(红箭头) (×15 000)Fig.12 no bilirubin particles were found in the capillary bile duct (red arrow magnified) (×15 000)
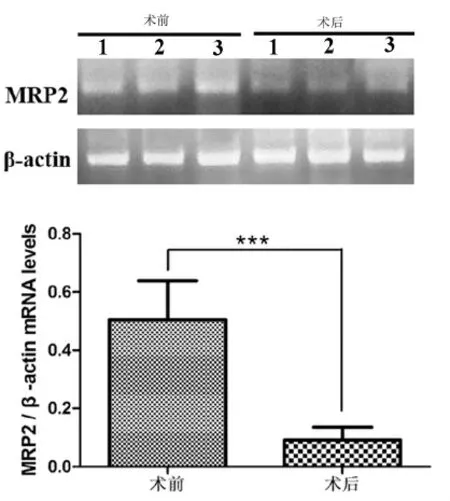
图13 肝移植术前术后mRNA 水平的表达变化Fig.13 Changes in mRNA expression before and after liver transplantation
3 讨论
在肝移植和肝脏手术中,因为肝移植手术过程中存在器官获取和转运,肝脏手术中需要行第一肝门阻断以减少术中出血等原因,肝缺血再灌注损伤是临床上经常发生的一种病理生理变化[4]。对肝缺血再灌注损伤机理的研究一直以来是肝移植和肝胆外科的研究热点问题。目前已知的机理其发病机制主要包括以下几点:细胞凋亡;炎性细胞浸润;微循环障碍;氧自由基生成增加;各种炎性介质释放:例如黏附分子和白三烯;血小板聚集;能量代谢障碍;钙超载;血管活性物产生:例如一氧化氮和内皮素等;Kupffer 细胞激活;反应性氧中间物的产生和释放等[5]。
在笔者的前期研究中已经发现肝移植术后早期出现可出现以直接胆红素的升高为主高胆红素血症[6],以往对肝移植后胆汁瘀积原因的研究主要集中在形态学方面,将其归因于肝缺血再灌损伤后的肝细胞和胆小管结构的改变[7]。但我们在肝移植的临床实践过程中却发现有些患者进行肝移植术后出现明显的选择性胆汁瘀积症,即这种胆汁瘀积仅仅表现为明显的高结合胆红素血症,血胆汁酸及胆固醇水平却保持正常,而这种选择性的高结合胆红素血症不能用肝细胞的溶解和胆小管的形态改变所解释,同时通过各种检查(包括临床生化检测、胆道造影术、超声检查、CT 扫描以及肝穿刺活检等)排除了急性移植物排斥反应、大块肝坏死及胆道并发症。国外的研究也表明,肝移植术后供肝组织肝中央静脉周围的肝细胞明显瘀胆,而非急性移植物排斥反应所引起[7-8]。
胆汁的生成与转运需要线粒体供能,并由位于肝细胞细胞膜及胆细胞膜上的转运蛋白完成转运,肝细胞小管膜(顶膜) 中包含一系列转运蛋白,这些小管转运蛋白能逆浓度梯度转运内生性和外源性代谢产物,穿过肝细胞小管膜排泄至胆小管的胆汁中[9]。如果转运蛋白功能下降或供能出现障碍,就会出现结合胆红素转运障碍,引起高结合胆红素血症。MRP2 介导了多特异性结合型有机阴离子的排泄分泌,特别是结合型胆红素的排泄分泌,它是唯一将结合型胆红素从肝细胞内转运至毛细胆管内的转运蛋白[10-11]。经以往研究发现MRP2 基因的表达水平与血清总胆红素呈负相关[12]。缺血再灌注损伤导致线粒体损伤,引起能量代谢障碍,在本实验中我们发现冷缺血期线粒体发生肿胀,在再灌注期线粒体损伤进一步加重,因此我们推测缺血再灌注损伤引起肝细胞线粒体功能障碍,导致MRP2蛋白功能下降,从而引起胆红素从肝细胞内至胆小管的转运出现障碍,引起术后的高胆红素血症。
在本研究中,通过镜下观察,笔者发现冷缺血时供肝细胞的浊肿、肝窦的扩张,线粒体肿胀,嵴减少,排列紊乱,细胞核内染色体边聚;肝细胞内出现胆红素颗粒,毛细胆管内未出现胆红素颗粒。这些都提示肝细胞缺血缺氧后出现细胞功能的障碍及肝细胞内的胆红素聚集。再灌注后细胞损伤进一步加重,肝细胞内胆红素颗粒增加,提示有胆红素转运障碍加重。通过荧光RT-PCR 法定量测定移植前后MRP2mRNA 的表达,发现与术前比较术后MRP2mRNA 表达明显下调,结合肝脏组织检查结果可知肝脏缺血再灌注损伤与肝脏中MRP2 表达呈负相关。
综上所述,笔者认为:MRP2 作为胆红素转运载体的表达降低是引起肝移植术后高胆红素血症的重要原因之一。缺血再灌注损伤引起肝细胞功能障碍,导致主要的胆红素转运蛋白-MRP2 的表达下降,从而引发胆红素的转运障碍,这可能是引起肝移植术后发生高胆红素血症的重要原因之。

