趋化因子受体CX3CR1 基因V249I 多态性在云南彝族人群中的分布
杨 钰 ,杨靖宜,陈志彬,陈灿昆,范志祥,张延洁,张 璐,万瑞雪,龙 莉
(1) 昆明医科大学,云南昆明 650031;2) 昆明医科大学细胞生物学与医学遗传学系,云南昆明 650500;3) 昆明医科大学第一附属医院遗传科,云南昆明 650101)
CX3CR1为G-蛋白偶联受体,须与Fractalkine(Fkn) 相结合方可发挥生物学作用,导致炎症发生。CX3CR1 基因共含1065 个核苷酸,可编码355 个氨基酸,位于3p21 -3pter[1]。McDemott 等[2]发现其跨膜结构区共有5 个单核苷酸多态位点(SNP),而V249I 多态位点就是其中之一。V249I 多态性是指位于CX3CR1 基因第二外显子上的745 位点碱基发生G→A 突变,使得相应的密码子由缬氨酸(V) 转为异亮氨酸(I)[3]。V249I(G→A) 多态位点位于CX3CR1 基因编码区,故其可影响蛋白质翻译,从而影响受体功能[4]。V249I突变影响炎症进程中白细胞尤其是吞噬细胞、淋巴细胞的游走与活化并介导细胞间黏附聚集等作用,甚至可能影响疾病遗传易感性[5]。现已发现V249I 多态与多种炎症性疾病和某些传染性疾病的发生发展相关[6],但其机制目前为止尚未完全明确。本文着力于研究、描述云南省晋宁县彝族健康人群CX3CR1 基因V249I 位点多态分布情况及其与国内外不同种族及不同民族之间的差异,为探索CX3CR1 基因相关疾病分子机制提供理论依据。
1 资料与方法
1.1 研究对象
昆明市晋宁县双河彝族乡彝族健康村民共245人,其中男性82 例,女性163 例,平均年龄(60.2±12.1) 岁;经病史调查、体检报告、实验室检查等资料将高血压、冠心病、心肌病、先天性心脏病和瓣膜性心脏病患者排除在外。本研究已通过伦理道德审查且所有对象对调查、取样项目知情同意。
1.2 研究方法
1.2.1 基因组DNA 提取抽取静脉血2 mL 后采用EDTA 抗凝,使白细胞分离,低渗溶血,酚-氯仿有机抽提法提取基因组DNA,TE 缓冲液溶解,4℃冰箱储存。
1.2.2 目的片段的PCR 扩增采用PCR 技术特异性扩增CX3CR1 基因的一段包含V249I 位点的DNA 引物序列。上游引物为:5'-CCGAGGTCCTCCAGGAAATCT-3';下游引物为5'-TCAGCATC AGGTTCAGGAACTC-3';30 μL PCR反应体系包含:正反引物各1.3 μL,TaqDNA 聚合酶15 μL(北京擎科新业生物技术有限公司),双蒸水(ddH2O) 11.4 μL,DNA 样本1 μL。PCR 反应条件如下:94℃预变性4 min,94℃变性30 s,58℃退火40 s,72 ℃延伸55 s,循环35 次;于72 ℃延伸10 min。
1.2.3 基因型鉴别采用RFLP 法检测基因型。酶切体系共18 μL:PCR 扩增产物6 μL,0.5 μL 限制性内切酶Acl I(Bio Basic 公司),双蒸水(ddH2O)8.8 μL,10×Buffer2.7 μL,37℃孵育过夜(24~36 h)。反应终止后将消化片段于2.5%琼脂糖凝胶上电泳(添加Goldview-I 型核酸染色剂),凝胶成像系统判断酶切结果。
1.3 统计学处理
数据处理采用SPSS 软件。χ2检验分析基因型及等位基因频率,且检验Hardy-Weinberg 平衡定律,P<0.05 为差异有统计学意义。
2 结果
2.1 Hardy-Weinberg 平衡检测
分析结果为χ2=3.286,P=0.279,说明CX3CR1 基因 V249I 位点多态性分布符合Hardy-Weinberg 遗传平衡定律,即所选用的人群样本具有群体代表性,结果具有说服力。
2.2 基因型鉴定
PCR 扩增产物片段大小为588 bp。该片段用限制性内切酶Acl I 进行酶切时,若CX3CR1 基因745 位点没发生突变,编码的氨基酸为G,则扩增产物被Acl I 切开会产生205 bp、383 bp 二个片段;若745 位点的G 被A 替代,编码的氨基酸变为I,原有的Acl I 酶切位点消失,Acl I 无法切开,即长度不变。酶切后产生2 个等位基因V、I,形成3种基因型:II:只产生588 bp 一个片段(无突变纯合子) VV:产生205 bp、383 bp 二个片段(突变杂合子);VI:产生588 bp、383 bp 和205 bp 三个片段(突变杂合子),见图1。

图1 CX3CR1 基因V249I 多态性3 种基因型凝胶电泳图Fig.1 Three genotype of CX3CR1 gene V249I polymorphism were showed by agarose electrophoresis image
2.3 V249I 多态性在云南彝族人群中的分布
昆明市晋宁县双河乡245 例彝族健康人群中,CX3CR1 基因249I 位点有VV、VI、II 三种基因型,其基因型频率分别为86.53%、12.25%、1.22%;V、I 等位基因频率分别为92.65%和7.35%。在男性中,基因型频率为VV(91.46%)、VI(7.32%)、II(1.22%);V、I 等位基因频率分别为95.12%、4.88%。在女性中,基因型频率为VV(84.05%)、VI(14.72%)、II(1.23%);V、I等位基因频率则分别为91.41%、8.59%。经过比较,在不同性别中该位点的多态性分布无显著差异(基因型为χ2=2.791,P=0.248;等位基因为χ2=2.207,P=0.137),见表1。
2.4 CX3CR1 基因V249I 多态性分布与其它文献报道的比较
现将国内外报道的不同种族或民族人群CX3CR1 基因位点多态性分布的研究结果与本研究进行比较,结果显示:云南彝族健康人群中V249I多态性位点以VV 型为主,日本人、傣族人、景颇族人、汉族人、新疆汉族人、湖南汉族人、包头汉族人群缺少II 基因型。云南彝族与报道的日本人[7]、法国人[8]、意大利人[9]、高加索人[10]、希腊人[11]、印度[12]人、塞尔维亚人[13]、维吾尔族人[14]、新疆汉族人[14]、汉族人[15]比较,其CX3CR1 基因型分布与基因频率差异均有统计学意义(P<0.05)。与景颇族人[16]、傣族人[16]、湖南汉族人[17]、包头汉族人[18]相比无论从基因型分布或是基因频率均无统计学差异(P>0.05)。
云南彝族人群VV 基因型频率为86.53%,显著高于已报道的维吾尔族人(72.45%)、塞尔维亚人(62.60%)、意大利人(52.94%)、希腊人(52.12%)、高加索人(50.60%)、法国人(50.32%)、印度人(50.00%),P<0.05;但显著低于新疆汉族人(95.74%)、汉族人(95.24%)、日本人(91.83%),P<0.05;云南彝族人群VI 基因型频率为12.25%,高于汉族人(4.76%)、新疆汉族人(4.26%),P<0.05;同时低于法国人(43.34%)、高加索人(41.77%)、意大利人(41.18%)、印度人(39.33%)、希腊人(35.76%)、塞尔维亚人(32.47%) 和维吾尔族人(23.47%)(P<0.05);云南彝族人群II 基因型频率为1.22%,显著低于希腊人(12.12%)、印度人(10.67%)、高加索人(7.63%)、法国人(6.34%)、意大利(5.88%)、塞尔维亚人(4.30%),P<0.05。
云南彝族人群V 等位基因频率为92.65%,显著高于维吾尔族人(84.18%)、塞尔维亚人(78.83%)、意大利人(73.53%)、法国人(71.96%)、高加索人(71.49%)、希腊人(70.0%)和印度人(69.69%),P<0.01;低于新疆汉族人(97.87%) 和汉族人 (97.60%)、日本人(95.92%),P<0.01。云南彝族人群I 等位基因频率为7.35%,低于印度人(30.31%)、希腊人(30.00%)、塞尔维亚人(21.17%)、高加索人(28.51%)、法国人(28.04%)、意大利人(26.47%) 和维吾尔族人(15.82%),P<0.01,但高于日本人(4.08%)、汉族人(2.40%) 和新疆汉族人(2.13%),P<0.01,与其他民族比较差异无统计学意义(P>0.05),见表2。

表1 彝族CXC3R1 基因V/I 多态性的分布[n(%)]Tab.1 Distribution of CX3CR1 gene V249I polymorphism in Yi nationality population [n(%)]
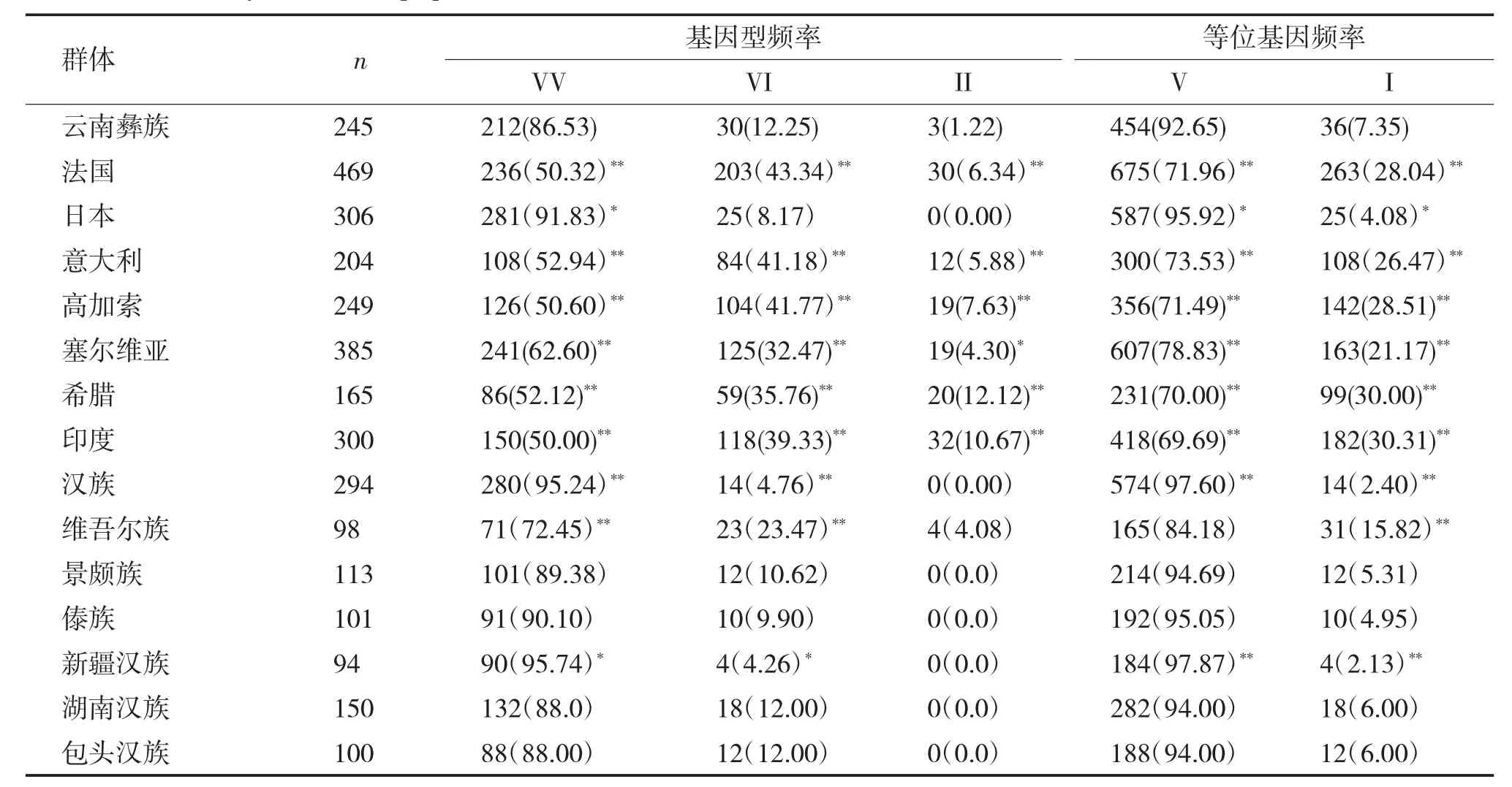
表2 不同人群CXC3R1 基因V249I 多态性基因型频率和等位基因频率[n(%)]Tab.2 Genotype frequency and gene frequency of CX3CR1 gene V249I polymorphism comparison between Yi nationality and other populations [n(%)]
3 讨论
Fkn 是CX3C 趋化因子家族中独特的促炎因子,以可溶性和膜结合形式存在,主要由大脑、心脏及外周血管内皮细胞表达。其特异性受体CX3CR1 存在于单核细胞、NK 细胞、T 细胞膜上,两者之间相互作用可导致炎症发生[19]。现已发现CX3CR1 基因V249I 多态性与某些传染性疾病以及多种炎性疾病的发生发展相关。朱阿楠[20]等发现V249I 突变对Fkn 趋化活性、结合率均下降,并减缓糖尿病肾病(DN) 进程。例如Combadiere 等[21]发现CX3CR1 基因V249I 多态性与年龄相关性黄斑变性(AMD) 相关。Moatti 等[22]发现CX3CRl 上只有I 等位基因可用于预测评估急性冠状动脉综合征的发病风险,说明Fkn 分子与血管性疾病有相关性;正如李文龙等[23]的研究显示:冠状动脉硬化性疾病(CAD) 患者的V249I 频率较低,即推测V249I 多态是CAD 的保护性因素。近年有研究发现V249I 多态可能为缺血性脑血管病(ICVD) 的遗传易感因素[24],且体外试验证实V249I 多态性还在肾小球肾炎发病中起作用[25]。但CX3CR1 基因V249I 多态与疾病的关系,在不同的民族或种族中,可能会得出不同的结论。如刘明旭等[14]检测到V249I 多态性可能与新疆维吾尔人群中HIV-1 易感性有关;而邓小玲等[26]却推测四川彝族人群HIV-1 感染者与正常人中V249I 多态分布无显著差异。这可能是由于不同民族遗传背景不同导致对疾病易感性存在差异。除了上述慢性病外,最近的研究提示V249I 多态性还与肿瘤的发生过程相关[27];瘤内CX3CL1-CX3CR1 信号被证明直接影响胶质瘤的侵袭和粘连行为,V249I 多态性提高胶质瘤患者术后的总存活率,减少TAM 浸润。
云南彝族与其他民族和种族具有不同的遗传背景,如龙莉等[28-33]发现M235T、T280M 等多种基因的多个多态位点在云南彝族与其他民族或种族中的分布均有显著差异。但目前国内外对于云南彝族CX3CR1 基因V249I 位点多态性的研究较少,对云南彝族进行基因层面的研究可为目前提倡精准医疗,个体化医疗方案提供一定证据。本研究对部分已报道种族、民族CX3CR1 基因V249I 多态性分布进行收集、描述统计,结果显示:云南彝族与报道的日本人、法国人、意大利人、高加索人、希腊人、印度人、塞尔维亚人、维吾尔族、汉族、新疆汉族比较,V249I 基因型分布与基因频率差异均有统计学意义(P<0.05)。这说明在不同地域、不同种族的健康人群中,V249I 基因型及其等位基因频率分布存在差异,其中以不同种族之间的差异更为显著。
以上国内外研究进展与结果都提示趋化因子受体CX3CR1 在炎性疾病、AMD 与AIDS 等疾病进程中发挥重要作用,而V249I 多态性很大程度上影响着CX3CR1 的表达。各种族与民族遗传背景的不同使得其疾病发生与发展可能存在差异,通过研究人类基因多态性,可掌握基因在不同人群中的分布状况,从基因水平对疾病在不同民族、种族中表现的易感性、发病率差异的潜在机制进行初步探索。此外,开展多地区、大样本的研究并对CX3CR1 的其他多态位点进行筛查,有助于明确CX3CR1 基因多态性在疾病发生发展中的作用,为疾病排查、治疗提供新的靶点。

