老年2型糖尿病患者肠道菌群的相关性研究
黄林林 郭静霞 杨永刚 张拥军 于华
随着社会人口老龄化的发展,老年2型糖尿病(T2DM) 患病逐年增加。有研究表明肠道菌群失调可引起细菌释放内毒素,引起机体慢性炎症状态长期存在,慢性炎症可引起胰岛素抵抗,继而发生糖尿病[1-3]。本试验通过对老年T2DM 患者中肠道菌群与炎性因子、胰岛素抵抗的相关性研究,探讨肠道菌群与糖尿病发生发展的相关性。
1 资料与方法
1.1 一般资料 收集2017年3月至2018年12月在石家庄市人民医院老年病科住院的 80 例老年患者作为研究对象,均诊断为 T2DM[4];另选取同期80例健康体检者为对照组。所有入组人员年龄>60岁,在之前2个月内均未使用过抗生素、乳果糖、微生物活菌制剂等。排除标准:1型糖尿病;急慢性胃肠道疾病;胃肠道手术史;长期使用激素、抗菌药物、免疫抑制剂的患者。
1.2 血清临床指标、HOMA-IR、炎性因子的测定 患者均过夜空腹抽静脉血,采用全自动生化仪测定生化指标:总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。 采用葡萄糖氧化酶法测空腹血糖(FPG),另取静脉血 2~3 ml静置1 h后,3 000 r/min 离心5 min,测定血清空腹胰岛素(FINS)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)。 采用放免分析法测定FINS,采用酶联免疫吸附法检测血清 IL-6和TNF-α,采用美国 Bio READ550酶标仪测量,试验操作按照说明书进行,试剂由深圳晶美生物技术公司提供。胰岛素抵抗状态采用稳态模型评估法判断,计算 HOMA-IR。
1.3 肠道菌群的测定 取新鲜粪便3~5 g,置于无菌干燥采便器内,30 min内送检。称取送检的粪便1.0 g,用灭菌稀释液倍比稀释至10-8cfu/ml,制成均匀悬液,用“L”棒均匀涂抹于不同的培养基上,对目标菌进行定量、定性检测[5]。
2 结果
2.1 2组患者一般资料比较 2组患者年龄、体重指数(body mass index,BMI)、血脂等比较,差异均无统计学意义(P>0.05)。见表1。
表1 2组患者一般资料比较
2.2 2组患者血清HOMA-IR、炎性因子比较 T2DM 组患者的空腹血糖、空腹胰岛素、胰岛素抵抗指数、炎性因子IL-6和TNF-α的水平均高于对照组,差异有统计学意义(P均<0.05)。见表2。
表2 2组患者血清HOMA-IR、炎性因子比较
2.3 2组患者肠道菌群比较 T2DM 组肠球菌、肠杆菌均高于对照组,双歧杆菌、乳酸杆菌和双歧杆菌/大肠杆菌的比值均低于对照组,差异有统计学意义(P均<0.05)。见表3。

表3 2组患者肠道菌群比较
2.4 肠道菌群与HOMA-IR、炎性因子的相关性分析 肠球菌、肠杆菌与IL-6、TNF-α和HOMA-IR是正相关(P<0.05),双歧杆菌、乳酸杆菌和双歧杆菌/大肠杆菌的比值与IL-6、TNF-α和HOMA-IR呈负相关(P<0.05)。见表4。
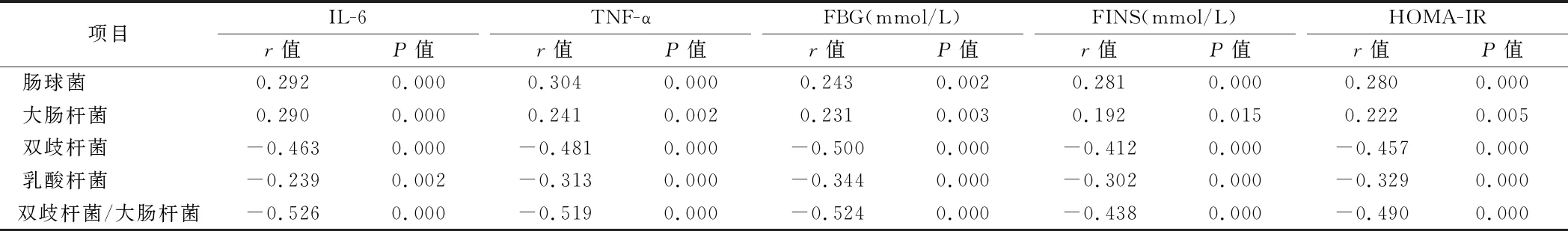
表4 肠道菌群与HOMA-IR、炎性因子的相关性分析
3 讨论
人类的肠道不仅具有消化、吸收功能,同时有内分泌和免疫调节功能,肠道菌群与其宿主之间有很复杂的动态平衡关系,对保持机体健康状态至关重要。研究表明,2型糖尿病等代谢疾病与肠道菌群有密切关系[5-7]。老年患者肠道的生理机能逐渐减退,肠道内微生物也发生变化,其种类及数量的改变与代谢性疾病的发生发展相关,菌群结构的改变主要表现在拟杆菌的比例增高[8]。双歧杆菌和乳杆菌是人体肠道中最重要的益生菌,在维持肠道菌群平衡中起了重要作用,其中反应肠道定植抗力的一个指标是双歧杆菌与肠杆菌数量之比(B/E值)。本研究显示老年T2DM组肠球菌、肠杆菌数量较对照组明显升高,双歧杆菌、乳酸杆菌和双歧杆菌/大肠杆菌的比值较对照组明显降低。
人类的肠道微生物数量可达1 014个,根据微生物对宿主的作用将其分为有益菌、双向菌和有害菌3种,其中益生菌>99.0%[9]。常见的有益菌包括乳酸杆菌、双歧杆菌等。在机体防御能力正常时,双向菌对人体无害,但当肠道菌群的种类及数量发生变化时,原本不会损害健康的细菌可成为致病菌[10]。一般情况下,肠道细菌的结构及数量在一个相对的平衡状态,与人体互利共生达到健康平衡状态,从而维持正常的生理功能等。在一些因素影响下,如:药物、年龄、饮食等,都会导致肠道菌群的改变,益生菌减少,致病菌增加,机体代谢紊乱,发生多种疾病[11]。研究表明,肠道菌群结构的变化与代谢综合征、肥胖、2型糖尿病等疾病有着千丝万缕的关系,在能量代谢及体重控制控制方面发挥着重要作用,类杆菌含量降低、肠杆菌科细菌含量增多导致肠道菌群失调[12]。双歧杆菌在肠道菌群中特别重要是因为它可以预防和治疗肠道菌群失调相关性的疾病,可促进肠道益生菌生长繁殖,改善肠道环境。很多种代谢性疾病与肠道菌群失调有关,其中双歧杆菌减少至关重要[13]。
研究表明,由高脂饮食引起肠道菌群比例的改变,激活了肠道炎症机制,导致代谢失调[14]。Amar等[15]研究发现胰岛素抵抗与肠道菌群失调有关,内毒素(LPS) 是其中重要因素。相互作用的脂多糖与细胞膜上的 CD14/TLR4 受体复合体释放较多的炎性介质,比如IL-1、IL-6、TNF-α,机体出现慢性炎症,慢性炎症导致胰岛素功能下降,从而发生糖尿病[16,17]。肠道内分泌细胞还释放多种激素[18-20],可以对控饮食的消化功能作用外,还可影响上皮完整性、黏膜耐受性及系统性炎症的调节功能。Cani 等[21]研究发现,在大鼠体内发现机体炎性反应引起胰岛素抵抗,抗生素的治疗改变了肠道菌群的结构及数量,可以减少血浆 LPS 的含量,说明通过改变肠道菌群可以影响 DM 的发生。还有一些动物实验证实,通过肠道菌群的接种,可以使得无菌小鼠体脂水平的明显增加,出现与肥胖小鼠相同的特征,说明肠道菌群可以影响小鼠的食欲,导致其肥胖; 对肥胖小鼠的基因测序发现,肥胖小鼠的肠道菌群中有更多对能力贮存有重要作用的基因,这些基因参与能量代谢。通过对16S核糖体RNA 基因测序,发现肥胖小鼠中拟杆菌门数量较低,厚壁菌门细菌较多[18-22]。与动物实验相同的细菌门类变化趋势在肥胖人群和非肥胖人群中同样出现[22,23]。T2DM 患者相对于正常人,肠道菌群也有不同程度肠种类和数量的异常。有研究通过比较T2DM 组和非T2DM 组发现,T2DM 患者肠道内变形菌门的沙门菌、大肠埃希菌等病原菌数量增高,并且与血糖浓度相关[24]。
本研究中通过对老年T2DM 患者肠道菌群、炎性因子和胰岛素抵抗的研究,探讨肠道菌群与糖尿病发生发展的关系。在T2DM 组中空腹血糖、空腹胰岛素、胰岛素抵抗指数、炎性因子IL-6和TNF-α的水平均明显比对照组高,IL-6、TNF-α和HOMA-IR与肠球菌、肠杆菌具有正相关性,IL-6、TNF-α和HOMA-IR与双歧杆菌、乳酸杆菌和双歧杆菌/大肠杆菌的比值具有负相关性。其机制可能为肠道菌群紊乱导致炎性因子增多,从而出现胰岛素抵抗,参与了T2DM 的进展[25]。
肠道肠道受损,会导致肠道菌群的种类及数量发生变化,大量毒素被肠道吸收,机体炎性介质的释放明显增多,免疫细胞如中性粒细胞、巨噬细胞、自然杀伤细胞等释放炎性因子[26]。胰岛素抵抗及糖代谢紊乱均与炎性因子密切相关[27]。炎性因子的升高通常不引起明显的炎性反应,一般表现位慢性炎性反应,单核巨噬细胞激活,释放促炎因子[28]。胰岛素的信号转导通路被影响,使胰岛素抵抗发生[29]。在糖尿病中胰岛素抵抗是重要发病机制,在T2DM 患者中,往往有不同程度胰岛素抵抗。另外,肠道菌群的抗原成分多糖,能够使机体出现免疫反应,其机制是通过M细胞诱导局部和全身性免疫反应发生[30,31]。Shen 等[32]研究证实在糖尿病患者中,肠道的双歧杆菌水平和胰岛素水平具有正相关性,能够降低炎性因子水平,从而减轻机体胰岛素抵抗。
综上所述,在老年T2DM 患者中,肠道菌群、炎性因子和胰岛素抵抗指数都发生明显变化,且肠道菌群与炎性因子及糖尿病的胰岛素抵抗指数具有相关性,从而推测出肠道菌群紊乱,可能导致炎性因子释放的增多,从而使机体出现胰岛素抵抗,进而出现糖尿病,其具体机制仍需进一步研究。

