右美托咪定在危重高血压脑出血患者开颅术后的应用研究
宋春旺 田军 李国英 雷国亮 左书浩 宋贺
高血压脑出血(hypertensive intracerebral hemorrhage,HICH)是严重威胁人类健康的出血性脑卒中[1,2]。对于形成脑疝的危重高血压脑出血患者,常规采用开颅血肿清除术,清除颅内血肿,降低颅内压力,达到挽救生命和改善预后的效果[3]。同时,早期颅内出血和治疗中的开颅手术均为刺激损害性事件,可导致神经体液调节功能紊乱,引发交感神经兴奋,造成缺血缺氧性脑损害。右美托咪定为α受体激动剂,能够抑制去甲肾上腺素释放,达到镇静、镇痛及减轻应激反应的效果,减轻脑组织损害[4]。目前对于麻对于术后继续使用右美托咪定是否提高脑功能的研究较少。本研究探讨术后继续使用右美托咪定对危重症高血压脑出血患者开颅术后颅内压、脑氧、脑糖、脑脊液及血流动力学的影响。
1 资料与方法
1.1 一般资料 选取我院2016年12月至2018年12月收治的危重高血压基底节区脑出血患者80例,按照随机单盲法分为试验组和对照组,每组40例。试验组:男24例,女16例;年龄34~72岁,平均年龄(48.3±6.7)岁。对照组:男22例,女18例;年龄32~74岁,平均年龄(50.5±8.3)岁。本组研究病例均为首次颅内出血,且符合第四届全国脑血管学术会议制定的高血压脑出血病诊断标准[5],并符合以下要求:(1)患者发病3 h内入院,经头部CT检查证实基底节区血肿,并于入院后3 h内实施手术;(2)血肿量60~120 ml,头部CT提示中线移位>1 cm;(3)格拉斯哥评分(glasgow coma scal,GCS)<8分;(4)双侧瞳孔不等大;(5)年龄18~80岁;(6)患者家属同意并且签署知情同意书。排除标准:(1)长期口服抗凝药物或具有凝血系统的疾病;(2)既往有神经功能障碍者;(3)既往有严重心肺功能障碍患者;(4)双侧瞳孔散大;(5)长期使用镇静镇痛药物。2组患者的性别比、年龄、平均动脉压(MAP)、颅内血肿量、血糖、血红蛋白(Hb)、纤维蛋白原、D-二聚体、GCS差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。见表1。
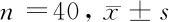
表1 2组患者一般资料比较
1.2 方法 2组患者均常规术前准备和全身麻醉下急诊行开颅血肿清除术,且每次手术均由同组手术医生和麻醉医师完成。麻醉诱导前10 min内负荷量静脉注射1.0 μg/kg右美托咪定(四川国瑞药业有限责任公司,规格:2 ml∶0.2 mg),再使用异丙酚1.0~1.5 mg/kg、瑞芬太尼 2 μg/kg及阿曲库铵1 mg/kg麻醉诱导后进行气管插管,调整呼吸机参数,维持呼气末二氧化碳分压(end-tidal carbon dioxide pressure,PetCO2)在30~35 mm Hg。麻醉维持采用1%~3%七氟醚吸入(视BIS值调节),异丙酚4~6 mg·kg-1·h-1、瑞芬太尼0.05~0.30 μg·kg-1·h-1、阿曲库铵0.5 mg·kg-1·h-1静脉泵入,维持脑电双频指数(bispectral index,BIS)于40~60。同时,2组均于术中采用右美托咪定术中以0.5 μg·kg-1·h-1速度静脉泵入,术中穿刺开颅侧侧脑室留置颅内压探头合并脑脊液外引流管(Codman 颅内压监测仪,Johnson公司,美国),方便监测颅内压和留取脑脊液标本。术后患者均送入神经ICU常规生命支持治疗,且术后试验组采用右美托咪定以0.2 μg·kg-1·h-1速度静脉泵入至术后24 h。
1.3 观察指标
1.3.1 血流动力学变化:术后即刻(0 h)、12 h、24 h、72 h记录心率(heart rate,HR)、MAP、动脉血氧饱和度(pulse oxygen saturation,SpO2)。
1.3.2 脑氧代谢和脑糖代谢变化:采用Seldinger法在颈内静脉逆行穿刺置管术留置颈内静脉导管,便于抽取颈内静脉球部静脉血。桡动脉穿刺留置导管,便于抽取桡动脉部动脉血。分别在术后即刻(0 h)、12 h、24 h、72 h采集颈静脉球部血液和桡动脉血液各3 ml,并检测颈静脉球部血氧饱和度(blood oxygen saturation of jugular vein bulb,SjvO2)、颈内静脉血氧分压(jugular venous oxygen pressure,PjvO2)、脑动静脉血氧含量差(arteriovenous oxygen content diference,A-VDO2)、脑动静脉血糖含量差(arteriovenous glucose content diference,A-VDG)、动脉血氧分压(arterial oxygen pressure,PaO2)、动脉氧饱和度(arterial oxygen saturation,SaO2)、脑氧摄取率(cerebral O2extraction rate,CERO2)。A-VDO2=Hb×1.39×(SaO2-SjvO2)+0.003×(PaO2-PjvO2)。CERO2=A-VDO2/CaO2×100%。动脉血氧含量(CaO2)=Hb×1.39×SaO2+0.003×PaO2。
1.3.3 颅内压变化:术后即刻(0 h)、12 h、24 h、72 h记录颅内压(intraeranial pressure,ICP),并以术后即刻(0 h)颅内压为基线,计算不同时刻颅内压增量(Increase of intracranial pressure,I-ICP),I-ICPn=ICPn-ICP0。
1.3.4 脑脊液氨基酸变化:术后即刻(0 h)、12 h、24 h、72 h留取脑脊液标本,以高效液相色谱法测定并记录相应时间点的脑脊液中抑制性氨基酸γ-氨基丁酸(inhibitory amino acid γ-aminobutyric acid,GABA)、谷氨酸(glutamic acid,Glu)水平,并以术后即刻(0 h)脑脊液中GABA和Glu含量为基线,计算术后不同时刻GABA和Glu增量,其中GABA增量(I-GABAn)=GABAn-GABA0。Glu增量(I-Glun)=Glun-Glu0。
2 结果
2.1 2组患者术后血流动力学比较 2组患者术后不同时间点,试验组在术后即刻(0 h)、12 h、24 h、72 h的HR、MAP均低于对照组,差异有统计学意义(P<0.05)。2组患者术后不同时间点的SpO2相比,差异无统计学意义(P>0.05)。见表2。
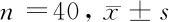
表2 2组患者术后血流动力学指标比较
2.2 2组患者术后脑氧和脑糖代谢比较 2组患者术后即刻(0 h)CERO2和A-VDG差异无统计学意义(P>0.05)。与术后即刻(0 h)CERO2相比,术后12 h、24 h、72 h时,2组患者的CERO2均下降,差异均有统计学意义(P<0.05)。术后12 h、24 h、72 h试验组CERO2均小于对照组,A-VDG均大于对照组,2组间差异均有统计学意义(P<0.05)。见表3。
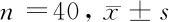
表3 2组患者术后脑氧和脑糖代谢指标比较
2.3 2组患者术后颅内压变化情况比较 2组患者术后即刻(0 h)ICP0差异无统计学意义(P>0.05);术后12 h、24 h、72 h试验组I-ICPn均小于对照组,差异有统计学意义(P<0.05)。见表4。
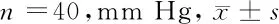
表4 2组患者术后I-ICP比较
2.4 2组患者术后脑脊液指标比较 2组患者术后即刻(0 h)脑脊液中GABA和Glu含量差异无统计学意义,术后12 h、24 h、72 h试验组I-GABA均高于对照组,I-Glu均小于对照组(P<0.05)。见表5。
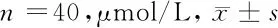
表5 2组患者术后脑脊液中I-GABA和I-Glu比较
3 讨论
高血压脑出血近年来发病率呈增长趋势,它的主要危害在于脑出血后血液对周围脑组织的直接压迫作用和血液及其代谢产物对神经细胞及血管的刺激损害作用,尤其是大量脑出血导致的危重症患者。尽早清除颅内血肿或减少其含量可减轻颅内血肿对脑组织继发损害,但不能解除颅内出血和手术打击引发的机体应激反应。颅脑急性应激性反应可引发脑组织神经细胞水肿和坏死,造成神经功能缺损,而颅内血肿和手术引发的应激反应主要是通过激发交感-肾上腺素系统,进一步引发级联式炎性反应,同时,引起血流动力学变化,加重脑组织缺血和缺氧性损害[6]。
右美托咪定作为一种α2-肾上腺素受体激动剂,能够高效选择性的激活脑干睡眠和觉醒调节中枢,抑制去甲肾上腺素释放,从而起到抗交感系统兴奋、镇静和镇痛作用[7]。脑出血和开颅术后机体应激性导致交感系统兴奋、血管收缩、血压增高、心率增快、机体耗氧和耗能剧增,进一步引发颅内压增高、脑灌注不足,甚至脑组织缺血缺氧、脑水肿加重、神经细胞坏死,而颅内压增高和脑神经缺血缺氧时又可以反馈性激活交感系统,造成恶性循环,最终导致神经功能损害持续性加重,严重影响其预后。多项研究支持右美托咪定可减轻交感神经兴奋,减少去甲肾上腺素释放,从而减慢心率、降低血压和减少机体氧耗,对维持机体血流动力学稳定具有重要意义[8-10]。本研究在术后继续使用右美托咪定,试验组不同时间点的心率、MAP均低于对照组,差异有统计学意义(P<0.05),也支持了右美托咪定在术后应用稳定血流动力学。机体血流动力学稳定,保证了脑组织有效的灌注压力,减少了脑组织缺血事件,也减轻了细胞毒性和神经毒性脑水肿,从而降低颅内压。脑组织损伤后,直接导致其能量代谢异常,而能量代谢障碍又是引发脑细胞炎性反应和引起脑细胞坏死的重要因素。脑氧和脑糖代谢为评估脑细胞活性的重要指标[11]。脑氧和脑糖代谢障碍会直接引发炎性因子释放,造成神经细胞毒性,加剧脑组织损害和功能障碍,尤其是引发认知功能障碍,则提高脑组织脑氧和脑糖代谢,减轻炎性反应,对于脑组织功能恢复和改善预后至关重要。右美托咪定还可通过调节大脑皮层下蓝斑核的肾上腺素受体腺苷环化酶通路,增加脑缺血区域血供,减轻再灌注损伤,并激活能量敏感性蛋白酶AMPK,抑制炎性因子释放,减少神经细胞凋亡,增强生长因子表达,减少脑组织一氧化氮含量[12]。本研究中试验组脑氧和脑糖代谢及颅内压变化指标均优于对照组,且差异有统计学意义(P<0.05),证实通过术后持续应用右美托咪定,减轻机体应激反应,稳定血流动力学,保证脑灌注,减轻炎性反应和细胞凋亡情况,改善脑组织脑氧和脑糖代谢,进一步降低颅内压。
GABA和Glu作为重要的神经递质,广泛存在于神经组织中,共同参与疼痛和睡眠觉醒调节,与人的意识水平密切相关。GABA作为抑制性神经递质,对大脑神经回路的精确活动和神经元群的同步震荡活动密切相关。它可通过与突触后膜上特异性受体相结合,促进CL-跨膜转运,降低突触后神经元放电速率,抑制神经细胞兴奋性。与其相反,Glu作为兴奋性神经递质,可通过激活N-甲基-D-天冬氨酸型受体引起Na+和K+通透性,导致大量Ca2+内流,产生兴奋性突触后电流,选择性兴奋神经元[13-15]。正常情况下GABA和Glu含量处于平衡状态,但在应激状态下,GABA的含量下降,Glu含量增加,造成兴奋性神经元持续去极化,应激损害继续放大,引发神经元损伤和坏死。研究中试验组开颅术后持续使用右美托咪定,结果其术后12 h、24 h、72 h脑脊液中GABA含量增加度高于对照组,而Glu含量增加度低于对照组,组间比较差异有统计学意义(P<0.05)。由此表明,右美托咪定可通过减少脑组织中Glu含量,增加GABA含量,起到保护神经元,促进神经功能恢复的作用。同时,GABA增多和Glu降低,还可通过降低NMDA受体介导的兴奋性神经毒性作用,保护缺血半暗带脑组织,减轻脑缺血,促进脑功能恢复。分析原因为右美托咪定通过激活脑神经末梢α2-肾上腺素受体,阻断突触Ca2+内流,提高谷氨酰胺酶活性,减少Glu释放,缓解神经细胞兴奋毒性[16]。
综上所述,右美托咪定作为一种高选择性α2-肾上腺素受体激动剂,在危重症高血压脑出血开颅术后持续应用,能够减轻应激反应,稳定血流动力学,改善脑氧和脑糖代谢,缓解颅内高压,调节脑神经末梢GABA和Glu释放,达到保护脑神经细胞,并促进其功能恢复和改善预后。

