枯草芽孢杆菌M-23对柑橘砂皮病防效及柑橘叶际细菌群落多样性的影响
李审微 洪艳云 李新文 何可佳 戴良英 卢晓鹏 宋娜 易图永


摘要:【目的】明确柑橘砂皮病不同发病等级及喷施生防菌枯草芽孢杆菌M-23后柑橘叶际细菌群落结构的变化,揭示生防菌防治柑橘砂皮病的叶际微生物学机制,为进一步研究柑橘砂皮病的生物防治提供理论基础。【方法】试验设对照区和喷施生防菌区2个区域,喷施生防菌区分别在2019年3月中旬柑橘春梢长2~3 cm、4月中旬、谢花2/3、果实蚕豆大小和果实乒乓球大小时喷施M-23菌株发酵液,喷药液量3 L/株;同时对照区喷施等量的灭菌NB液体培养基,在最后一次喷施生防菌15 d 后进行防效调查。采集喷施生防菌区柑橘叶片(R4处理,病情等级0级)和未喷施生防菌区不同发病等级的柑橘叶片(R1、R2和R3处理,病情等级分别为0、5和9级),使用FastDNA[?] Spin Kit for Soil试剂盒提取柑橘叶片叶际微生物总DNA,通过Illumina MiseqTM高通量平台测序分析微生物群落多样性。【结果】生防菌M-23对柑橘砂皮病的防治效果达74.02%。高通量测序共获得571091条序列,单一样品序列数17833~96147条,在97%的相似水平下进行生物信息统计分析聚类后获得2932个OTUs。4个处理的OTUs数量分别为1944、1545、1205和607个,表现为R1>R2>R3>R4。在门水平的组成上主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、梭杆菌门(Fusobacteria)、装甲菌门(Armatimonadetes)、酸杆菌门(Acidobacteria)和疣微菌门(Verrucomicrobia)组成。变形菌门是优势菌门,在R1、R2、R3和R4处理中的相对丰度分别为81.84%、87.93%、86.80%和68.82%。对照区的叶际微生物多样性与发病等级成反比;喷施生防菌后柑橘叶片叶际细菌群落多样性降低,在属水平上芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas)的相对丰度得到明显增加,芽孢杆菌属的相对丰度达33.41%。【结论】喷施生防菌M-23能有效防治柑橘砂皮病。M-23菌株能在柑橘叶片上定殖和增殖,改善叶际细菌群落结构,提升有益菌的比例,使病情指数降低,具有一定的应用潜力。
关键词: 柑橘砂皮病;叶际细菌;生防菌;高通量测序;多样性
中图分类号: S436.66 文献标志码: A 文章编号:2095-1191(2020)07-1699-07
Abstract:【Objective】Focusing on different severities of Diaporthe citri and the shifts of bacterial community diversity in citrus phyllosphere after spraying with Bacillus subtilis M-23, this study was to reveal the phyllospheric microbiological mechanism of controlling D. citri with biocontrol bacteria and provide theoretical basis for further studies on biological control of D. citri. 【Method】The experiment was conducted in two areas—the control area and the treatment area. In the treatment area, biocontrol bacteria M-23 was sprayed in the middle of March, 2019, when the citrus spring tip grew 2-3 cm, in the middle of April, 2/3 of flowers fell, the citrus size was like broad bean and the citrus size was like ping-pong ball, evenly onto citrus leaves with an inoculum of 3 L/plant. At the same time, the control area was sprayed with the same amount of sterilized NB medium. The control effect was investigated 15 d after the last application of biocontrol agents. Collecting leaves with different incidence grades in the sprayed areas(R4 treatment, incidence grade 0) and unsprayed areas(R1, R2 and R3 treatments,incidence grades 0, 5 and 9 respectively). FastDNA[?] Spin Kit for Soil kit was used to extract the total DNA of phyllosphere microorganisms, and the diversity of microbial community was analyzed by Illumina MiseqTM high throughput platform sequencing method. 【Result】The result showed that the control effect of biocontrol bacterium M-23 on D. citri was 74.02%. A total of 571091 high quality sequences were obtained by high throughput sequencing, the number of single sample sequences ranged from 17833 to 96147, and 2932 OTUs were obtained by bioinformatics statistical analysis clustering at a similar level of 97%. The number of OTUs of the four treatments were 1944, 1545, 1205 and 607, respectively,in the following order:R1>R2>R3>R4. The horizontal composition of the phylum was mainly composed of Proteobacteria, Firmicutes, Bacteroidetes, Actinomycetes, Fusobacteria, Armatimonadetes, Acidobacteria and Verruciformis. Proteobacteria were dominant, and the relative abundances in R1, R2, R3 and R4 treatments were 81.84%, 87.93%, 86.80% and 68.82%, respectively. In the control area,phyllosphere microbial diversity was inversely proportio-nal to the incidence level. After spraying the biocontrol agent, the diversity of the bacterial community in the phyllosphere decreased, and the relative abundance of Bacillus and Pseudomonas increased obviously at the genus level, the relative abundance of Bacillus reached 33.41%. 【Conclusion】To sum up, spraying M-23 can effectively prevent the occurrence of D. citri. M-23 can colonize and proliferate on citrus leaves, which improves the community structure of phyllosphere bacteria, increases the proportion of beneficial bacteria, and reduces the disease index. Therefore, B. subtilis M-23 has certain application potential.
Key words: Diaporthe citri; phyllosphere bacteria; biocontrol bacteria; high-throughput sequencing; diversity
Foundation item: Post Scientist Project of Modern Agriculture(Citrus) Industrial Technology System(CARS-26); Citrus Plant Protection Post Expert of Hunan Fruit Industry Technology System(Xiangnongfa〔2015〕137); Hunan Agricultural Universitys “Double First-Class” Construction Sub-project(SYL2019027); Hunan Agricultural University Youth Science Foundation Project(19QN30)
0 引言
【研究意义】近年来,柑橘砂皮病在湖南省大面积发生,且日益严重,给湖南省柑橘产业带来巨大经济损失(马靖艳等,2019)。柑橘砂皮病菌(Diaporthe citri)为弱寄生菌,在树体受伤或树势衰弱时进行侵染,特别是侵染叶片和果实,常在表面形成黑色麻点,严重影响果实外观和品质,影响其经济价值(方天露,2017)。目前,防治柑橘砂皮病主要依靠化学药剂防治,每年需进行6次以上喷施才有较好的控制效果。大量化学药剂的使用极易导致病原菌产生抗性和农药残留,影响环境微生物的平衡(周娜等,2015)。生物防治措施因对环境友好、安全程度高、不会造成药物残留而受到研究者们的重视。因此,研究柑橘砂皮病不同发病等级柑橘叶片叶际微生物多样性,探究喷施生防菌对叶际微生物多样性的影响,有助于从微生态分析中发现柑橘砂皮病病害与微生态之间的关系,明确芽孢杆菌对柑橘砂皮病的抗病机制,为防治柑橘砂皮病提供新思路。【前人研究进展】高爽等(2016)综述了植物叶际微生物群落的组成、特点及与外界环境的互作,发现不同因素均会对叶际微生物群落组成造成一定影响,其变化有规律可循,微生物群落组成的改变会影响寄主植物的生长。化学农药的使用对植物葉际微生物群落的影响较大,谢兰芬等(2018)研究发现,使用百菌清处理玉米叶片对其叶际微生物的影响较大,而解淀粉芽孢杆菌与喷施环境兼容性良好,是一种生态、环境友好的防治手段。近年来,随着高通量测序技术的发展,扩增子测序分析技术逐渐在植物叶际微生物多样性的研究中得到广泛使用(Bodenhausen et al.,2013)。罗路云等(2017)比较了不同发病等级下植物叶际微生物种群的多样性,发现由于病害的发生,植物叶际细菌种群会发生显著变化,发病叶片叶际细菌多样性明显低于健康叶片叶际细菌多样性。Zhang等(2008)研究苏云金芽孢杆菌对微生物群落的影响,发现接种苏云金芽孢杆菌后辣椒叶际微生物结构受到影响,微生物多样性降低。岑浴(2016)将多粘类芽孢杆菌喷施在茶叶上,发现多粘类芽孢杆菌可在叶际定殖,施用生防菌后在实现良好促生和病害抑制作用的基础上减少了叶际细菌群落的相对丰度,但对于群落的组成和体系的稳定影响较小。【本研究切入点】目前,针对柑橘砂皮病的研究主要集中在其发生规律和化学防治上,生物防治也仅限于基础的生防菌筛选,没有对柑橘砂皮病不同发病等级叶际细菌群落多样性的差异性比较和施用生防菌发酵液后叶际细菌群落结构变化方面的研究。生防菌M-23由湖南农业大学植物保护学院园艺作物病害研究室筛选获得,通过前期研究发现其能抑制柑橘砂皮病病原菌菌丝生长和孢子萌发,但未对其田间防治效果及对柑橘叶际微生物的影响进行研究。【拟解决的关键问题】通过生防菌M-23对柑橘砂皮病防治的田间试验,利用高通量测序技术比较不同处理下柑橘叶际细菌群落多样性的差异,探究生防菌防治柑橘砂皮病的机制,为柑橘砂皮病的生物防治提供理论参考。
1 材料与方法
1. 1 试验材料
供试生防菌株为枯草芽孢杆菌(Bacillus subti-lis)M-23,由湖南农业大学植物保护学院园艺作物病害研究室分离获得。
1. 2 试验方法
1. 2. 1 试验地概况 试验地位于湖南省怀化市洪江市双溪镇柑橘园艺场,该橘园于1986年建园,品种为冰糖橙,柑橘砂皮病发生较重。
1. 2. 2 试验设计 试验设对照区和喷施生防菌区2个区域。将生防菌M-23活化后以0.8%的接种量接种于灭菌的NB液体培养基中,28 ℃、180 r/min培养5 d后备用。喷施生防菌区分别在2019年3月中旬柑橘春梢长2~3 cm、4月中旬、谢花2/3、果实蚕豆大小和果实乒乓球大小时喷施生防菌发酵液,使用人工背负式电动喷雾器对叶片进行喷洒,喷药液量3 L/株;同时对照区以相同条件喷施等量的灭菌NB液体培养基。叶片采集设4个处理,其中对照区叶片采集根据柑橘砂皮病的病情等级(R1:0级,无病斑;R2:5级,每叶病斑51~75个;R3:9级,每叶病斑100个以上)对应设R1、R2和R3处理,喷施生防菌区设R4处理(叶片无病斑)。
1. 2. 3 样品采集方法 最后一次喷施生防菌15 d后,从对照区选择3株柑橘树分别采集R1、R2和R3处理的柑橘叶片。叶片采集采用五点取样法,每株柑橘树于东西南北中各选择1个枝条,每枝条采集R1处理同等大小柑橘叶片1片,每处理共15片叶混合放入无菌采样袋中,进行3次重复,共获得3个样品,分别命名为SP01、SP02和SP03;以同样的方式采集R2和R3处理柑橘叶片样品,R2处理的样品命名为SP51、SP52和SP53,R3处理的样品命名为SP91、SP92和SP93。从喷施生防菌区3棵不同柑橘树上采集无病的柑橘叶片,方法同上,样品命名为BS01、BS02和BS03。
1. 2. 4 防治效果调查 参照张岳等(2018)的方法对柑橘砂皮病进行分级:0级,无病;1级,叶片或果实上有1~25个病斑;3级:叶片或果实上有26~50个病斑;5级:叶片或果实上有51~75个病斑;7级:叶片或果实上有76~100个病斑;9级:叶片或果实上有100个病斑以上。收获期间分别调查对照区和喷施生防菌区柑橘砂皮病病情指数并计算防治效果,每区调查3株柑橘树,每株5个枝条,共调查15个枝条上叶片的发病情况。
病情指数=∑(各级病叶数×各级代表值)/(调查
总叶数×最高级代表值)×100
防治效果(%)=(对照区病情指数-防治区病情
指数)/对照区病情指数×100
1. 2. 5 叶际微生物总DNA提取 取叶片6 g加入灭菌的锥形瓶中,向锥形瓶加入pH 7的0.1 mol/L PBS缓冲液100 mL、吐温-80 100 ?L。锥形瓶置于超声波振荡器中振荡10 min后,在恒温摇床中以28 ℃、180 r/min的条件培养30 min,然后再次用超声波振荡器振荡5 min,在无菌条件下用镊子取出叶片。采用真空泵对锥形瓶中的液体进行抽滤,用0.45 ?m微孔滤膜收集微生物。使用FastDNA[?] Spin Kit for Soil试剂盒提取叶际微生物DNA,要求DNA浓度和纯度的A260/A280为1.8~2.0。
1. 2. 6 16S rDNA的V3~V4区PCR扩增及测序 第一轮扩增,PCR引物为341F[5'-CCCTACACGACGCT CTTCCGATCTG(barcode)CCTACGGGNGGCWGCA G-3']和805R(5'-GACTGGAGTTCCTTGGCACCCG AGAATTCCAGACTACHVGGGTATCTAATCC-3')。反应体系30 ?L:2×Taq Master Mix 15 ?L,上、下游引物(10 μmol/L)各1 ?L,DNA模板10~20 ng,ddH2O补足至30 ?L。扩增程序:94 ℃预变性3 min;94 ℃ 30 s,45 ℃ 20 s,65 ℃ 30 s,进行5个循环;94 ℃预变性20 s;94 ℃ 30 s,55 ℃ 20 s,72 ℃ 30 s,进行20个循环;72 ℃延伸5 min,4 ℃保存。第二轮扩增,引物Illumina桥式PCR兼容引物。反应体系30 ?L:2×Taq Master Mix 15 ?L,上、下游引物(10 μmol/L)各1 ?L,PCR产物20 ng(第一轮),ddH2O补足至30 ?L。扩增程序:95 ℃预变性3 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,进行5个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行高通量测序。
1. 3 数据处理与分析
Illumina MiseqTM平台获得的原始数据,通过质控过滤后剔除嵌合体和非特异性扩增序列,得到的有效数据使用Usearc软件以97%的默认相似性将序列聚类成为一个OTU。以聚类similarity值(0.86~0.99)为横坐标、OTU数目变化(0~25000)为纵坐标制图,本研究OTU分析和分析学分析选择的similarity值为0.97。使用97%相似度的OTU,用Mothur进行Rarefaction分析(Asnicar et al.,2015),利用R制作稀释曲线用来评估各样品在测序强度间的差异。根据每个样品文库的OTU丰度信息,完成Alpha和Beta多样性分析。计算Chao1、ACE、Shannon和Simpson指数,评估序列文库的多样性。通过NMDS(Non-metric multidimensional scaling)分析4组不同处理微生物群落结构间的差异。
2 结果与分析
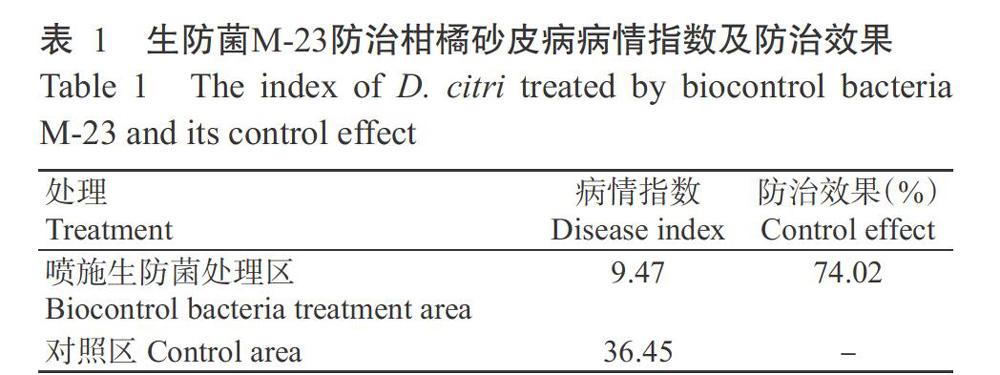
2. 1 生防菌M-23对柑橘砂皮病的防治效果
由表1可知,对照区发病较严重,病情指数高达36.45;喷施生防菌区施菌后病情指数降低至9.47,防治效果明顯,防效达74.02%。说明生防菌M-23对柑橘砂皮病具有较强的拮抗作用。
2. 2 高通量测序数据预处理结果
利用高通量测序共得到571091条有效序列,单一样品序列数17833~96147条,平均为47591条,对序列在97%相似水平下进行生物信息统计分析,获得2932个OTUs。采用稀释曲线来比较样品间物种的丰度和试验数据的合理性,如图1所示,Shannon指数的稀释曲线趋于平缓,可认为测序深度已基本覆盖样品中绝大多数物种,更多的数据量只会产生少量新的OTU,测序数据量足以反映样品中的物种多样性。
2. 3 OTU聚类分析结果
由图2可看出,R1、R2、R3和R4处理分别有1944、1545、1205和607个OTUs,4个处理间的OTUs数量表现为R1>R2>R3>R4,说明未喷施生防菌且未发病的R1处理微生物种类最丰富,随着病情指数的增加微生物种类丰富度随之降低,喷施生防菌的R4处理微生物种类最少。
2. 4 Alpha多样性指数分析结果
目前,普遍认可种(Species)的分类水平为97%序列相似度(Gu et al.,2019),在该相似度水平下使用获取的OTU分析各样品的Alpha多样性,通过Chao1、ACE、Shannon和Simpson指数对柑橘叶际微生物多样性进行评估,所得的参数如表2所示。由表2可知,Shannon、Simpson、Chao1和ACE指数的变化范围分别为1.41~3.77、0.084~0.372、365.6~1256.5和413.7~1302.2。对喷施灭菌培养基的R1、R2和R3处理的Shannon指数进行比较,表现为R1>R2>R3,表明微生物多样性随着病情指数的升高而降低;喷施生防菌的R4处理与喷施灭菌培养基的R1、R2和R3处理相比,喷施生防菌后Simpson指数显著降低(P<0.05),与OTU聚类分析结果吻合。
2. 5 NMDS非度量多维尺度分析结果
根据非度量多维尺度分析结果(图3),R2和R3处理与R1处理在坐标轴上有一定距离,表明柑橘砂皮病的发生导致叶际细菌群落结构改变;R4处理与R1、R2和R3处理距离较远,说明生防菌的加入改变了叶际细菌的群落结构。如图3所示,相同处理的重复能紧密靠在一起,不同处理间可明显区分,各处理间有明显差异性,相同处理间群落相似度较高,未喷施生防菌不同病情等级条件下的叶际细菌群落与生防菌处理的细菌群落可明显区分开来。使用非参数检验方法Anosim做进一步分析,根据分析结果(表3)可知,R接近1,说明4个处理的组间差异大于组内差异,P=0.011,小于0.05,说明分析结果具有统计学上的显著性差异。
2. 6 高通量测序分析柑橘叶际细菌群落结构
柑橘叶际细菌群落门水平和属水平在各分组样品中相对丰度≥1%的组成情况见图4和图5。在门水平上主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、梭杆菌门(Fusobacteria)、装甲菌门(Armatimonadetes)、酸杆菌门(Acidobacteria)和疣微菌门(Verrucomicrobia)组成(图4)。其中变形菌门占绝对优势,在R1、R2、R3和R4处理中的相对丰度分别为81.84%、87.93%、86.80%和68.82%,喷施灭菌培养基处理的R1处理与R2和R3处理相比,变形菌门的相对丰度随着病情等级升高而升高,R2处理与R3处理间无明显差异,喷施生防菌后R4处理中变形菌门的相对丰度有所下降;发病后降低了浮霉菌门的相对丰度;喷施灭菌培养基处理组的厚壁菌门的相对丰度均在10.00%以下,而喷施生防菌后R4处理组厚壁菌门的相对丰度为34.89%,相对丰度明显增加。
进一步对各分组样品在属水平(OTU数相对丰度≥1%)的相对丰度进行研究,结果(图5)表明,不同样品的主要叶际细菌群落结构存在明显差异,其中,假单胞菌属(Pseudomonas)、鞘氨醇单胞菌属(Sphingomonas)、甲基杆菌属(Methylobacterium)和马赛菌属(Massilia)为R1、R2和R3处理的共有优势菌属,黄单胞菌属(Xanthomonas)为R2和R3处理的共有优势菌属。橘园发病后假单胞菌属的丰度降低,喷施生防菌后明显上升,在R4处理组中达最高(42.79%)。鞘氨醇单胞菌属和黄单胞菌属在发病后相对丰度先明显升高,然后略微下降,可能与致病菌存在协同作用。喷施生防菌后R4处理的细菌主要由假单胞菌属和芽孢杆菌属(Bacillus)组成,芽孢杆菌属在R4处理中的相对丰度达33.41%,说明M-23菌株在叶际得到较好的定殖。
3 讨论
近年来,湖南省怀化地区由于降水增加、温度上升、果农对柑橘园管理不当、化学农药滥用等导致柑橘砂皮病发生越来越严重,给柑橘的品质带来严重影响(马靖艳等,2019),造成重大经济损失。生物防治是防治柑橘砂皮病最有效的绿色防治措施,通常是在植物生长的自然环境中获得对病原菌有拮抗作用的生防菌株来防治病害,这种生物防治的方法可维持叶际微生物生态系统的平衡(Wang et al.,2019)。
植物病害的发生会影响其环境微生物结构变化,多样性和均匀性随着病害的发生而降低,化学农药的喷施会影响环境微生物的生态平衡,而生防菌可优化环境微生物的组成(李春宏等,2019;李忠奎等,2019)。岑浴(2016)研究多粘类芽孢杆菌在茶叶上的定殖及其对叶际细菌群落的影响时发现,生防菌在叶片上定殖作为一种生物刺激,可改良叶际细菌的生态环境,并不会产生生物入侵的作用打破叶际微生物的生态平衡造成生态环境的紊乱。谢兰芬等(2018)在生防菌对玉米叶际微生物影响的研究中证明杀菌剂严重降低了玉米叶际微生物的代谢活动,而解淀粉芽孢杆菌与喷施环境兼容性良好。Zhang等(2008)探究黄瓜和辣椒的叶际使用苏云金芽孢杆菌对其叶际微生物结构的影响,结果显示苏云芽孢杆菌会降低微生物的多样性。本研究中R1处理(发病等级为0级)的Chao1、Shannon和ACE指数均大于其他处理,Simpson指数小于其他处理,在病害入侵后其叶际微生物多样性和丰富度较健康叶际微生物有所降低;喷施生防菌的R4处理Chao1、Shannon和ACE指数的降低可能是因为柑橘叶片喷施生防菌后,突然有大量生防菌加入,其他叶际微生物的定殖受到一定影响,从而提升了有协同作用菌群的相对丰度,抑制了部分菌群的定殖,因此导致叶际微生物的多样性有所降低,與Zhang等(2008)的研究结果一致。
在叶际细菌菌群结构的组成中,变形菌门、厚壁菌门、拟杆菌门和放线菌门是4个处理共有的菌门,变形菌门和厚壁菌门是其优势菌门,厚壁菌门在R4处理中所占的比例最高,为34.89%,明显高于未喷施生防菌的R1、R2和R3处理,其原因是喷施生防菌后枯草芽孢杆菌M-23在叶际得到良好定殖,增加了生防菌株所属门的相对丰度;变形菌门主要包括α-变形菌纲、β-变形菌纲和γ-变形菌纲,尽管变形菌门在不同物种叶际的相对丰度不一致,但均为叶际细菌中的优势门类,与Laforest-Lapointe和Whitaker(2019)对叶际细菌群落研究得出的结果一致。变形菌门中很多细菌对周边环境的平衡起到重要作用,其中γ-变形菌纲中的假单胞菌属在4个处理中占据优势地位,与刘畅等(2020)测定的烟草叶际微生物多样性的研究结果基本一致。随着病原菌的侵染假单胞菌属的相对丰度下降,喷施生防菌后抑制了病害的发生,其相对丰度明显上升,远高于其他处理,推测是假单胞菌属与喷施的生防菌M-23在叶际的互作对植物起到一定的保护作用。沙月霞和沈瑞清(2019)研究发现,3种芽胞杆菌浸种处理显著改变水稻根和茎部内生细菌群落结构,提高了假单胞菌属的相对丰度,本研究结果与之一致。假单胞菌属作为叶际微生物的组成,随着病害的发生或生防菌的喷施其相对丰度发生变化,可能与植物防御病原物入侵有关。有研究表明,丁香假单胞菌(Pseudomonas syringae)产生的生物活性分子(冠菌素Coronatine和一种蛋白酶体抑制剂Sy- ringolin A)能引起气孔关闭,从而影响病原体进入质外体(Hunter et al.,2010)。Ko等(2014)分离得到的一株假单胞菌菌株THJ609-3对柑橘砂皮病有较好的防效,可抑制菌丝生长和孢子萌发。此前也有学者发现多种生防菌联合使用可提高对病害的防治效果,谯天敏等(2015)将铜绿假单胞菌(P. aeruginosa)与长枝木霉菌(Trichoderma longibrachiatum)2种生防菌联合使用,对杂交竹梢枯病的协同防效得到显著提高;Wang等(2019)使用枯草芽孢杆菌和哈茨木霉组成的生物产物能有效防治马铃薯疮痂病。因此,芽孢杆菌属与假单胞菌属联合使用以有效防治柑橘砂皮病有待进一步探究。
本研究运用高通量测序技术检测柑橘叶际细菌群落结构,比较柑橘砂皮病不同发病等级下叶际细菌群落组成的区别和喷施生防菌后叶际菌群的变化,有助于深层次了解柑橘健康叶片与砂皮病叶的微生态差异,为研究柑橘砂皮病的防治提供理论基础。
4 结论
喷施生防菌M-23能有效防治柑橘砂皮病。在柑橘砂皮病发生较严重的柑橘园中喷施生防菌M-23后,M-23菌株能在柑橘叶片上定殖和增殖,改善叶际细菌群落结构,提升有益菌的比例,使病情指数降低,具有一定的应用潜力。
参考文献:
岑浴. 2016. 多粘类芽孢杆菌在茶叶上的定殖及其对叶际细菌群落的影响[D]. 石家庄:河北科技大学. [Cen Y. 2016. Colonization of Paenibacillus polymyxa in the phyllosphere of Camellia sinensis and its effect on the bacterial community[D]. Shijiazhuang:Hebei University of Science and Technology.]
方天露,李怡岚,易图永,戴良英,何可佳,谢深喜. 2017. 柑橘砂皮病病原菌的分离鉴定和药剂筛选试验[J]. 中国果树,(2):53-55. [Fang T L,Li Y L,Yi T Y,Dai L Y,He K J,Xie S X. 2017. Isolation,identification and fungicide screening of the pathogen of Diaporthe citri[J]. China Fruits,(2):53-55.]
高爽,刘笑尘,董铮,刘茂炎,戴良英. 2016. 叶际微生物及其与外界互作的研究进展[J]. 植物科学学报,34(4):654-661. [Gao S,Liu X C,Dong Z,Liu M Y,Dai L Y. 2016. Advance of phyllosphere microorganisms and their intera-ction with the outside environment[J]. Plant Science Journal,34(4):654-661.]
李春宏,殷剑美,王立,蒋璐,郭文琦,韩晓勇,张培通. 2019. 连作对芋头根际土壤理化性状和微生物特性的影响[J]. 江苏农业学报,35(4):825-833. [Li C H,Yin J M,Wang L,Jiang L,Guo W Q,Han X Y,Zhang P T. 2019. Effects of continuous cropping on soil physicochemical and microbial properties of taro[J]. Jiangsu Journal of Agricultural Sciences,35(4):825-833.]
刘畅,汪汉成,谢红炼,向立刚,黄宇,陈乾丽,余知和,邹光进. 2020. 感染赤星病烟草叶际细菌的多样性分析[J]. 烟草科技,53(2):8-14. [Liu C,Wang H C,Xie H L,Xiang L G,Huang Y,Chen Q L,Yu Z H,Zou G J. 2020. Biodiversity analysis of phyllosphere bacterial genus from tobacco leaves infected by brown spot disease[J].Tobacco Science and Technology,53(2):8-14.]
李忠奎,凌爱芬,李红丽,陈娟,朱显俊,王勇,陈玉蓝,王岩. 2019. 基于多样性测序对健康与易感病烟田根际土壤微生物群落分析[J]. 河南农业大学学报 ,53(6):918-925. [Li Z K,Ling A F,Li H L,Chen J,Zhu X J,Wang Y,Chen Y L,Wang Y. 2019. Analysis of rhizosphere soil microbial communities in healthy and susceptible tobacco fields based on diversity sequencing[J]. Journal of Henan Agricultural University,53(6):918-925.]
罗路云,张卓,金德才,譚新球,张德咏,田云,卢向阳,刘勇. 2017. 南瓜白粉病不同病情等级下叶际细菌群落结构和多样性[J]. 植物病理学报,47(5):688-695. [Luo L Y,Zhang Z,Jin D C,Tan X Q,Zhang D Y,Tian Y,Lu X Y,Liu Y. 2017. Phyllosphere bacterial diversities and community structures on pumkin with different severities of powdery mildew[J]. Acta Phytopathologica Sinica,47(5):688-695.]
马靖艳,杨付前,刘自君,刘斌,普建才,谭娟. 2019. 怀化地区柑橘砂皮病发生动态及综合防控措施[J]. 中国植保导刊,39(3):55-58. [Ma J Y,Yang F Q,Liu Z J,Liu B,Pu J C,Tan J. 2019. Occurrence trends and comprehensive control measures of Diaporthe citri in Huaihua area[J]. China Plant Protection,39(3):55-58.]
谯天敏,张静,朱天辉. 2015. 铜绿假单胞菌与长枝木霉对杂交竹梢枯病的协同增效生防研究[J]. 北京林业大学学报,37(2):113-120. [Qiao T M,Zhang J,Zhu T H. 2015. Synergistic biocontrol mechanism of Pseudomonas aeruginosa and Trichoderma longibrachiatum on Arthri-nium phaeospermum[J]. Journal of Beijing Forestry University,37(2):113-120.]
沙月霞,沈瑞清. 2019. 芽胞杆菌浸种对水稻内生细菌群落结构的影响[J]. 生态学报,39(22):8442-8451. [Sha Y X,Shen R Q. 2019. Impact of seed soaked by Bacillus on endophytic bacterial community structure of rice[J]. Acta Ecologica Sinica,39(22):8442-8451.]
谢兰芬,何鹏飞,吴毅歆,刘春明,肖春,何月秋. 2018. 解淀粉芽孢杆菌B9601-Y2对玉米叶际微生物群落的影响[J]. 玉米科学,26(2):149-155. [Xie L F,He P F,Wu Y X,Liu C M,Xiao C,He Y Q. 2018 .Effect of Bacillus amyloliquefaciens 9601-Y2 on maize phyllosphere microbial communities[J]. Journal of Maize Sciences,26(2):149-155.]
张岳,易图永,何可佳. 2018. 柑橘砂皮病发生规律研究[J]. 湖南农业科学,(9):78-80. [Zhang Y,Yi T Y,He K J. 2018. Research on the occurrence regularity of Diaporthe citri[J]. Hunan Agricultural Sciences,(9):78-80.]
周娜,胡军华,姚廷山,王雪莲,王娟,彭凤格,洪棋斌,江东. 2015. 柑橘种质抗柑橘蒂腐病菌扩展能力的评价[J]. 园艺学报,42(1):1889-1898. [Zhou N,Hu J H,Yao T S,Wang X L,Wang J,Peng F G,Hong Q B,Jiang D. 2015. Evaluation of anti-expansion capacity of different citrus germplasm against Diaporthe citri[J]. Acta Horticulturae Sinica,42(1):1889-1898.]
Asnicar F,Weingart G,Tickle T L,Huttenhower C,Segata N. 2015. Compact graphical representation of phylogenetic data and metadata with GraPhlAn[J]. PeerJ,3:e1029.
Bodenhausen N,Horton M W,Bergelson J. 2013. Bacterial communities associated with the leaves and the roots of Arabidopsis thaliana[J]. PLoS One,8(2):e56329.
Gu S S,Hu Q L,Cheng Y Q,Bai L Y,Liu Z H,Xiao W J,Gong Z H,Wu Y N,Feng K,Deng Y,Tan L. 2019. App-lication of organic fertilizer improves microbial community diversity and alters microbial network structure in tea(Camellia sinensis) plantation soils[J]. Soil and Tillage Research,195:1-10.
Hunter P J,Hand P,Pink D,Whipps J M,Bending G D. 2010. Both leaf properties and microbe-microbe interactions influence within-species variation in bacterial population diversity and structure in the lettuce(Lactuca species) phyllosphere[J]. Apple Environ mental Microbio-logy,76(24):8117-8125.
Ko Y J,Kim J S,Kim K D,Jeun Y C. 2014. Microscopical observation of inhibition behaviors against Diaporthe citri by pretreated with Pseudomonas putida strain THJ609-3 on the leaves of citrus plants[J]. Journal of Microbiology,52(10):879-883.
Laforest-Lapointe I,Whitaker B K. 2019. Decrypting the phyllosphere microbiota:Progress and challenges[J]. American Journal of Botany,106(2): 171-173.
Wang Z S,Li Y,Zhuang L B,Yu Y,Liu J,Zhang L X,Gao Z J,Wu Y F,Gao W,Ding G H,Wang Q. 2019. A rhizosphere-derived consortium of Bacillus subtilis and Trichoderma harzianum suppresses common scab of potato and increases yield[J]. Computational and Structural Biotechnology Journal,17:645-653.
Zhang B G,Bai Z H,Hoefel D,Tang L,Yang Z G,Zhuang G Q,Yang J Z,Zhang H X. 2008. Assessing the impact of the biological control agent Bacillus thuringiensis on the indigenous microbial community within the pepper plant phyllosphere[J]. FEMS Microbiology Letters,284:102-108.
(責任编辑 麻小燕)

