光介导抗菌涂层的研究进展*
姚添甜,李熇阳,任科峰,计 剑
(浙江大学 高分子科学与工程学系, 教育部高分子合成与功能构造重点实验室 ,杭州 310027)
0 引 言
医源性感染(Health care-associated infection, HAI)是病人在医院或其他医疗机构接受治疗时获得的感染的统称,主要包括尿路感染、手术部位感染、医院获得性肺炎、呼吸机相关感染等等[1-3]。HAI对病人的生命造成了严重威胁:根据世界卫生组织的报告,在发展中国家,病人HAI的平均患病率已高于10%。在拉丁美洲、亚洲和非洲,HAI会使得成年病人的死亡率分别增加约18%、24%和29%。同时,在欧美地区,HAI也导致了高达数十亿美元的社会经济损失。因此,近年来HAI已经成为全球性的重大公共卫生问题[4]。随着现代医学的发展,植/介入医疗装置,如人工关节、人工血管、导尿管等,已在临床治疗中被广泛使用。这使得植/介入医疗装置引起的细菌感染逐渐成为医源性感染最主要的组成部分之一。数据表明,美国每年仅因导尿管引发尿路感染的病人就高达上百万。植/介入医疗装置引发的医源性感染往往起源于细菌在装置表面的粘附和定植。细菌首先与装置表面接触,并进一步形成难以去除的细菌生物被膜。近些年来对抗生素的误用和滥用,导致细菌耐药性(Antimicrobial resistance,AMR)快速发展[5-6]。这使得植/介入医疗装置表面引发的医源性感染问题更加难以解决。
研究人员认为,抑制细菌在医疗装置表面的粘附和定植是解决医源性感染,抑制细菌进一步传播的关键[4,7-9]。而在医疗装置表面构建抗菌涂层不但可以赋予装置抗菌性能,而且一般不会破坏装置自身的机械性能[10-11]。这一方法与全身使用抗生素等药物相比,减少了药物用量,降低了产生AMR的概率;与临床常用的手术治疗相比,避免了对患者造成二次创伤。因此抗菌涂层被认为是最有效和最实用的方法之一,已逐渐发展成为抗菌领域的研究热点[12-13]。
传统的抗菌涂层常常选择将抗粘附聚合物(如聚乙二醇[14-15]、两性离子聚合物[16-19])或抗生素、抗菌肽、季铵盐、金属离子等抗菌剂固定或负载在涂层中[20-22],实现抗菌效果。但是传统抗菌涂层的应用同样阻碍重重,首先细菌耐药性的报道在近年来已经层出不穷,而新型抗生素的开发速度却显著降低。其次,新型抗菌剂的合成,如抗菌肽、季铵盐等,均需要复杂的流程和较长的时间。
因此,研究人员致力于探索新型抗菌涂层策略,以应对植/介入医疗装置引发的医源性感染问题,从而降低病人的痛苦,减少公共卫生压力。其中,光介导抗菌涂层是一种利用光照实现细菌杀灭的新型策略,因其独特的作用机理受到了研究人员的关注。本文将光介导抗菌涂层分为两类:光热抗菌涂层和光动力抗菌涂层,总结了两类涂层的作用机理和研究进展,并介绍了光介导抗菌涂层的发展趋势。
1 光介导抗菌
光是自然界中最易于获取的资源之一,在许多生物的生理过程中也扮演着重要角色。光介导抗菌就是在光照条件下灭活细菌的新型抗菌策略。一般而言,光介导抗菌策略主要包含紫外杀菌、光动力抗菌和光热抗菌三类。
在生活中,紫外杀菌已被广泛使用,这是由于紫外线具有兆焦级别的能量,能够快速杀灭细菌。但是这种短波紫外线的组织穿透能力很弱,并且极有可能会对人体正常细胞造成伤害,威胁人类健康。光动力抗菌和光热抗菌则使用组织穿透能力较好的红光和近红外光,分别产生活性氧和局部高温从而杀灭细菌[5]。
与其他抗菌策略相比,光介导抗菌策略具有灵活可控、广谱抗菌和不易引起细菌耐药性的突出优势[23-25]。近年的光介导抗菌研究主要集中在光热抗菌和光动力抗菌领域。
2 光热抗菌涂层
2.1 光热抗菌疗法
在食品行业,高温灭菌法被广泛应用。这是因为致病菌大多属于嗜温菌,可以在33~41 ℃的温度范围内生存繁殖。当环境温度高于55 ℃时,细菌的各项生理活动会受到明显限制[26-29]。研究人员希望利用细菌高温失活的特性,将此方法推广至医疗领域,于是光热疗法便受到了广泛关注。
光热疗法(Photothermal therapy, PTT)是在光源照射下通过光热转化剂将光能转换为热能,产生局部高温,从而杀灭细菌的治疗方法。基于高温灭菌的作用机制,这种方法更加安全可靠、不会引起细菌耐药性[30-32]。
在应用光热抗菌疗法时,研究人员常选择组织穿透能力最强的近红外光作为光源。常用的光热转化剂可大致分为四类,包括碳纳米材料(石墨烯[33]、碳纳米片[34]等),贵金属(金纳米粒子[35-36]、钯纳米粒子[37]等),金属化合物(如过渡金属化合物二硫化钼[38]、二硒化钨[39]等),和聚合物(聚多巴胺[40-42]、聚苯胺[43]等)。
2.2 光热抗菌涂层的研究进展
在材料表面构建光热抗菌涂层,可实现材料在光照条件下的高温灭菌。研究人员通过各种不同的方法将光热转化剂负载在涂层上。
Oh等[37]通过简单的混合和冷冻凝胶过程将钯纳米粒子物理包覆在壳聚糖/聚乙烯醇多孔膜上,得到光热抗菌敷料CS/PVA/Pd。此抗菌敷料具有高孔隙率、高比表面积和较好的生物相容性。钯纳米粒子的引入使得CS/PVA/Pd在808 nm激光照射下表现出优良的光热抗菌性能。研究人员利用非共价键相互作用在基底表面负载光热转化剂。Sung等[44]将聚多巴胺作为表面粘合剂,将侧链修饰了磺酸基团的聚乙烯吡咯烷酮(PVP)固定在材料表面,随后通过静电作用吸附光热转化剂聚苯胺,从而制备出光热抗菌表面。
另一种较为直接的方法是通过化学键合固定光热转化剂。Lee等[45]制备出修饰了羧基基团的金纳米壳(AuNS),利用羧基与硅烷偶联剂上氨基的化学反应在基底表面固定金纳米壳涂层,如图1所示。金纳米壳具有优异的光热转化性能,使得涂层在近红外光的照射下可高效杀灭粪肠球菌。
聚多巴胺(Polydopamine,PDA)是一种优良的光热转化剂,具有高达40%的近红外光光热转换效率。同时,以多巴胺氧化自聚为代表的贻贝仿生化学为涂层的构建提供了具有广泛适用性的新方法[46]。因此PDA常常被用于构建光热抗菌涂层[47-48]。
我们[49]将聚合物基底浸泡在弱碱性的多巴胺溶液中(2 mg/mL, 10 mmol/L Tris 缓冲液, pH=8.5),在基底表面制得了聚多巴胺光热抗菌涂层,如图2所示。随着浸泡时间的延长,涂层厚度也逐渐增加,反应24 h后,PDA涂层厚度为28 nm。在近红外光照射下,涂层对金黄色葡萄球菌和大肠杆菌均表现出优异的光热抗菌性能,可用于各类医用导管的表面改性。

图1 制备AuNS修饰的聚二甲基硅氧烷PDMS表面[45]

图2 PDA涂层的厚度随聚合时间变化和 PDA涂层聚合24 h后的扫描电镜照片(标尺为1 μm)[49]
二硫化钼(MoS2)是一种过渡金属硫化物,具有与石墨烯相似的二维结构,可作为光热转换剂用于光热治疗;同时MoS2也能够产生活性氧,对细菌造成氧化应激损伤。Liu等[41]在钛植入材料表面制备出二氧化钛纳米管,随后利用水热法形成MoS2涂层。涂层上沉积PDA后,通过化学反应在涂层上固定了RGD肽,从而构建出MoS2/PDA-RGD复合涂层。涂层的光热效应可以有效杀灭细菌,并且进一步促进谷胱甘肽的氧化。RGD肽的引入利于骨的形成。

图3 智能光热抗菌涂层的“杀灭-释放”策略[51]
单宁酸是一种多酚类物质,具有类似多巴胺的苯酚基团,可以与金属离子形成络合物粘附在不同基底表面[50]。同时,这种络合物也具有优良的光热转化性能。Yu等[51]将单宁酸/Fe3+络合物(TA/Fe)沉积在金基底表面,并通过简单的化学反应在涂层上接枝了聚(N-异丙基丙烯酰胺) (PNIPAAm),使得涂层表现出“杀灭-释放细菌”的功能,如图3所示。在近红外光照射下,涂层的温度升高杀灭细菌,此时PNIPAAm处于坍缩状态;无光照条件下涂层温度降低,PNIPAAm亲水性增强,从而释放涂层上90%的细菌。这种智能化的抗菌策略更有益于涂层的长期使用和实际应用。
3 光动力抗菌涂层
3.1 光动力抗菌疗法

由于光动力疗法独特的作用机制,光动力抗菌具有突出的优势:首先光源的使用使得治疗更为灵活可控;其次,多靶点的作用机制使得光动力疗法一般不易引发细菌耐药性,并且对耐药菌仍然有效;最后,具有高反应活性的活性氧可快速破坏细菌结构,使得光动力疗法的抗菌效率较高[59-61]。

图4 光动力抗菌疗法的作用机制[52]
3.2 光动力抗菌涂层的研究进展
在材料表面构建高效的光动力抗菌涂层,可以赋予材料光动力抗菌性能[62-63]。研究人员通过不同的方法实现了光敏剂的负载,与光热抗菌涂层不同的是,光动力抗菌涂层上光敏剂的聚集情况对涂层的光动力抗菌效率影响深远。
非共价键力可被应用于结合光敏剂。Kubat等[64]通过静电纺丝技术制备出聚苯乙烯电纺纤维膜,对电纺纤维膜进行磺酸化处理后,通过简单的浸泡过程,利用磺酸基团与光敏剂的静电吸附作用制备出光动力电纺纤维膜。基于静电作用吸附的光敏剂分子表现出不同的光物理性能,这与光敏剂的聚集状态息息相关。在最近的一个研究中,我们[65]利用β-环糊精与光敏剂亚甲基蓝的主客体相互作用,结合超声喷涂技术构建了光动力抗菌涂层,如图5所示。主客体作用有效抑制了光敏剂的聚集,使得涂层具有高单线态氧量子效率,在光敏剂负载量极低的情况下表现出优秀的光动力抗菌性能。
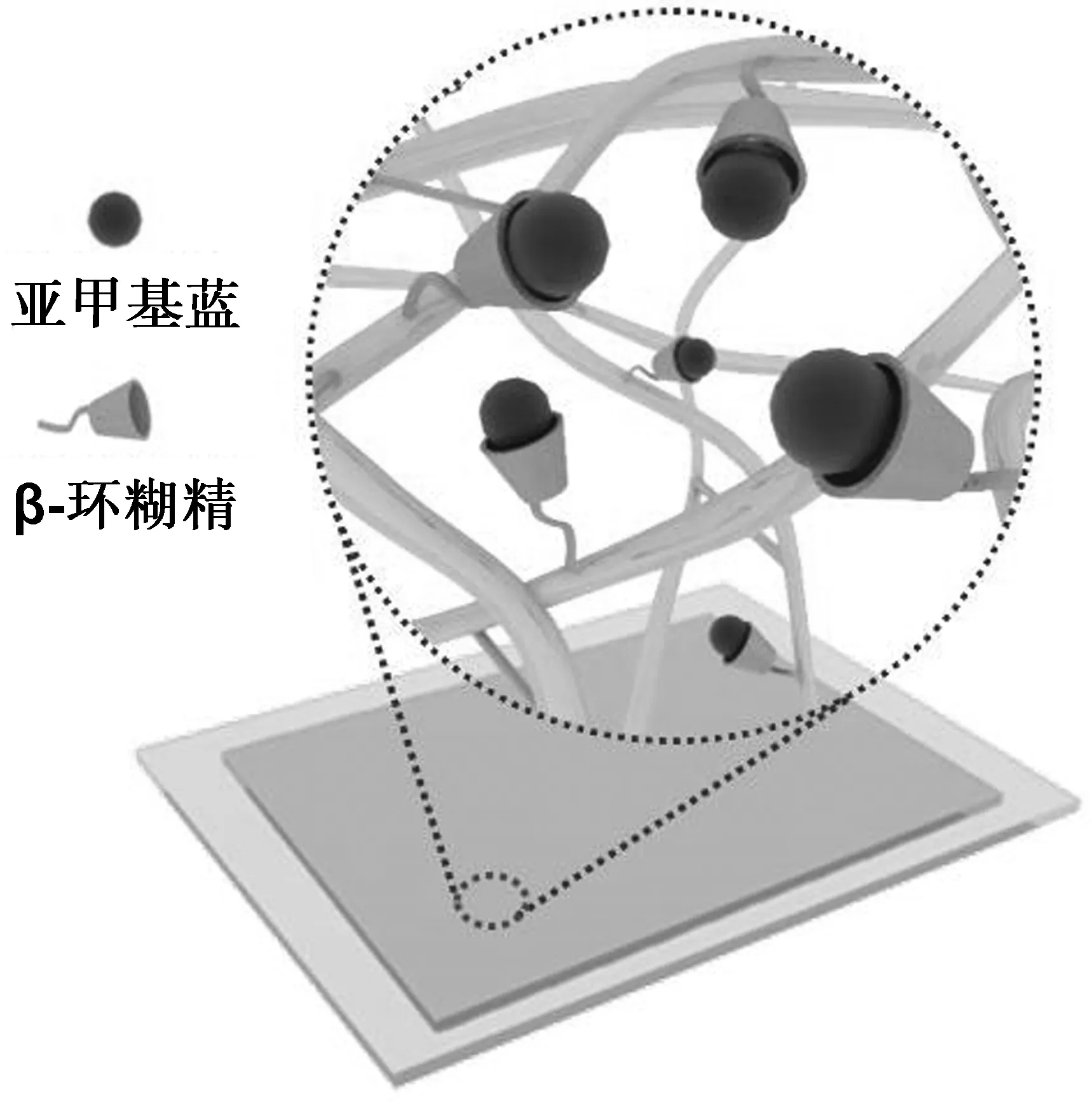
图5 基于主客体作用构建光动力抗菌涂层[65]
一些光敏剂具有羧基、氨基等基团,可以通过化学键合的方法固定在涂层上。Zhang等[66]将季铵盐基团和光敏剂原卟啉通过化学反应接枝在纤维素链上,从而获得具有光动力抗菌性能的聚合物CPS。随后,研究人员将CPS与少量戊二醛混合,可以通过喷涂的方式在不同的基底上制得稳定的光动力抗菌涂层。值得一提的是,由于季铵盐基团的静电排斥作用,原卟啉的聚集受到明显抑制,这有利于提高涂层的光动力抗菌效率。Wu等[67]利用壳聚糖分散并稳定光敏剂MoS2纳米片,制备得到复合材料CS@MoS2。随后在外加电场的辅助下,CS@MoS2与钛表面上的硅烷偶联剂发生化学反应从而形成复合抗菌涂层。
Felgentrager等[68]选择通过自聚合的方法获得光动力抗菌涂层。他们将商品化的液体聚氨酯与含羟基的四苯基卟啉(TPP-OH)混合,将混合液体喷涂在聚合物基底表面。液体聚氨酯中大量的异氰酸酯基团可与TPP-OH发生反应,从而自聚合形稳定的光动力抗菌涂层。这种自聚合的方法可抑制光敏剂的自聚集和1O2的自淬灭,提高了涂层的光动力抗菌效率。
聚多巴胺同样可用于光动力抗菌涂层的构建。Xu等[69]成功合成出含光敏剂曙红Y的阳离子型抗菌聚合物。此聚合物含多种基团,可实现涂层的制备和多功能化。其中,伯胺基团可以与聚多巴胺发生化学反应,使得聚合物可在聚多巴胺改性的表面上形成涂层;聚合物上的季铵盐基团和光敏剂具有明显的协同抗菌活性,在520 nm激光照射下,涂层对金黄色葡萄球菌和大肠杆菌均表现出优异的抗菌功效;聚合物侧链上的羟基使得涂层具有良好的抗粘附性能,同时也使涂层表现出优异的生物相容性。
4 光介导协同抗菌涂层
将不同抗菌方法结合在一起,发挥协同抗菌作用,是抗菌涂层的发展趋势之一。Luan等[70]将抗粘附策略与光动力抗菌疗法结合,构建了超疏水与光动力协同的抗菌织物。这种材料表面具有微纳结构,并化学接枝疏水性光敏剂Ce6,使得材料表面可有效抑制细菌粘附,并在光照条件下快速杀灭细菌。Nie等[71]在氧化石墨烯上原位沉积银纳米粒子,获得复合抗菌纳米材料,随后利用层层自组装的方法制备出了具有较好生物相容性的抗菌涂层(PES-(Ag@G-SAS)3/G-SAS)。抗菌实验结果表明,近红外光照射下,涂层可杀灭表面上所有细菌,并且抗菌效果明显优于在暗处的涂层。因此氧化石墨烯的光热效应有效提升了涂层的抗菌效率,银纳米粒子则使得涂层可长期发挥抗菌作用。
研究人员也将光热和光动力抗菌疗法相结合,探究了两种光介导抗菌疗法协同作用的可能性。由于光动力治疗所用的光源大多与光热治疗不同,常常需要两种光源共同作用,这一过程较为复杂。Zhao等[72]将光敏剂二氧化钛与光热转化剂氧化石墨烯相结合,通过静电纺丝技术制备出协同抗菌纤维膜。在上转换纳米粒子的作用下,只需980 nm激光照射即可同时激发纤维膜的光动力和光热抗菌性能。
也可将其他功能性分子引入协同抗菌涂层当中。Cai等[73]将聚多巴胺、光敏剂吲哚菁绿(ICG)和功能性多肽RGD肽结合,利用聚多巴胺共沉积的方法在金属钛表面构建了多功能协同抗菌复合涂层,如图6所示。PDA在光照下产生局部高温,从而杀灭细菌;高温还可以促进ICG的释放,利于光敏剂发挥作用。ICG在光照条件下产生活性氧,可有效破坏菌膜结构,进一步增强光热抗菌效果。RGD肽的引入则有效促进了细胞在涂层的粘附与增值,提高了涂层的生物相容性。

图6 Ti-M/I/RGD在体内通过PDT/PTT协同清除金黄色葡萄球菌生物被膜[73]
5 结 语
细菌在植/介入医用装置表面的定植是医源性感染的重要组成部分,已经成为全球性的重大公共卫生问题。在医用装置表面构建抗菌涂层是最有效和最实用的方法之一。光介导抗菌疗法灵活可控,具有广谱抗菌特性,且不易引起细菌耐药性,是一种极具潜力的抗菌方法。因此,构建光介导抗菌涂层是在解决医源性感染问题上具有的巨大潜力。现有研究主要集中在光热抗菌涂层和光动力抗菌涂层领域。
研究人员通过化学键合和非共价键相互作用实现了光热转化剂和光敏剂的负载,从而赋予材料光介导抗菌性能。其中光动力抗菌涂层上光敏剂的聚集问题会对涂层的效率造成严重影响,因此这一问题不容忽视。进一步在涂层上负载其他功能性分子,可实现光介导抗菌涂层的智能化和多功能化。不同抗菌方法的协同有利于提高抗菌涂层的抗菌效率、使用期限和实际应用价值,是未来抗菌涂层领域的发展趋势。

