氧糖剥夺再灌注对小鼠小胶质细胞炎症反应的影响
周天恩 谭笑杏 蒋龙元
缺血性脑损伤通常是由突然的血液供应阻断所致,导致大脑组织的氧气和葡萄糖供应减少。炎症反应在缺血缺氧性脑损伤的病理生理中起关键作用,而抑制炎性反应可以改善神经功能结局[1]。小胶质细胞是中枢神经系统中的主要免疫细胞,缺血后小胶质细胞迅速活化,促成炎症反应[2]。本研究采用体外培养的BV2 小鼠小胶质细胞细胞系制作氧糖剥夺再灌注(OGD/R)模型模拟体内脑卒中损伤,观察不同时长OGD/R 后小胶质细胞的形态学改变,探讨OGD/ R 对小胶质细胞炎症反应的影响。
1 材料及方法
1.1 细胞、试剂、仪器(1)细胞BV2 永生化的鼠小胶质细胞由中国医学科学院(中国)细胞培养中心提供。(2)试剂DMEM/F12 培养基(美国Gibco 公司),胎牛血清(美国Gibco 公司),EBSS 平衡盐溶液(中国solarbio 公司);白细胞介素-1β(IL-1β)ELISA 试剂盒(美国Thermo Fisher Scientific 公司),肿瘤坏死因子-α(TNF-α)ELISA 试剂盒(美国Thermo Fisher Scientific 公司),白细胞介素-6(IL-6)ELISA 试剂盒(美国Thermo Fisher Scientific 公司)。(3)酶标仪(DiatekDR-200Bs)、IX73 倒置荧光显微镜(日本OLYMPUS 公司)。
1.2 方法(1)细胞培养复苏冻存的BV2 小胶质细胞,用含10%胎牛血清的DMEM/F12 重悬后将细胞接种至T25 细胞培养瓶中,在37°C 的普通培养箱(37℃,19%O2,5%CO2)中培养。待细胞长满后,以1×106细胞/皿的细胞数接种至直径60 mm 的培养皿中,培养24 小时后分别进行OGD 处理。我们研究中所用的所有细胞培养试剂已在以往的研究中被证明有效[3,4]。(2)实验分组及氧糖剥夺及再灌注模型(OGD/R)的建立将实验细胞随机分为4组(n=6):空白对照组、氧糖剥夺(OGD)2 h、OGD4h、OGD6h。预先调设三气细胞培养箱至缺氧状态(37℃,0.1%O2,5%CO2,94.9%N2),从普通培养箱中取出BV2 小胶质细胞,将原培养基用EBSS 洗涤后更换为EBSS 培养以模拟小胶质细胞缺血,并置于缺氧培养箱内培养,以此建立小胶质细胞OGD 模型,模拟小胶质细胞缺血、缺氧损伤。细胞OGD 不同时间培养之后换回原培养基,换回原培养基,重新置于普通培养箱,复糖、复氧24h 后观察及处理送检。(3)小胶质细胞形态学观察于倒置荧光显微镜下观察OGD 不同时间后小胶质细胞形态学改变。
1.3 炎性因子的测定Elisa法检测OGD不同时间后小胶质细胞上清液中炎性因子IL-1β、IL-6、TNFα的含量。取细胞培养上清,2000r/min离心20min,仔细收集上清。严格按照ELISA 试剂盒说明书操作,检测细胞上清中IL-1β、IL-6、TNF-α的含量。
1.4 统计分析所有数据应用SPSS 13.0 软件进行统计分析。所有计量资料以(±s)来表示,采用单因素方差分析的统计方法,先行方差齐性检验,方差齐时采用LSD 检验,方差不齐时采用Dunnett T3 检验,P<0.05 认为差异具有统计学意义。
2 结 果
2.1 不同时长OGD/R 后小胶质细胞形态学改变倒置荧光显微镜下观察未进行OGD/R 处理的小胶质细胞生长良好,细胞呈细长或椭圆,从胞体发出细长而有分枝的突起,细胞形态正常。OGD/R 后小胶质细胞损伤明显,OGD 2h 后复糖复氧主要表现为部分细胞分枝剥离消失,细胞固缩,OGD 4h 后复糖复氧细胞突触剥离消失较OGD 2h明显且固缩更为严重,受损细胞数目也更多,OGD 6h 后复糖复氧与前两组比较出现更为明显且范围更广的突触剥离及细胞固缩等结构破坏,出现较多细胞死亡(见图1)。
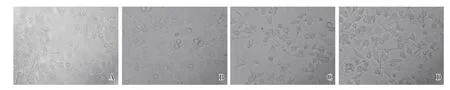
图1 倒置荧光显微镜观察小胶质细胞不同时长OGD 后形态学改变。对照组(A)小胶质细胞生长良好,细胞呈细长或椭圆,从胞体发出细长而有分枝的突起,细胞形态正常。OGD 2h 组(B)部分细胞分枝剥离消失,细胞固缩。OGD 4h 组(C)细胞突触剥离消失较OGD2h 明显且固缩更为严重,受损细胞数目也更多。OGD 6h 组(D)出现更为明显且范围更广的突触剥离及细胞固缩等结构破坏,出现较多细胞死亡。
2.2 ELISA 方法检测不同时长OGD/R 后小胶质细胞炎症因子分泌见表1。
表1 各组细胞上清液炎症因子IL-1β、IL-6、TNF-α表达比较(±s,n=6)
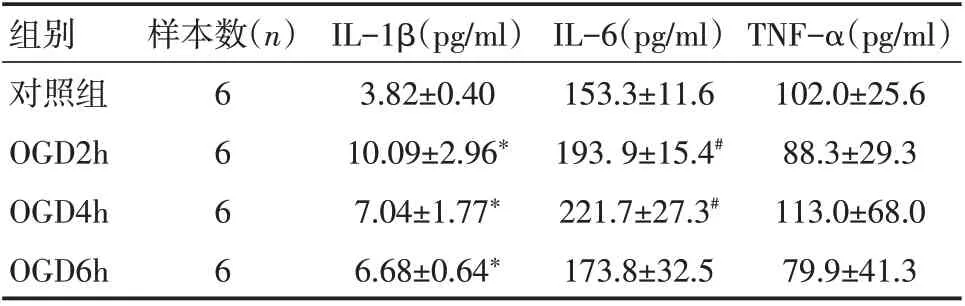
表1 各组细胞上清液炎症因子IL-1β、IL-6、TNF-α表达比较(±s,n=6)
注:OGD 为氧糖剥夺;与对照组比较,*P<0.05,#P<0.01。
组别对照组OGD2h OGD4h OGD6h TNF-α(pg/ml)102.0±25.6 88.3±29.3 113.0±68.0 79.9±41.3样本数(n)6 6 6 6 IL-1β(pg/ml)3.82±0.40 10.09±2.96*7.04±1.77*6.68±0.64*IL-6(pg/ml)153.3±11.6 193.9±15.4#221.7±27.3#173.8±32.5
3 讨 论
免疫应答和诱发的炎症在缺血性脑损伤中起关键作用[5,6]。卒中急性期的白细胞介素-1(IL-1)可以激活小胶质细胞并募集炎性细胞以传播炎症,这可能导致卒中后细胞损伤及死亡[7]。小胶质细胞是大脑中的主要免疫细胞,在缺血性卒中后数小时内被激活,并产生细胞因子和趋化因子[8]。有研究表明,小胶质细胞与神经元的相互作用是缺血性脑损伤的最重要因素之一[5]。因此,小胶质细胞通常用于研究缺血性卒中方面的炎症反应。而对于缺血后小胶质细胞产生促炎因子的干预或许能成为缺血性脑损伤保护神经元的新方法。
体外小胶质细胞氧糖剥夺再复糖、复氧是模拟体内脑缺血再灌注损伤后炎症反应的模型之一。在这一模型中,氧糖剥夺的时间是关键,氧糖剥夺时间太长,小胶质细胞容易死亡;反之,氧糖剥夺时间太短,则可能无法有效地诱导小胶质细胞产生炎症反应。因此,对于氧糖剥夺再灌注后小胶质细胞炎症反应的相关研究是很有必要的,其中氧糖剥夺的时间窗是关键的研究要点,是后续研究小胶质细胞炎症反应机制的基础。
小胶质细胞在不同的条件下会分化成不同的亚型,即M1 和M2 型M1 型主要表达IL-1β、IL-6以及iNOS 等致炎因子,从而诱发炎症反应,导致组织损伤;而M2 型主要表达TGF-13、IL-10 等因子,其主要起免疫保护作用。在这项研究中,我们通过构建体外氧糖剥夺再灌注模型(OGD/R),观察到OGD/R 后小胶质细胞形态学的改变是随着OGD 时间的延长而逐渐加重的,主要表现为细胞突触剥离及固缩死亡。OGD 6 小时后小胶质细胞出现明显的损伤,甚至大量死亡,而OGD 2 小时细胞损伤轻微,说明合适的OGD 时间是至关重要的。我们进一步研究揭示了不同时长OGD 后复糖复氧均可诱导小胶质细胞的炎症反应,发现在OGD 2h 后小胶质细胞的炎症反应已被激活,此时炎症因子IL-6,IL-1β 分泌明显增加,OGD 6h 后因小胶质细胞不能耐受长时间的缺氧缺糖而大量死亡,故炎症因子的分泌反而急剧减少。我们的研究表明,OGD 可诱导小胶质细胞分化为M1 型,并分泌IL-1β?IL-6,导致炎症反应的发生。另外,我们发现小胶质细胞经过不同时长OGD 后均未见TNF-α 表达升高,说明小胶质细胞激活后并不增加TNF-α 的分泌,TNF-α 并不在OGD 诱导的小胶质细胞炎症反应中起作用。该结果提供了可靠的证据,表明OGD 可以在体外较好地诱导出炎症,同时结合小胶质细胞的形态学改变,我们认为OGD2 小时对小胶质细胞的损伤较少,而且能有效地诱导炎症反应,故推荐在体外OGD 模型研究中,OGD 的时长采用2 小时为宜。
综上所述,氧糖剥夺2-4 小时后再复糖复氧能较好地在体外诱导小胶质细胞炎症反应,且细胞损伤较少。这对于我们后续选择其他干预措施控制神经炎症及对缺血性脑损伤中神经元保护的研究具有重要参考意义。

