吡西达替尼抑制NLRP3通路保护脑缺血后神经功能的恢复
杜小雪 邹阳 方马荣
缺血性脑卒中(cerebral ischemic stroke)是临床上常见的神经系统疾病之一,可引起脑内胶质细胞免疫应答和急剧的炎症反应。小胶质细胞是卒中后炎症反应最主要的细胞来源。NLRP3 是NOD 样炎症小体,在脑内参与调控小胶质细胞集落因子1 受体(CSF1R)介导的下游炎症反应,并催化促炎因子释放,加重神经损伤[1]。因此寻找抑制NLRP3 的抗炎药物对缓解脑缺血患者体内炎症和神经损伤具有重要作用。吡西达替尼(Pexidartinib)是一种新型口服小分子酪氨酸激酶抑制剂,对CSF1R 具有较强的选择抑制性。被报道作为临床抗癌前期实验药物用于腱鞘巨细胞肿瘤的Ⅰ期、Ⅲ期治疗等[2]。本研究主要从NLRP3 信号通路探究吡西达替尼对脑缺血小鼠抗炎机制的影响。
1 材料与方法
1.1 动物 雄性C57/B6J 小鼠50 只,体质量25~30g,清洁级,8 周龄。所有小鼠购自中科院上海实验动物中心/上海斯莱克实验动物有限公司,小鼠的饲养与实验操作均于浙江大学动物实验中心完成。
1.2 药物 实验用药品吡西达替尼Pexidartinib,又称PLX-3397,购自MCE 公司,目录号为HY-16749,并溶解于DMSO 溶液中至10mg/ml 备用。
1.3 试剂和仪器 抗Iba1 抗体购自Abcam 公司(兔抗,批号ab178847);抗NLRP3 抗体购自Abcam 公司(兔抗,批号ab214185);抗Caspase1 抗体购自Abcam公司(兔抗,批号ab179515);抗NF-κB 抗体购自Abcam 公司(兔抗,批号ab16502);超敏酶标羊抗兔抗体来自于北京中杉生物公司(批号107257D9);荧光羊抗兔抗体来自武汉博士德公司(批号BA1142);RNA 提取试剂盒购自TaKaRa 公司(批号AK1401);SYBR PremixEx TaqTMII 购 自TaKaRa 公 司( 批 号AKA1201);PrimeScriptTMRT Master Mix 购 自TaKaRa公司(批号AK5101)。冰冻切片机来自德国LAIKA 公司;Olympus BX53 手动正置荧光显微镜来自Olympus公司;Bio-Rad 化学发光成像仪来自杭州宝诚生物技术有限公司;吸入麻醉机来自深圳瑞沃德公司。
1.4 实验方法 (1)动物分组。实验动物分组,将大鼠随机分为5 组,每组各10 只:①正常组;②假手术组;③DMSO 组;④脑缺血组;⑤吡西达替尼组。(2)造模。小鼠局灶性脑缺血-再灌注损伤模型参照Coll 等[3]的方法建立。具体操作过程如下:小鼠称重,腹腔注射5%戊巴比妥钠(5ml/kg)麻醉。仰卧固定后,颈部正中纵切口,分离并暴露右侧颈总动脉(CCA),颈外动脉(ECA)和颈内动脉(ICA)。结扎CCA 近心端和ECA 基底部,CCA 处剪口,用直径为0.3mm 的线栓插入右CCA 管腔,并缓慢前进至ICA 远端直至不能推进为止,约7mm。缺血90min 后缓慢将线栓拉出并结扎CCA 远端,形成再灌注损伤。缝合切口,术毕。放回笼内,单笼饲养。小鼠苏醒后左上肢屈曲、行走时左侧旋转或左侧肢体瘫痪的小鼠为堵塞成功。假手术组大鼠只分离、暴露血管,不结扎CCA 及ECA,不插入线栓。吡西达替尼组,术后连续给予吡西达替尼腹腔注射(1mg/kg)7d。DMSO 组小鼠腹腔注射与吡西达替尼组等体积的DMSO 溶剂。
1.5 神经症状评分 参照Longa 的方法进行评分。评分标准:0 分为无明显神经功能缺损症状;1 分为不能完全伸展左侧前爪;2 分为向左侧旋转;3 分为行走时向左侧倾倒;4 分为不能自行行走,意识障碍。采用双盲方式对小鼠术后行为进行评估。
1.6 标本和检测指标 麻醉所有小鼠,将每组3 只小鼠的大脑进行冰冻切片包埋。对冰冻标本进行Iba1免疫荧光检测,观察脑缺血后大脑皮层中Iba1 表达的改变。每组4 只小鼠大脑皮层组织用于实时荧光定量多聚核苷酸链式反应(QPCR)检测(TaKaRa 公司RNA 提取试剂说明书,提取组织中的总RNA 进行逆转录,并测定mRNA 的表达量),观察小胶质细胞相关炎症因子TNF-α、IL-10、Arg1 和iNOS 的表达。引物序列见表1。剩下每组3 只小鼠大脑皮层组织用于Western Blot,观察NLRP3、NF-κB 和活化的Caspase1 的蛋白表达变化。

表1 TNF-α、IL-10、Arg1、iNOS和β-Actin的引物序列
1.7 统计学方法 采用SPSS 19.0 统计软件。计量资料以(±s)表示,对于属于正态分布的五组数据应用单因素方差分析比较,并进行两两比较的q 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 吡西达替尼缓解脑缺血小鼠神经功能损伤 神经症状评分能够评估各组小鼠的神经行为功能情况。评分越高,神经损伤越严重。对照组和假手术组神经功能评分为0,说明这两组小鼠无损伤;脑缺血组和DMSO 组小鼠神经功能损伤显著,分别为(3.33±0.51)分和(3.16±0.75)分,与正常组比较,P<0.001;吡西达替尼组神经功能损伤明显减轻为(1.83±0.75)分,与脑缺血组和DMSO 组比较差异有统计学意义(P<0.001)。
2.2 吡西达替尼减少脑缺血再灌注小鼠大脑皮层Iba1的表达 免疫荧光检测小胶质细胞标志蛋白Iba1 在吡西达替尼治疗前后的表达变化(见图1)。统计结果显示,与假手术组和对照组比较,脑缺血组和DMSO 组的Iba1 表达显著增加(P<0.001)。相对于脑缺血组,吡西达替尼组的Iba1 表达降低(P<0.01)(见表2)。结果表明,吡西达替尼能够有效地抑制小胶质细胞标志蛋白Iba1 的表达。
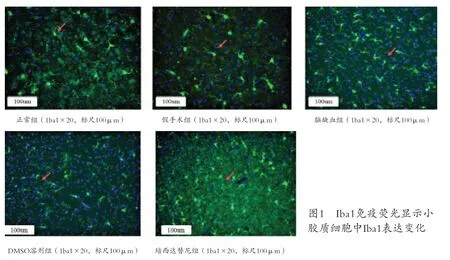
表2 各组小鼠大脑皮层Iba1表达比较(±s)

表2 各组小鼠大脑皮层Iba1表达比较(±s)
注:与正常组比较,*P<0.001;与脑缺血组比较,#P<0.01
组别 正常组 假手术组 脑缺血组 DMSO 组 吡西达替尼组Iba1 表达 1.01±0.41 1.10±0.30 2.70±0.14* 2.40±0.17 2.10±0.23#
2.3 吡西达替尼治疗能够抑制脑缺血后小胶质细胞相关炎症因子的表达 通过QRT-PCR 法观察脑缺血后小鼠大脑皮层小胶质细胞相关炎症TNF-α、iNOS、IL-10、Arg-1 的表达变化。结果表明,与对照组比较, 脑 缺 血 组TNF-α、iNOS、IL-10、Arg-1 因 子的mRNA 表达显 著 增 加(P<0.01、P<0.001)。相 对于脑缺血组,吡西达替尼组TNF-α、iNOS、IL-10、Arg-1 因子的mRNA 表达显著降低(P<0.05、P<0.01、P<0.001)(见表3)。结果表明,吡西达替尼通过抑制小胶质细胞相关因子TNF-α、iNOS、IL-10、Arg-1的表达而发挥保护神经细胞的作用。
表3 各组小鼠大脑损伤部位TNF-α、iNOS、IL-10和Arg-1mRNA表达比较(±s)

表3 各组小鼠大脑损伤部位TNF-α、iNOS、IL-10和Arg-1mRNA表达比较(±s)
注:与正常组比较,*P<0.01,#P<0.001;与脑缺血组比较,▲P<0.05,△P<0.01,△△P<0.001。TNF-α:肿瘤坏死因子α;iNOS:诱导型一氧化氮合酶;IL-10:白介素10;Arg-1:精氨酸酶1
组别 正常组 假手术组 脑缺血组 DMSO 组 吡西达替尼组TNF-α 4.29±1.14 4.83±0.64 9.49±0.45# 10.21±1.14 7.04±0.50 △△iNOS 2.62±0.94 2.50±0.45 6.49±0.45# 6.88±0.41 4.70±0.77 △IL-10 1.23±0.21 1.17±0.16 2.43±0.11* 2.40±0.10 1.91±0.06 ▲Arg-1 1.80±0.17 1.89±0.25 3.43±0.10* 3.40±0.12 2.01±0.02 △△
2.4 吡西达替尼抑制脑缺血组NLRP3 信号通路 Western Blot 结果显示,在假手术组和对照组小鼠中,NLRP3、NF-κB 和Caspase1 低表达。脑缺血组和DMSO 组NLRP3、NF-κB 和活化的Caspase1 蛋白表达水平显著升高(P<0.01)。与脑缺血组和DMSO组比较,吡西达替尼组NLRP3、NF-κB 和活化的Caspase1 蛋白表达显著降低(P<0.01、P<0.001)(见图2、表4)。
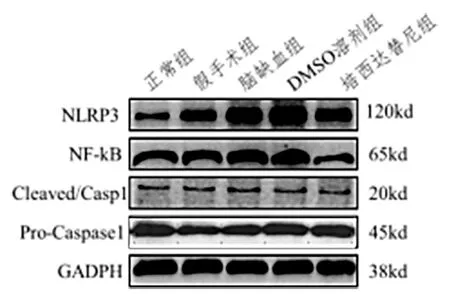
图2 各组NLRP3,NF-κB和活化的Caspase1蛋白表达图
表4 各组小鼠大脑皮层NLRP3、NF-κB和活化的Caspase1蛋白表达比较(±s)
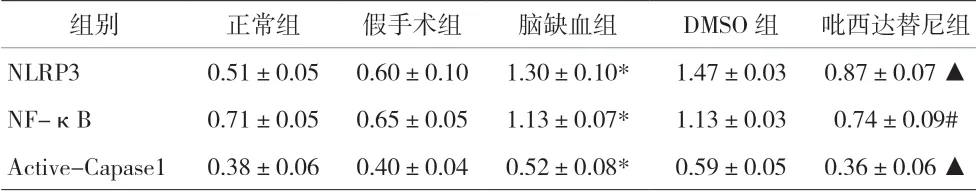
表4 各组小鼠大脑皮层NLRP3、NF-κB和活化的Caspase1蛋白表达比较(±s)
注:与正常组比较,*P<0.001;与脑缺血组比较,#P<0.01,▲P<0.001。NLRP3:NOD样受体蛋白3;NF-κB:核因子κB蛋白;Active-Capase1:活化的含半胱氨酸的天冬氨酸蛋白水解酶1
组别 正常组 假手术组 脑缺血组 DMSO 组 吡西达替尼组NLRP3 0.51±0.05 0.60±0.10 1.30±0.10* 1.47±0.03 0.87±0.07 ▲NF-κB 0.71±0.05 0.65±0.05 1.13±0.07* 1.13±0.03 0.74±0.09#Active-Capase1 0.38±0.06 0.40±0.04 0.52±0.08* 0.59±0.05 0.36±0.06 ▲
3 讨论
吡西达替尼是集落刺激因子1 受体(CSF1R)的特异性抑制剂,通过抑制CSF1R 的磷酸化,对小胶质细胞的活性有重要作用。2014 年,吡西达替尼被美国食品和药物管理局(FDA)授予用于治疗色素沉着的绒毛结节性滑膜炎(PVNS)和腱鞘巨细胞肿瘤的临床研究[4]。本次研究首次在基础研究中证实吡西达替尼能显著抑制NLRP3 炎症通路,在脑缺血再灌注小鼠中实现神经保护作用。
胶质细胞免疫治疗是治疗脑卒中的新趋势。脑卒中发生后,机体自身的免疫系统会被激活进而通过免疫细胞如小胶质细胞、星形胶质细胞等的调节作用抵御损伤部位氧糖缺失[5]。同时炎症反应促使机体释放大量的TNF-α 和iNOS[6]。TNF-α 的过度表达会加重脑损伤。iNOS 表达的上调,使一氧化氮(NO)合成分泌增加,促进小胶质细胞向损伤部位聚集,进一步加重脑的损伤[7]。CSF1R 表达聚集,促进小胶质细胞形态转变,释放IL-10 和Arg1 因子,不利于患者预后。在本研究中,小鼠局灶性脑缺血损伤诱导TNF-α 和iNOS 的mRNA 表达显著增加,小胶质细胞聚集,催化Iba1 表达增加和IL-10 和Arg1 释放。而吡西达替尼能够有效降低小胶质细胞Iba1 表达,并抑制TNF-α 和iNOS 的mRNA 表达以及IL-10 和Arg1 释放,抑制局部炎症。
小胶质细胞依赖的CSF1R 炎症激活在神经免疫中起重要作用,尤其是NLRP3 炎性小体介导炎症反应[3]。NLRP3 是NOD 样受体3,能被机体各种内外源性危险信号激活后,通过活化半胱天冬酶-1(Caspase-1)进而促进 IL-1β、IL-18 的成熟和释放,引起机体的炎症反应[8]。既往的多项研究均发现,NLRP3 的激活能够增加促炎基因,包括NF-κB、iNOS、IL-10、TNF-α 和Arg-1 的 表 达[9]。本 研 究结果显示,吡西达替尼能够显著减少iNOS、IL-10、TNF-α 和Arg-1 在脑缺血组织的mRNA 表达,同时抑制NLRP3 炎症信号相关蛋白NF-κB、活化的Caspase1蛋白的表达,具有较强的抗炎和神经保护作用。
综上所述,吡西达替尼显著降低小胶质细胞相关炎症因子的mRNA 表达,抑制NLRP3 炎症信号通路的激活,进而减少局灶性脑缺血后的小胶质细胞Iba1的表达,降低神经功能评分,促进脑缺血小鼠神经功能恢复,进而实现神经保护作用。

