miR-124通过调控PI3K/Akt信号通路对人胃癌MGC803细胞增殖与凋亡的影响
罗远 蒋海忠
胃癌是全球高发的恶性肿瘤之一,据2015 年我国癌症中心统计,胃癌在恶性肿瘤死亡率排名第3 位[1-2]。近年来,microRNAs(miRNAs)作为肿瘤标志物,参与胃癌的发生发展、侵袭转移及化疗抵抗,受到学术界越来越多的关注[3]。据文献报道,miRNA 发挥癌基因和抑癌基因的功能,参与细胞增殖、凋亡和分化的调控,在肿瘤的发生发展过程中具有重要作用[4-5]。其中,miR-124 在多种肿瘤中发挥抑瘤基因的功能,如膀胱癌、肺癌、乳腺癌和前列腺癌[6-9]。有学者发现,miR-124 在胃癌细胞及组织中表达下调(包括人胃癌细胞MGC803),且在胃癌的发生发展中发挥重要调控作用[5,10]。但miR-124 对胃癌细胞MGC803 的生物学功能尚未深入。因此,本研究主要探讨miR-124 对人胃癌细胞MGC803 增殖、凋亡的影响,并进一步研究其调控PI3K/AKt 信号通路的作用机制。
1 材料和方法
1.1 材料 (1)细胞株:胃癌细胞MGC803 购自通派(上海)生物科技有限公司。(2)主要试剂:Trizol™ Reagent、Lipofectamine™ 2000 试 剂 均 购 自Invitrogen 公 司;SYBR Green qPCR Mix、4×Reverse Transcription Master Mix 均 购 自TaKaRa 公 司;CCK8试剂盒购自上海碧云天生物技术有限公司;TransWell小室购自上海子起生物科技有限公司;miR-124 模拟 物(miR-124 mimics)、 阴 性 对 照(mimics-NC)购自上海吉玛公司;胎牛血清购自美国PeproTech公司;DMEM 培养基购自美国Gibco 公司;PI3K、Akt、p-PI3K 和p-AKT 单 克 隆 抗 体、HRP 标 记 山羊抗兔IgG 二抗均购自美国Abcam 公司;引物均由上海生工生物工程公司设计合成(其中miR-124 引物 序 列:Forward:5'-GCTAAGGCACGCGGTG-3';Reverse :5'-GTGCAGGGTCCGAGGT-3' ;U6 :Forward:5'-GCTCGCTTCGGCAGCACA-3';Reverse:5'-AACGCTTCACGAATTTGCGT-3')。(3)主要仪器:1658033 小型蛋白垂直电泳转印系统(武汉科昊佳生物科技有限公司);ABI 7500 荧光定量PCR 仪(美国ABI 公司);美国SHELLAB 2406-2 CO2培养箱(美国SHELLAB 公司);CLARIOstar 全功能多功能酶标仪(德国BMG LABTECH 公司);凝胶成像系统(美国Bio-Rad 公司)。
1.2 方法 (1)细胞培养:将胃癌细胞MGC803 培养在含10%的胎牛血清的RPMI-1640 培养基中,置于37℃、5% CO2的细胞培养箱中培养,用于后续的实验。(2)细胞转染:分别设置miR-124mimics 组与阴性对照(miR-124NC)组,待MGC803 细胞培养至对数生长期时,使用胰酶消化细胞后,洗涤2遍后应用完全培养基将细胞调至3.0×106个/ml,取200µl 细胞液接种至corning 6 孔板中培养24h。分别向三个EP 管中加入5µl LipofectamineTM2000,5µl LipofectamineTM2000+ 阴 性 质 粒miR-124 NC,5µl LipofectamineTM2000+5µl miR-124 mimics,室温静置5min 后混合,加入不含血清的DMEM 培养基调整终体积至2ml,置于37℃、5% CO2、饱和湿度下培养6h后,更换完全培养基继续培养,完成MGC803 细胞转染,并继续扩大培养以用于后续实验。(3)RT-qPCR检测转染后细胞内miR-124 的表达:细胞转染成功后,采用RT-qPCR 技术检测细胞内miR-124 的表达。收集细胞后,PBS 洗涤2 遍,离心取细胞沉淀,按照Trizol™ Reagent 说明书提取胃癌细胞MGC803 的总RNA,依据4×Reverse Transcription Master Mix 试剂盒说明书将组织总RNA 逆转录为总cDNA,按照SYBR Green qPCR Mix 试剂盒说明书操作,以cDNA 为模板,进行荧光定量PCR 反应。反应条件:94℃ 2min,94℃20s,60℃ 30s,共40 个循环。以U6 为内参,miR-124 基因的相对表达量以2-ΔΔCt表示。(4)CCK8 检测细胞增殖水平:待转染后的MGC803 细胞生长至对数期时,使用胰酶消化细胞后,洗涤2 遍后应用完全培养基将细胞调至3.0×103个/ml,每孔(96 孔板)接种100µl 细胞液。分别培养24h、48h、72h,加入配置好的CCK8 试剂(10µl CCK8 试剂+90µl 完全培养基)孵育2h,采用酶标仪检测OD450 值。(5)细胞克隆实验:两组细胞以200 个/皿接种于60mm 的细胞培养皿(含10ml 培养液)中,置37℃、5% CO2的培养箱中孵育,2 周后肉眼可见细胞克隆的形成。小心吸弃培养液,用PBS 洗涤2 次,将两组细胞以4%的多聚甲醛固定15min,再用0.1%的结晶紫染色20min,用清水清洗染液并风干,于荧光显微镜下随机选取5 个视野统计形成的细胞克隆数(>50 个克隆数为有效克隆)。(6)流式细胞术检测细胞凋亡:消化MGC803 细胞后使用含血清DMEM 培养基将细胞浓度调至3×105个/ml,收集对数生长的各组细胞,据说明书进行操作,采用Annexin V/PI 凋亡试剂盒检测不同时间点各组细胞的凋亡率。其中,各组样品分别加入500µl Binding Buffer,5µl Annexin V,5µl PI,混匀,室温避光反应5~15min,用流式细胞仪检测细胞凋亡水平。(7)miR-124 对MGC803 细胞PI3K/Akt 信号通路的调控作用:按照1 ∶10(g/ml)的比例加入RIPA裂解液,按BCA 蛋白定量试剂盒说明书方法测定所提取的各组细胞的总蛋白含量,以确保每组样本之间的上样量相同。裂解、提取各组蛋白后,经SDS-PAGE电泳分离,转至硝酸纤维素(PVDF)膜,将转好的PVDF 膜于5%脱脂奶粉溶液中室温封闭2h,TBST 洗涤液漂洗3~4 次。加入一抗,4℃孵育过夜。再漂洗3~4 次,加入HRP 标记的二抗体,室温孵育2h,漂洗3~4 次。化学发光检测底物ECL 工作液显色,采用Image J 图像分析系统对蛋白显影图进行灰度分析,以β-actin 为内参,分析PI3K、Akt、p-PI3K 和p-AKT蛋白相对表达水平。再次收集MGC803 细胞后,PBS洗涤2 次,离心取细胞沉淀,按照Trizol™ Reagent 说明书提取miR-124mimics 组与miR-124 NC 组胃癌细胞MGC803 的总RNA,按细胞培养方法进行PCR 扩增,均以β-actin 为内参,分别检测PI3K、Akt 的mRNA水平。引物由上海生工生物工程公司设计提供,引物序列见表1。
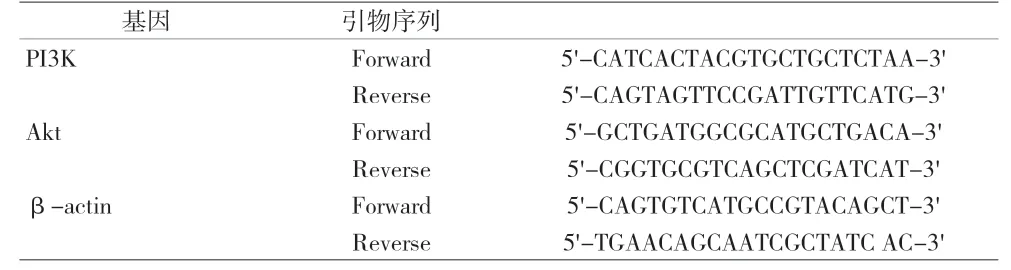
表1 PI3K/Akt信号通路关键基因引物序列
1.3 统计学方法 采用SPSS 17.0 统计软件。计量资料以(±s)表示,应用单因素方差分析和LSD-t 检验比较两组间各指标水平差异,P<0.05 为差异有统计学意义。
2 结果
2.1 转染后MGC803 细胞miR-124 的表达及其对细胞增殖的影响 MGC803 细胞转染miR-124 模拟物后,miR-124 的表达量为(4.15±0.18),显著高于miR-124NC 组(2.01±0.14)(t=17.984,P=0.006)。 转 染24h、4h 和72h 后,miR-124mimics 组 细 胞的OD450值分别为(0.46±0.09)、(0.86±0.08)和(1.08±0.13);其中,转染48h 和72h 后,miR-124mimics 组显著低于miR-124 NC 组 的(1.25±0.14) 和(1.72±0.17)(t=8.245,14.257,P=0.027、0.008),结果见图1。说明转染miR-124 后,人胃癌细胞MGC803 的增殖能力降低。

图1 miR-124对MGC803细胞增殖的影响
2.2 miR-124 对MGC803 细 胞 克 隆 实 验 miR-124 mimics 组细胞克隆形成数为(71.3±4.5),显著低于miR-124 NC 组(103.8±10.1),差异有统计学意义(t=9.450,P<0.001)。说 明 转 染miR-124 后MGC803细胞的克隆能力降低,进一步反映miR-124 可抑制人胃癌MGC803 细胞增殖。结果见图2。
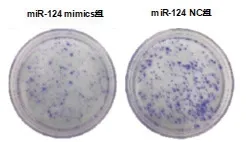
图2 miR-124对胃癌MGC803细胞克隆的影响
2.3 miR-124 对MGC803 细胞凋亡的影响 细胞转 染24h、48h 和72h 后,miR-124mimics 组 细 胞凋 亡 率 分 别 为(12.70±5.14)、(51.80±8.14)% 及(70.40±7.14)%。其中细胞转染后48h 和72h 的细胞凋亡率显著高于miR-124 NC 组的(24.81±7.41)%和(33.21±8.29)%,差异具有统计学意义(t=17.565、18.147,P=0.007、0.005),结 果 见 图3。提 示 转 染miR-124 后MGC803 细胞凋亡率提高,且凋亡率随时间而不断增高。
2.4 miR-124 对MGC803 细胞PI3K/Akt 信号通路的影响 细胞转染后,miR-124 mimics 组PI3K/Akt 信号 通 路 中 关 键 靶 点PI3K、Akt、p-PI3K 和p-AKT蛋白相对表达分别为(0.87±0.05)、(0.95±0.11)、(0.89±0.09) 和(0.91±0.10), 均 显 著 低 于miR-124 NC 组(1.25±0.13)、(1.34±0.08)、(0.95±0.12)和(1.12±0.09)(t=13.542、15.224、4.159、12.357,P=0.007、0.008、0.035、0.006)。 同 时,miR-124 mimics 组PI3K/Akt 信号通路中PI3K 及Akt 基因相对表达分别为(0.73±0.08)和(0.64±0.11),均显著低于miR-124 NC 组(0.87±0.15)和(0.94±0.10)(t=8.365、10.324,P=0.007、0.009)。提示miR-124 可抑制胃癌细胞MGC803 的PI3K/Akt 信号通路。结果见图4。
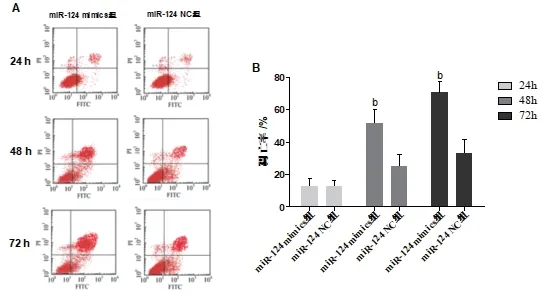
图3 miR-124对MGC803细胞凋亡的影响

图4 miR-124对MGC803细胞PI3K/Akt信号通路的影响
3 讨论
目前,胃癌已成为我国发病率和病死率最高的常见恶性肿瘤之一[11],据统计我国每年胃癌新发患者达70 万人[12]。由于胃癌的发病隐匿及诊断水平限制,多数胃癌患者在确诊时已经发展为中晚期,失去了手术机会,即使早期胃癌患者在接受手术治疗后仍有可能发生局部 复发或远处转移,导致治疗失败。故寻找新的药物靶点已成为近年来的研究热点,为胃癌的治疗寻找新的突破。近年研究表明miRNA 可通过调控细胞增殖、凋亡和分化,促进或抑制肿瘤的恶性表型,相比正常细胞,肿瘤组织中miRNA 存在异常表达,这些异常表达的miRNA 在肿瘤形成中可能扮演重要角色,可作为生物学特性、肿瘤病因学、组织分型和临床分级分期的分子标志物[13]。
miRNA 是一类微小非编码RNA,其长约20~22个核苷酸[11]。在众多miRNAs 中,miR-124 是一种新发现与胃癌有关的miRNA,与胃癌发生发展有密切关系[5,10]。据文献报道,miR-124 在多种肿瘤包括消化系统肿瘤的细胞或组织中均表达下调。Xie 等[14]研究发现,通过上调miR-124 表达水平,高浓度的miR-124 不仅可抑制胃癌细胞增殖,还可促进胃癌细胞凋亡的作用;同时发现,与5-氟尿嘧啶联合使用后,miR-124 对胃癌细胞的抑制作用更加明显,这为miR-124 作为胃癌治疗的潜在药物靶点提供了有力的证据。但目前国内关于miR-124 与胃癌发生发展及相关机制的研究报道较少。基于此,本研究成功将miR-124 转染至人胃癌MGC803 细胞中,并进一步考察miR-124 对胃癌细胞MGC803 增殖及凋亡的影响,结果显示miR-124mimics 组中细胞的miR-124 高表达;转染48h 后miR-124mimics 组MGC803 细胞的增殖较miR-124 NC 组显著降低;同时流式细胞术结果显示,miR-124 mimics 组MGC803 细胞凋亡率较miR-124 NC 组显著提高。由此可见,miR-124 可抑制胃癌细胞MGC803 增殖并促进MGC803 细胞凋亡。
为了进一步探讨miR-124 对人胃癌细胞MGC803增殖及凋亡的作用机制,本研究采用Western blotting法和RT-qPCR 法测定PI3K/Akt 信号通路关键靶点蛋白和mRNA 水平。研究证实,PI3K/Akt 信号通路参与调节细胞的增殖、凋亡等重要活动,其调控的失衡与多种肿瘤的发生、发展及耐药密切相关,已成为值得深入研究的治疗靶点[15]。Akt 蛋白处于PI3K/AKt 信号通路的中心位置,经磷酸化后被激活形成p-AkT,后者进一步使多个Akt 下游蛋白发生磷酸化(包括PI3K 等),从而调控肿瘤细胞的增殖与凋亡等[16]。有学者分别检测胃癌干细胞和胃癌细胞中PI3K、Akt 的表达,发现胃癌干细胞中PI3K、Akt 蛋白与mRNA 的表达明显高于胃癌细胞,推测PI3K/Akt 信号通路与胃癌进展密切相关[17]。本研究考察了miR-124 对人胃癌MGC803 细胞PI3K、Akt、p-PI3K 和p-Akt 蛋白表达及PI3K、Akt 基因水平,发现miR-124mimics 组上述蛋白及基因表达均较miR-124NC 组显著降低。提示miR-124 可抑制PI3K/Akt 信号通路,从而促进人胃癌MGC803 细胞凋亡,并抑制细胞增殖,与文献报道一致[16,18]。
综上所述,miR-124 可抑制人胃癌细胞MGC803的增殖,提高其细胞凋亡,其可能机制与抑制PI3K/Akt 信号通路表达有关。本研究可为胃癌的诊断与基因治疗提供参考。

