长期口服抗血小板药物合并急性硬膜下血肿的临床分析
张永明 赵鹏程 武孝刚 黄振山 许少年 马涛
近年来,由于抗血小板药物如阿司匹林、氯吡格雷等在心脑血管疾病中的广泛应用,出现大量需长期口服抗血小板治疗的患者,此类患者合并多脏器出血的风险较高[1]。若长期口服抗血小板药物的患者发生了脑外伤,尤其是重型颅脑损伤(severe trauma brain injury,sTBI),是否会对颅脑损伤手术及预后产生影响,目前尚未形成共识。而急性硬膜下血肿(acute subdural hematoma,ASDH)为sTBI 的常见类型,占创伤性颅内血肿的40%左右[2,3]。本文回顾性分析解放军联勤保障部队第九〇一医院神经外科自2018 年1 月至12 月收治的67 例外伤性ASDH患者的病例资料,旨在研究长期口服抗血小板药物对外伤性ASDH 患者的影响及治疗策略,现报道如下。
资料与方法
一、一般资料
本组67 例ASDH 患者中,男性36 例,女性31例;年龄范围35~78 岁,年龄(58.5±4.9)岁;基础疾病:高血压病34 例,糖尿病17 例,颈动脉狭窄10例,冠心病18 例,脑供血不足9 例,脑梗死10 例。受伤原因:交通事故伤28 例、自行摔伤17 例、高处坠落伤12 例、打击伤6 例,其他4 例。术前患者GCS 评分为3~9 分,平均7.3 分。其中口服阿司匹林(拜阿司匹林0.1 g,口服,1 次/d)20 例,为单抗组;口服阿司匹林+氯吡格雷(拜阿司匹林0.1 g,口服,1次/d;氯吡格雷75 mg,口服,1 次/d)12 例,为双抗组;服用抗血小板药物均在3 个月以上。未服用抗血小板药物者35 例,为对照组。3 组患者的性别、年龄、血肿量、术前GCS 评分等方面差异无统计学意义(P>0.05,表1)。本研究已通过医院临床医学伦理委员会批准,所有患者及家属均签署知情同意书。
纳入标准:(1)明确外伤史,且受伤至入院时间<24 h;(2)CT 示存在ASDH;(3)需急诊行手术治疗。排除标准:(1)合并明显硬膜外血肿、蛛网膜下腔出血及脑挫裂伤等;(2)合并严重心脑血管或行血管介入治疗;(3)其他严重实质性脏器疾病或其他严重并发症;(4)随访6 个月内死亡。
表1 3 组患者的一般资料比较()
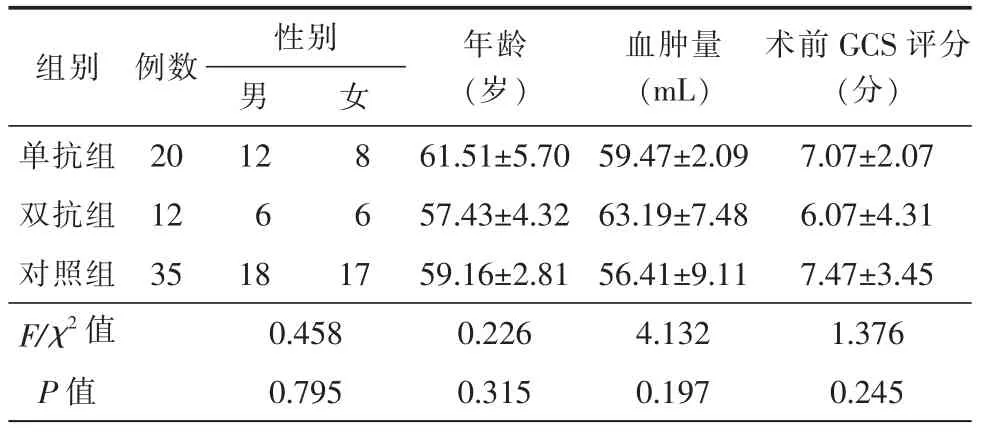
表1 3 组患者的一般资料比较()
二、手术方法
所有患者均行术前常规准备及检查,治疗上给予维持生命体征平稳、保持呼吸道通畅、脱水、止血及脑功能保护等综合治疗,而服药组所有患者停用抗血小板药物,并根据凝血功能状况,采取以下逆转抗凝或其他积极治疗[4]:(1)输注新鲜冰冻血浆或凝血酶原复合;(2)积极申请血小板,争取围手术期内给予血小板治疗;(3)充分备血,以防术中失血过多,甚至出现术中低血压表现,加重损伤,影响预后。
所有手术均在全麻下进行,常规采用额颞弧形手术切口,手术遵循控制性减压方式,首先在标记的颞部耳前切口线上切开头皮2 cm 行颅骨钻孔,打开硬脑膜后缓慢释放液态血肿,待颅内压力部分释放后,再切开剩余皮肤。常规开颅,取下骨瓣后,间断切开多处硬膜,每处约2 cm,放出并清除部分硬膜下血肿,而后再翻开硬膜,生理盐水反复冲洗硬膜下腔,彻底清除血肿,活动性出血点予以止血。充分止血后,采用人工硬膜行硬膜修补减张缝合,留置硬膜外引流管,另做皮肤造口引出。有条件积极使用颅内压监测,其对病情监测优于头颅CT 复查。视颅内压力情况以及病情特点,决定是否行去颅骨骨瓣减压术。术中记录手术过程中出血量。
三、术后处理
术后密切观察体温、血压、脉搏、呼吸及瞳孔等生命体征变化,常规行头颅CT 复查,一般比普通患者频繁,包括术后立即、术后6、12、24 及72 h 等,若临床有症状随时复查。若出现颅内再出血,动态观察并根据病情考虑是否需二次手术。术后常规定期复查凝血状况,并根据凝血结果尽可能补充新鲜血浆、凝血酶原复合物及血小板等。常规使用弹力袜或气压治疗等防止深静脉血栓形成。及时请相关科室会诊,积极防治原发疾病并指导用药,若术后颅内病情平稳及凝血功能指标正常,尽早启动抗凝抗血小板治疗。
四、观察指标及评分标准
(1)凝血功能检查:主要包括手术前后血小板计数(blood platelet,PLT)、出血时间(bleeding time,BT)、部分凝血活酶时间(activated partial thromboplastin time,APTT) 及凝血酶原国际标准化比值(international normalized ratio,INR)等;(2)术中出血量;(3)术后硬膜外引流总量;(4)术后再出血(血肿增加超过10%)及二次手术发生率;(5)随访6 个月,对比各组患者GOS 评分及改良Rankin 量表(modified Rankin scale,mRs)评分。mRs 分级法评分[5]:0 级,完全没有症状;1 级,尽管有症状,但未见明显残障,能完成所有经常从事的职责和活动;2 级(轻度残障),不能完成所有以前能从事的活动,但能处理个人事务而不需帮助;3 级(中度残障),需要一些协助,但行走不需要协助;4 级(重度残障),离开他人协助不能行走,以及不能照顾自己的身体需要;5 级(严重残障),卧床不起、大小便失禁、需持续护理和照顾;6级,死亡。其中0~3 级为恢复良好,4~6 级为恢复不良。
五、统计学分析
采用SPSS22.0 软件进行统计学分析,计量资料(凝血功能指标、术中出血、硬膜外引流量及GOS 评分)均符合正态分布,以均数±标准差()表示,3组比较采用方差分析,组间两两比较采用SNK 法;计数资料(术后再出血率、二次手术率以及mRs 分级评分恢复良好率)以率(%)表示,比较采用χ2检验。P<0.05 为差异有统计学意义。
结果
一、3 组患者的围手术期凝血指标比较
与对照组相比,单抗组、双抗组的术前BT、APTT均显著延长,差异有统计学意义(P<0.05),但3 组间的PLT、INR 比较,差异无统计学意义(P>0.05)。单抗组与双抗组各凝血指标比较,差异无统计学意义(P>0.05)。详细信息见表2。
二、3 组患者术中、术后并发症发生率比较
单抗组与双抗组的术中出血量、术后硬膜外引流总量、术后再出血以及二次手术率等均显著高于对照组,差异有统计学意义(P<0.05)。双抗组的术中出血量、硬膜外引流总量及二次手术率均明显高于单抗组,差异有统计学意义(P<0.05)。详细信息见表3。
表2 3 组患者的围手术期凝血指标比较()
与对照组比较,aP<0.05;PLT:血小板计数;APTT:部分凝血活酶时间;INR:凝血酶原国际标准化比值;BT:出血时间
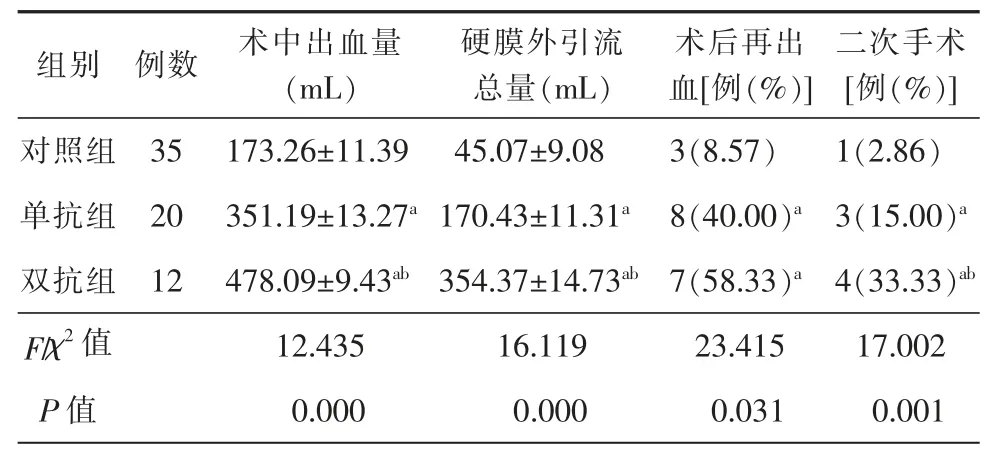
表3 3 组患者术中、术后并发症发生率比较
三、3 组患者术后6 个月的预后结果比较
术后随访6 个月以上,单抗组与双抗组的GOS评分及mRs 分级评分恢复良好率均低于对照组,差异有统计学意义(P<0.05)。单抗组与双抗组的GOS评分及mRs 分级评分恢复良好率差异无统计学意义(P>0.05)。详细信息见表4。

表4 3 组患者术后6 个月预后结果比较
四、典型病例
男性,78 岁,因“头部外伤伴昏迷2 h”入院。既往冠心病史,口服阿司匹林和氯吡格雷3 年以上。术前GCS 6 分,浅昏迷,头颅CT 示右额颞顶硬膜下血肿,中线结构向左侧移位,脑室系统受压明显 (图1A)。急诊行右额颞开颅血肿清除+去骨瓣减压术,术后复查头颅CT 示硬膜下血肿清除满意(图1B)。24 h 后再次出血,再次行手术清除血肿(图1C)。术后恢复好,1 个月后转康复科治疗(图1D)。随访6个月,mRs 评分1 级,生活基本自理。

图1 抗血小板合并急性硬膜下血肿患者急诊手术及二次出血术前术后CT 图
讨论
随着口服抗血小板药物在心脑血管疾病中普遍使用,长期使用口服抗血小板物的不良反应和弊端也越来越受到临床医生的关注。国内外研究发现长期口服抗血小板药物患者的脑出血几率比一般患者高8~10 倍,且多数存在致残[6,7]。sTBI 是一种高死亡率和致残率的常见神经外科急重症,急诊开颅手术与其他部位的手术相比止血困难,若合并口服抗血小板药物,脑出血的风险会明显增大。由于此类颅脑损伤的临床特点复杂多样且预后不一,目前尚未有临床统一的治疗共识。本文通过研究长期口服抗血小板药物合并ASDH 患者的临床资料,旨在探讨抗血小板药物对脑外伤的影响及临床治疗策略。
本研究结果显示,长期口服阿司匹林、氯吡格雷等抗血小板药物显著增加了术前BT,延长了APTT等,但PLT、INR 差异无统计学意义。双抗组与单抗组相比,虽然BT、APTT 等均有所延长,但差异无统计学意义,可能与样本量较小有关。众所周知,阿司匹林主要通过抑制血小板环氧酶、降低血栓素A2、加快前列腺素合成来抑制血小板凝集。氯吡格雷主要通过抑制血小板二磷酸腺苷受体,最终均达到抗血小板凝集与抗血栓形成的治疗目的。两种抗血小板药物对血小板并没有破坏作用,因此对PLT 影响不大,只是导致血小板功能下降,而APTT、INR 等虽因不同机制直接或间接受到抗血小板药物作用而有所异常,但其本质上反映的是凝血因子和凝血途径的情况,与血小板功能无直接相关,也不能直接反映患者的实际凝血状况。因此对于抗血小板药物患者凝血功能监测,最简单、最有意义的指标是BT 和APTT。有研究也推荐术前应用血栓弹力图测量凝血功能各项参数,更能全面评估血小板-纤维蛋白原凝块强度,为手术提供更安全保障[8]。
本研究结果还显示长期口服抗血小板药物合并ASDH 患者术中出血量显著多于对照组患者,且术后硬膜外引流量、术后再出血以及二次手术发生率均明显提高。此结果与之前相关研究结果基本相符,可能是因为颅脑损伤,脑组织表面桥静脉或微血管一旦发生挫伤破裂,则容易出血,且出血后不易凝固,因此此类患者往往在外伤初期很快形成ASDH[4,9,10]。术中清除ASDH 后,对于出血部位需慎重对待,必须在直视下电凝确切止血,简单的压迫或依靠止血材料往往不可靠,笔者提倡在显微镜下精准止血,必须生理盐水反复冲洗、多次观察,以确认止血效果。此类患者术中止血相对困难,手术时间一般比正常脑外伤患者明显延长,而且许多研究结果表明术后仍有高达50%的患者出现再出血[11-13]。本研究结果也显示单抗组术后再出血率达40%,双抗组再出血率则高于50%,且部分患者需要二次手术再次清除血肿。
从研究结果可知,对于应用抗血小板药物合并颅脑外伤的患者而言,全身凝血功能异常是影响手术预后的重要因素,也是指导术后诊疗的重要指标。相关诊疗指南建议,对于口服抗凝药患者,颅脑手术应停用抗凝药物1~2 周后进行,但颅脑损伤手术一般为急诊手术,往往来不及停用,且难以快速纠正凝血异常,减少术中出血量及控制术后再出血发生率就需要进行多方面考虑[14,15]。通过长期临床实践总结,笔者认为对于此类患者,若其无明显的中线移位或脑疝发生,不宜进行急诊手术,应先服从“停药等待、积极逆凝”的原则,待BT、APTT 等指标基本或接近正常后视情况决定手术;若已出现脑疝表现,则需急诊手术,围手术期的管理则非常重要,需注意以下几点:(1)申请血小板,争取围手术期内给予血小板治疗(往往难以得到),同时输注新鲜冰冻血浆或凝血酶原复合,充分备血,备血量建议为其他手术的2倍以上;(2)根据出血量及出血部位选择适当切口,尽可能减小手术创面,尽量减少神经血管损伤,术中止血彻底,尽量在显微镜下完成止血工作;(3)术后CT 复查应相对频繁,常规在术后即刻和6、12、24、72 h均复查头颅CT,若临床病情变化,则需随时复查,有可能较早发现术后再出血;(4)推荐积极颅内压持续监测,对病情变化的监测优于头颅CT 的复查;(5)高度重视原发缺血性疾病的预防,请心内科及血液科等相关科室及时会诊,如果术后头颅CT 提示颅内病情平稳,且术后凝血功能指标正常,则术后1 周可以给予皮下注射小剂量的低分子肝素(2500 IU/d)。
综上所述,长期服用抗血小板药物合并颅脑外伤手术治疗的关键在于对患者凝血状态的把控。一方面,抗血小板治疗本身会加重颅内出血的风险,另一方面受伤前由于潜在的血栓风险服用抗血小板药物,创伤后停用抗血小板药,甚至采取逆转抗凝的措施,有可能加重血栓形成的风险。如何权衡两方面的风险,如何根据病情特点采取不同的措施,从而达到改善疾病预后的目的,目前尚缺乏相关共识和推荐,值得进一步研究和探讨。
利益冲突所有作者均声明不存在利益冲突

