融合魏斯氏菌(Weissella confusa)XG-3产胞外多糖条件研究
刘丽娜,郭尚旭,姜 静,赵 丹,b,*
(黑龙江大学 a.生命科学学院微生物省高校重点实验室,哈尔滨 150080;b.农业微生物技术教育部工程研究中心,哈尔滨 150500)
0 引 言
乳酸菌(lactic acid bacteria, LAB)是发酵糖类产生乳酸的革兰氏阳性细菌,大部分成员是公认安全的(generally regarded as safe, GRAS)菌株[1-2]。LAB分泌的多糖类化合物称为胞外多糖(exopolysaccharide, EPS)。产EPS的LAB在乳杆菌(Lactobacillus)、明串珠菌(Leuconostoc)、乳球菌(Lactococcus)和链球菌(Streptococcus)中较为常见,在肠球菌(Enterococcus)、葡萄球菌(Oenococcus)和魏斯氏菌(Weissella)中相对较少[3]。EPS具有高粘度和优良的流变学特性[4],可作为天然安全的增稠剂、乳化剂和稳定剂,改善食品的质地及口感,在食品工业生产中被广泛应用[5]。此外,EPS还具有抗氧化[6]、抗菌[7]、降胆固醇[8]、免疫调节[9]、抗肿瘤[10]及抗病毒[11]等生理功能和生物活性,并已在临床治疗和制药领域中广泛应用。
目前,应用于生产的LAB EPS的产量普遍较低,使其在工业生产上受到限制。国内外已有相关研究表明,EPS的产量不仅与LAB种属有关,还受所选培养基组分,培养条件等因素的影响[12-13]。张文平等[14]采用单因素和响应面试验(response surface methodology, RSM)对植物乳杆菌(Lactobacillusplantarum)产EPS的条件进行优化,EPS产量增加了48.64%。梁增楠等[15]对L.plantarumKF5产EPS的条件进行单因素及正交试验,EPS的产量增加了26.48%。因此,优化培养条件对提高EPS产量至关重要,研究结果可为工业生产提供依据。
本文以提高EPS产量为出发点,以分离自香瓜培养物的融合魏斯氏菌(Weissellaconfusa)XG-3为试验菌株,经扫描电子显微镜(scanning electron microscope, SEM)观察其显微形态,采用单因素试验研究产EPS培养基组分和条件,确定菌株高产EPS的最佳发酵工艺条件,为菌株工业化生产EPS提供一定的理论基础。
1 材料与方法
1.1 菌株、培养基与EPS发酵参数
供试菌W.confusaXG-3分离自香瓜培养物,保藏于微生物省高校重点实验室(黑龙江大学)。MRS产糖基础培养基(g/L):牛肉膏10,蛋白胨10,葡萄糖50,酵母提取物 5,K2HPO42,C6H5O7(NH4)32,Na2SO30.1,MgSO4·7H2O 0.2,C2H3NaO25,MnSO40.05,Tween80 1 mL,蒸馏水1 L;pH值5.5,121 ℃灭菌15 min。单因素试验中,将W.confusaXG-3制备成108个/mL细胞悬液,以2%(v/v)的接种量接入100/250 mL MRS产糖基础培养基中,30 ℃、100 rpm振荡培养36 h。
1.2 主要试剂
苯酚、浓硫酸均为国产分析纯,购自国产药品公司。
1.3 试验方法
1.3.1W.confusaXG-3显微形态观察
采用SEM(S-4800, Hitachi, Japan)观察W.confusaXG-3显微形态。
1.3.2 EPS产量测定
利用苯酚-硫酸法[16]测定多糖的产量,具体按照DUBOIS等[17]的方法进行操作。以葡萄糖作为标准品,绘制葡萄糖标准曲线,通过线性回归方程计算得到EPS产量。
1.3.3W.confusaXG-3生长量测定
将W.confusaXG-3发酵液适当稀释,以相同稀释倍数的MRS产糖基础培养基为空白对照,测定发酵液在600 nm下吸光度值,即为W.confusaXG-3生长量。
1.3.4 培养基组分对W.confusaXG-3 EPS产量及生长量的影响
在MRS产糖基础培养基的基础上,分别依次考察碳源种类(葡萄糖、果糖、甘露糖、半乳糖、乳糖和蔗糖)及浓度(葡萄糖50~100 g/L,间隔10 g)对W.confusaXG-3 EPS产量及生长量的影响。分别依次考察氮源种类及浓度(牛肉膏、酵母提取物、胰胨和蛋白胨,5~25 g/L,间隔5 g)、乙酸钠浓度(2~10 g/L,间隔2 g)、柠檬酸铵浓度(2~10 g/L,间隔2 g)、吐温80浓度(1~5 g/L,间隔1 g)及培养基初始pH值(2.5~8.5,间隔1)对W.confusaXG-3 EPS产量的影响。
1.3.5 培养条件对W.confuseXG-3 EPS产量及生长的影响
在1.3.4优化MRS产糖基础培养基组分的基础上,分别依次考察摇床转速(60~180 rpm,间隔30)和温度(27~39 ℃,间隔3)对W.confusaXG-3 EPS产量及生长量的影响。
1.4 统计分析方法
本研究所有处理均设置3个平行,数值以均值±标准差形式表示。绘图软件为SigmaPlot.10.0。统计分析软件为JMP 10.0,组间数据多重比较采用Tukey’s方法,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与讨论
2.1 W.confusa XG-3显微形态
SEM显示(图1),W.confusaXG-3细胞为短杆状,不产孢子,无鞭毛,与此前光学显微镜观察结果一致,与李巧玉等[18]描述的W.confusa显微形态一致。

图1 W.confusa XG-3显微形态扫描电镜图(1 000×)Fig.1 SEM showing microscopic morphology of W.confusa XG-3 (1 000×)
2.2 碳源种类及浓度对W.confusa XG-3 EPS产量及生长量的影响
碳源是微生物生长代谢过程中的必需物质,是影响菌株EPS产量及生长的重要因素之一[19]。本文以葡萄糖、果糖、甘露糖、半乳糖、乳糖及蔗糖6种常用的碳源进行试验,结果见图2,供试碳源对XG-3 EPS产量及其菌株生长量有显著的影响(P<0.001),EPS产量与生长量正向相关。以葡萄糖为碳源时,EPS产量和菌株生长量显著高于其他碳源,产量为15.6 g/L,吸光值为1.36,其次为蔗糖、半乳糖、乳糖、甘露糖和果糖。因此选择葡萄糖作为W.confusaXG-3合成EPS的最佳碳源。

注:不同字母表示EPS产量间差异显著,P<0.05。图2 碳源种类对W.confusa XG-3 EPS产量及生长量的影响Fig.2 Effects of carbon source category on EPS production and biomass of W.confusa XG-3
陈媛等[20]报道食窦魏斯氏菌(Weissellacibaria)SJ-02产EPS最佳碳源为葡萄糖,与本文结果一致。陈佳芳等[21]从酒曲中分离出一株W.cibariaT5,对该菌株所选碳源(葡萄糖、乳糖、蔗糖、半乳糖和果糖)的研究发现,其产EPS的最佳碳源为蔗糖。上述结果表明,LAB产EPS的最佳碳源具有种属特异性,这可能与菌株能量及糖类代谢基因水平的特有基因不同相关。
葡萄糖添加量对供试菌生长及产EPS的影响见图3。XG-3 EPS产量及生长量随葡萄糖添加量的增加而不断增加,当葡萄糖添加量达到90 g/L时,XG-3 EPS产量为27.76 g/L,吸光值为1.45。之后随着葡萄糖添加量增加而降低。葡萄糖浓度对XG-3 EPS产量及其生长量有显著影响(P<0.001),因此,葡萄糖添加量90 g/L时为最优值。当葡萄糖添加量过低时,发酵初期菌株XG-3生长较快,且初级代谢产物乙酸积累较少,后期菌株对葡萄糖的吸收量减少,从而导致EPS合成速率较低。然而,当葡萄糖添加量过高时,XG-3生长旺盛,发酵过程中发生“葡萄糖效应”导致代谢异常,乙酸等初级代谢产物大量积累,次级代谢受到抑制从而影响菌株XG-3的生长以及EPS的合成。因此,控制合适的葡萄糖添加量对W.confusaXG-3合成EPS至关重要。

注:不同字母表示EPS产量间差异显著,P<0.05。图3 葡萄糖浓度对W.confusa XG-3 EPS产量及生长量的影响Fig.3 Effects of glucose concentration on EPS production and biomass of W.confusa XG-3
2.3 氮源种类及浓度对W.confusa XG-3 EPS产量的影响
氮源是微生物生长发育所必需的营养物质,适合的氮源有利于菌体EPS的合成[22]。牛肉膏、酵母提取物、胰胨、蛋白胨4种氮源均对W.confusaXG-3 EPS的合成起促进作用,且随着氮源添加量的增加,XG-3 EPS的产量均呈现出先增加后降低的趋势(图4)。可能的原因是,氮源浓度过高会产生渗透胁迫,抑制XG-3 EPS的合成[23-24]。胰胨为10 g/L时,XG-3 EPS的产量(44.33 g/L)显著高于其他氮源。不同氮源的种类及添加量对XG-3 EPS产量差异显著(P<0.001)。以酵母提取物和胰胨分别为氮源时,XG-3 EPS的产量差异不显著,考虑到经济成本,可选用酵母提取物代替胰胨。Cerning等[25]研究德氏乳杆菌保加利亚亚种(Lactobacillusdelbrueckiisubsp.bulgaricus)产EPS的影响因素时发现,当以1%的酪蛋白为氮源时,EPS的产量最高。汪清美等[26]发现,L.delbrueckiisubsp.bulgaricus产EPS的最佳氮源为4.5%大豆蛋白胨。

注:不同字母表示同种氮源不同浓度EPS产量差异显著,P<0.05。图4 氮源对W.confusa XG-3 EPS产量的影响Fig.4 Effects of nitrogen source on W.confusa XG-3 EPS production
2.4 乙酸钠、柠檬酸铵、吐温80和初始pH对W.confusa XG-3 EPS产量的影响
乙酸钠、柠檬酸铵、吐温80的添加量及初始pH均对W.confusaXG-3 EPS产量有显著影响(P<0.001)(图5)。XG-3 EPS的产量均随着乙酸钠、柠檬酸铵、吐温80的添加量及初始pH的增加呈现出先上升后下降的趋势,当乙酸钠的添加量达到6 g/L时,XG-3 EPS的产量最高,为46.5 g/L(图5(a))。柠檬酸铵添加量为5 g/L时,XG-3 EPS的产量最高,为49.2 g/L(图5(b))。吐温80添加量为2 mL时,XG-3 EPS的产量最高,为51.5 g/L(图5(c))。初始pH值过低或过高都会抑制菌体的生长,pH值过低菌株生长的速度减慢,使得EPS的合成量减少,当pH值过高时,EPS的合成量也会因为菌体生长量的下降而减少。当初始pH为4.5和8.5时,菌株XG-3产EPS水平较低,分别为50.87 g/L和48.9 g/L,当初始pH为6.5时,即弱酸条件下优于其他情况,XG-3 EPS产量最高为53.7 g/L(图5(d))。张文平等[14]对L.plantarum产EPS的条件进行研究,也得到了相同的结果,即初始pH为6.5时EPS产量最高。
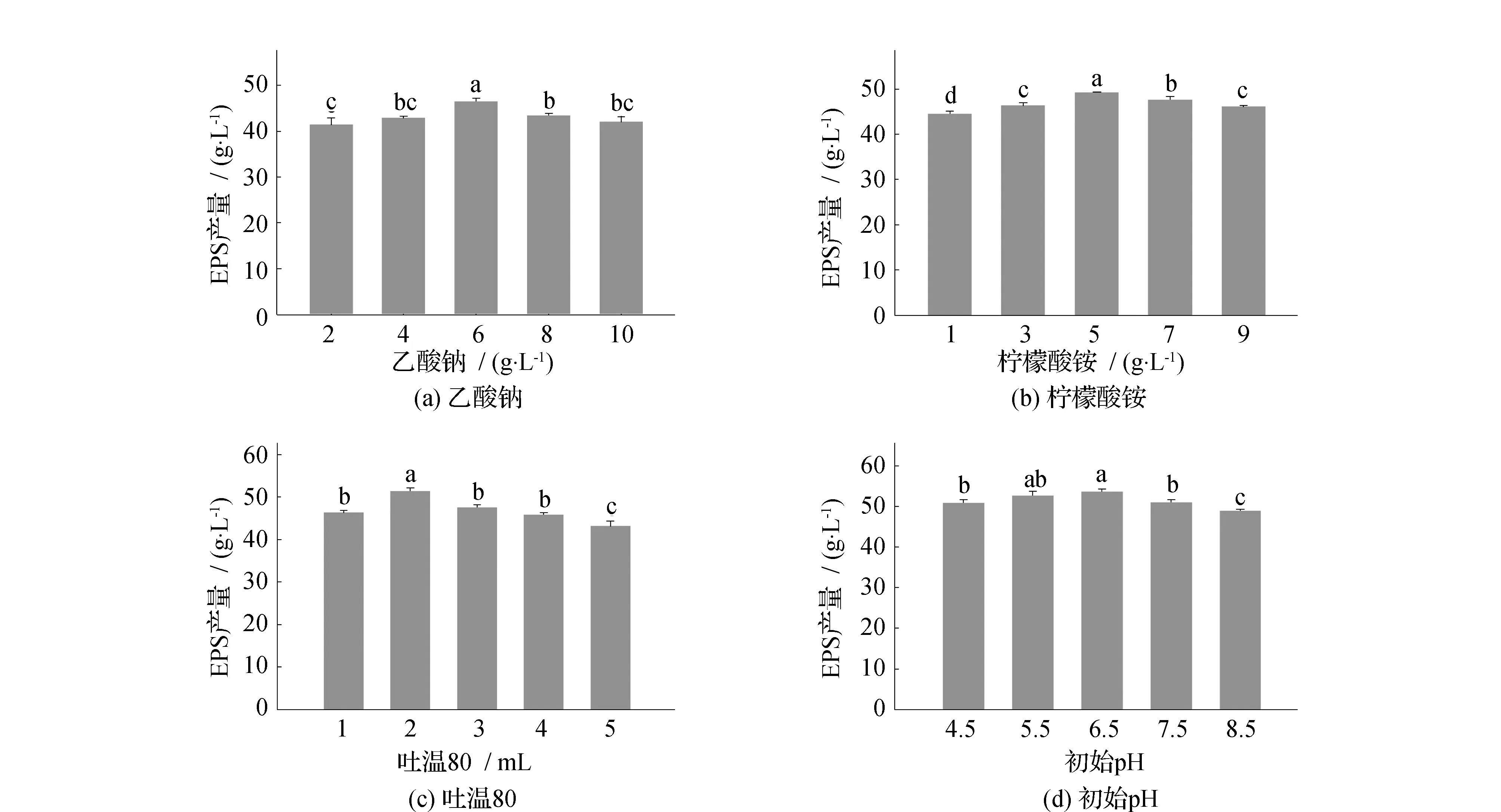
注:不同字母表示EPS产量差异显著,P<0.05。图5 不同因素对W.confusa XG-3 EPS产量的影响Fig.5 Effects of different factors on W.confusa XG-3 EPS production
2.5 培养条件对W.confusa XG-3 EPS产量及生长的影响
摇床转速对W.confusaXG-3 EPS产量的影响见图6,转速对XG-3 EPS的合成具有显著的影响(P<0.001)。随着转速的增加,XG-3 EPS的产量呈现出先升高后降低的趋势,当转速达到120 rpm时,XG-3 EPS的产量最高,为58.05 g/L。这可能是因为转速小时,发酵液中的溶氧量也随之降低,菌株XG-3的生长减慢,进而导致EPS的产量降低。当转速较大时,剪切力增加,菌株XG-3的生长受到抑制,从而导致W.confusaXG-3 EPS的产量降低。

注:不同字母表示EPS产量差异显著,P<0.05。图6 摇床转速对W.confusa XG-3 EPS产量的影响Fig.6 Effects of rotation speed on W.confusa XG-3 EPS production
培养温度对W.confusaXG-3产EPS的影响见图7,不同温度对XG-3 EPS有显著的差异(P<0.001)。培养温度过高或过低都会抑制菌株XG-3的生长以及EPS的合成。当培养温度为30~36 ℃时,XG-3 EPS的产量在58.91 g/L以上,而培养温度为30 ℃时,XG-3 EPS的产量最高,为61.03 g/L。当温度上升到39 ℃时,由于温度过高,导致菌株W.confusaXG-3生物量以及EPS产量的下降。冯小婉等[27]对L.plantarumAR307产EPS的条件进行研究,发现其最佳温度为32 ℃时,EPS的产量最高,与本研究结果较为相似。

注:不同字母表示EPS产量差异显著,P<0.05。图7 温度对W.confusa XG-3 EPS产量的影响Fig.7 Effects of temperature on W.confusa XG-3 EPS production
3 结 论
LAB和EPS的产量受多种因素的影响,且具有种属特异性。系统研究培养基成分和发酵条件对EPS产量的影响,对于挖掘高产EPS的LAB资源具有重要的意义。本研究结果表明:当培养基中碳源为葡萄糖90 g/L、氮源为酵母提取物10 g/L、乙酸钠6 g/L、柠檬酸铵5 g/L及吐温80 2 mL,初始pH为6.5,培养条件为摇床转速120 rpm、温度30 ℃时,W.confusaXG-3 EPS产量达到61.03 g/L,比优化前提高了44.95%。单因素试验显著提高了供试菌XG-3 EPS产量,研究结果为该菌株用于大规模工业化生产EPS提供了依据,具有鲜明的实践意义。

