甲氨蝶呤对中重度斑块型银屑病患者T细胞相关细胞因子表达水平的影响
苏蓓蓓, 甘泉, 甘才斌
(新乡市中心医院皮肤科,河南 新乡 453000)
银屑病是一种由遗传、环境及免疫等多种因素引起的一种自身免疫性皮肤疾病,其确切发病机制尚不清楚[1]。研究发现,Th1/Th2及Th17/Treg细胞平衡紊乱与银屑病明显相关[2-3]。IFN-γ和IL-4分别为Th1细胞及Th2细胞的代表性细胞因子,IL-17a、IL-21和TGF-β分别为Th17、Treg细胞的代表性细胞因子。甲氨蝶呤(Methotrexate,MTX)是系统治疗银屑病的首选药物,但其具体治疗机制不清,同时临床疗效及不良反应发生率存在个体差异[4-5]。采用MTX治疗中重度斑块型银屑病,获得PASI 75应答率患者的比例为79%(49/62)[6],在这一前期研究结果基础上,本研究探讨获得PASI 75及未获得PASI 75应答率的患者在采用MTX治疗后,外周血T细胞相关细胞因子IFN-γ、IL-4、IL-17a、IL-21及TGF-β表达水平的变化,同时探讨MTX对中重度斑块型银屑病患者肝肾功能、血糖及血脂水平的影响。现将结果报道如下。
1 对象与方法
1.1 研究对象
纳入2018年1月— 6月我院门诊及住院治疗的62例中重度斑块型银屑病患者作为研究对象。纳入标准:①通过临床医师诊断或组织病理学诊断为斑块型银屑病;②PASI 评分均≥10分。排除标准:①近3个月内采用维A酸类药物、环孢素及生物制剂等治疗者;②治疗前存在肝肾功能不全、血液系统疾病、感染性疾病及MTX过敏者;③治疗期间失访者。
中重度斑块型银屑病患者MTX治疗方案[6]:治疗前均完善相关生化功能检查且结果正常,MTX起始剂量为0.3 mg/(kg·周),每周二及周五或周一、周四、周六给药,随着皮损加重或减轻程度,每4周增加或减少2.5 mg。62例患者采用MTX治疗16周后,获得PASI 75应答率(治疗后PASI 评分相对于治疗前至少下降75%以上)的49例定义为应答组,其余未获得PASI 75应答率的13例患者定义为未应答组。应答组男28例,女21例;年龄49~63岁,平均(54.78±9.67)岁。未应答组男7例,女6例;年龄48~62岁,平均(58.45±5.17)岁。另纳入健康对照组35例,其中男16例,女19例;年龄51~62岁,平均(56.88±9.37)岁。三组研究对象在性别(2=1.08)及年龄(F=1.24)上无明显差异(P值均>0.05),具有可比性。
1.2 IFN-γ、IL-4、IL-17a、IL-21、TGF-β表达水平和生化指标检测
中重度斑块型银屑病患者治疗前后和健康对照组于清晨空腹抽取外周静脉血3 mL于抗凝管中,离心(4 ℃,12 000 r/min,离心半径4 cm)后获得上层血清。采用ELISA法检测所有研究对象IFN-γ、IL-4、IL-17a、IL-21、TGF-β的表达水平,所有操作步骤按照ELISA试剂盒(艾美捷科技有限公司)说明书进行。银屑病患者治疗前后及健康对照组的生化指标均通过我院检验科进行检测。
1.3 统计学处理
采用SPSS 17.0统计学软件进行数据分析,各细胞因子水平及生化指标以均数±标准差表示,两组间相关指标的比较采用t检验,相关性采用Pearson分析,P<0.05为差异有统计学意义。
2 结果
2.1 应答组与未应答组治疗前后细胞因子水平的比较
与对照组相比,应答组和未应答组治疗前及治疗后,血清IFN-γ、IL-17a、IL-21水平均明显升高,而IL-4和TGF-β水平均明显下降,差异均具有统计学意义(P值均<0.05)。与治疗前比较,应答组采用MTX治疗后血清IFN-γ、IL-17a、IL-21明显降低(P值均<0.05),TGF-β明显升高(P<0.05),而IL-4无明显变化(P>0.05);未应答组治疗前后所有细胞因子相比较均无明显差异(P值均>0.05)。详见表1。
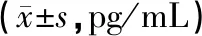
表1 对照组、应答组及未应答组治疗前后细胞因子水平的比较Tab.1 Comparison of cytokines among controls, responders and non-responders before
2.2 治疗前后生化指标的比较
治疗前,62例中重度斑块型银屑病患者所有生化指标与对照组相比较无明显差异(P值均>0.05)。治疗16周后,62例患者血清肌酐、尿酸、尿素氮、谷丙转氨酶和谷草转氨酶较治疗前均明显升高,差异均具有统计学意义(P值均<0.05),其余指标则未见明显差异;而应答组与未应答组所有生化指标相比较均无明显差异(P值均>0.05)。结果详见表2、表3。
2.3 PASI评分与银屑病患者IFN-γ、IL-4、IL-17a、IL-21、TGF-β的相关性
治疗前62例银屑病患者PASI评分为(14.54±1.76)分。应答组和未应答组治疗前PASI 评分分别为(13.99±2.72)分、(15.31±3.28)分,两组相比较无明显差异(t=1.33,P=0.188);MTX治疗后应答组和未应答组PASI评分分别为(1.23±0.11)分和(12.89±1.53)分,与治疗前相比,两组PASI 评分均明显下降(t值分别为32.81、2.41,P值均<0.05)。Pearson相关分析结果显示,治疗前PASI评分与IFN-γ、IL-17a、IL-21、TGF-β水平均存在明显相关(r值分别为0.25、0.75、0.66、-0.11,P值均<0.05)。
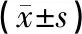
表2 62例银屑病患者治疗前后和对照组生化指标的比较Tab.2 Comparisons of biochemical markers in healthy controls and 62 patients before and after MTX

表3 应答组和未应答组治疗后生化指标的比较Tab.3 Comparisons of biochemical markers between responders and non-responders after MTX
3 讨论
银屑病发病机制复杂,现研究多认为银屑病是一种由T淋巴细胞介导的自身免疫性疾病,尤其是Th1/Th2和Th17/Treg 细胞比值失衡可能与银屑病明显相关,其中主要表现为Th1和(或)Th17细胞优势应答。Th1和Th17细胞分泌的主要细胞因子IFN-γ和IL-17相对升高,而Th2和Treg细胞分泌的主要细胞因子IL-4和TGF-β相对减少[7-10]。系统口服MTX对银屑病患者疗效显著,但仍存在个体差异,部分患者对其疗效较差[6, 11]。国内一项共计235例银屑病的研究结果显示,MTX系统治疗中重度银屑病患者12周后 PASI 75应答率仅仅为45.5%(107/235)[12]。本研究前期结果显示,MTX治疗银屑病的PASI 75应答率为79%[6],在此基础上,本研究对应答者和无应答者血清学指标进行详细检测,进一步探讨MTX治疗银屑病的潜在机制。
本研究结果显示,与对照组相比,62例银屑病患者治疗前和治疗后血清IFN-γ、IL-17a、IL-21水平均明显升高,而IL-4和TGF-β水平明显下降,提示银屑病患者存在一定程度的免疫紊乱现象,主要表现为Th1和Th17细胞优势应答。何玉清等[13]研究发现,同对照组相比,银屑病患者治疗前Th1细胞、Th1/Th2细胞比值、IFN-γ水平均明显升高,Th2细胞和IL-4水平无明显差异,但采用MTX治疗后,上述指标同对照组及治疗前相比均无明显差异。该结果与本研究结果存在差异,可能原因是该研究样本量较小,仅为36例,且MTX用药时间较短(8周左右)导致。Priyadarssini等[14]采用MTX系统治疗银屑病患者12周后发现,Th1细胞比例较治疗前明显降低(P<0.0001);Yan等[15]通过ELISA法证实银屑病患者经过MTX治疗后血清IFN-γ水平明显降低,主要与活化AMPK信号通路有关;张锡宝等[16]研究显示MTX治疗6周后,银屑病患者皮损中IFN-γ mRNA表达水平与治疗前比较明显降低,以上结果与本研究结论基本一致。对比两组患者治疗前后血清IFN-γ、IL-4、IL-17a、IL-21、TGF-β水平变化后发现,应答组血清IFN-γ水平较治疗前明显降低,而未应答组治疗前后对比则无明显差异,同时,血清IL-4水平在应答组和未应答组治疗前后均无明显变化。因此,推测MTX治疗银屑病机制可能主要在于抑制Th1细胞分泌的主要细胞因子IFN-γ的产生,而对Th2细胞分泌的主要细胞因子IL-4无明显影响。应答组患者治疗后IL-17a、IL-21较治疗前明显降低,而未应答组治疗后与治疗前比较无明显差异。推测MTX治疗银屑病的机制也与Th17细胞分泌的细胞因子IL-17a得到明显抑制有关,IL-17a相对减少,从而间接引起Treg相关细胞因子TGF-β的增多,而TGF-β能明显减轻银屑病的皮损严重程度[17-18]。相关性分析结果显示,治疗前患者PASI评分与IFN-γ、IL-17a和IL-21存在正相关,与TGF-β呈负相关,说明上述细胞因子在一定程度上也可反映银屑病皮损的严重程度,提示可通过上述指标的变化来预测MTX治疗银屑病的疗效。
MTX是指南推荐系统治疗银屑病的一线药物之一,临床使用过程中需要注意其用药安全性。MTX主要是在肝脏中代谢,在肾脏中排出,具有一定的肝肾毒性,常见的不良反应主要为消化道症状,还可影响骨髓及肝纤维化等[19]。本研究发现,62例银屑病患者治疗前所有生化指标与对照组相比未见明显差异,而采用MTX治疗后血清肌酐、尿酸、尿素氮及肝酶水平较治疗前均明显升高,但血脂及血糖水平无明显变化,提示临床上需注意MTX对银屑病患者肝肾功能的影响;另一方面,应答组与未应答组治疗后所有生化指标相比无明显差异,说明MTX治疗银屑病的临床疗效与生化指标的变化无明显相关性。
综上,本研究结果表明,MTX治疗银屑病的机制可能在于改变了Th1/Th2、Th17/Treg细胞免疫失衡,但本研究样本量较小,结果仍需要更大样本量的数据来证实。同时,MTX长期使用的临床安全性,尤其是对肝肾功能的影响也是值得临床医生重视的地方。

