IDO抑制剂LPM3480226心血管安全性药理研究
王 宇,李春梅,傅风华,田京伟
(烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心、分子药理和药物评价教育部重点实验室(烟台大学),山东 烟台 264005)
IDO是肝脏外唯一催化色氨酸(Trp)吲哚环氧化裂解,沿犬尿氨酸(Kyn)途径分解代谢的限速酶[1-2].近年来,研究发现IDO与肿瘤免疫逃逸密切相关,可通过多种机制介导肿瘤免疫逃逸如色氨酸耗竭抑制局部T细胞增殖、色氨酸代谢产物促进T细胞的凋亡、诱导调节性T细胞增殖等[3-4].
LPM3480226是Epacadostat的结构类似药物,已申请化合物专利、晶型专利及制备工艺专利.化学名称为:顺-氮-(3-溴-4-氟苯基)-氮'-羟基-4-((2-(脲乙基)硫)-1, 2, 5-噁二唑-3-羰肟酰胺,分子式为C12H12BrFN6O3S,相对分子质量419.23.前期申报研究资料(CXHL1800024)表明LPM3480226作为选择性IDO抑制剂,可逆转IDO介导的肿瘤免疫耐受,激活效应T细胞,改善肿瘤免疫微环境,协同增强其他药物如免疫检查点药物和化疗药物的肿瘤杀伤抑制作用,可用于肺癌、肾癌、膀胱癌、头颈癌和黑色素瘤的治疗,具有极好的开发前景.
安全药理学的研究应根据受试药物的临床用药目的和药物作用特点合理地进行实验设计,采用国内外认可的体内或体外方法,包括科学而有效的新技术和新方法.为了进一步考证IDO抑制剂LPM3480226的临床安全性,本研究通过对细胞和Beagle犬多次给药,进行hERG钾通道道(human Ether-a-go-go Related Gene potassium channel)电流的抑制作用和Beagle犬II导联心电图及血压各指标的研究,评价该化合物对心血管系统的影响,为进一步开发提供科学依据.

图1 LPM3480226结构式
1 实验材料
1.1 细胞株与实验动物
稳定转染了人Kv11.1(hERG)离子通道的中国仓鼠卵巢细胞hERG-CHO(Chinese Hamster Ovary)由内部构建,液氮冻存,于5% CO2,37 ℃培养箱培养.
普通级Beagle犬,6只,雌雄各半,首次给药时年龄为9~10月龄,体重为8.20~11.15 kg,购自北京玛斯生物技术有限公司,生产许可证号:SCXK(京)2016-0001,质量合格证流水号:11400600002039(雌性)、11400600002038(雄性).所有实验用动物均在温度为22.09~24.78 ℃,相对湿度为43.72%~67.45%,人工照明,12 h/12 h明暗交替条件下适应环境7 d,并给予自由饮食和饮水.本研究经过烟台大学动物伦理委员会审查批准.
1.2 药品与试剂
LPM3480226购自上海药明康德新药开发有限公司;阳性对照化合物cisapride(西沙比利)购自Sigma公司.
1.3 主要仪器
CO2培养箱(日本SANYO公司),离心机(美国Beckman公司),Axopatch 200B膜片钳系统(美国Axon公司),植入式生理信号无线遥测系统(美国DSI公司),全自动五分类血液分析仪(德国西门子公司),全自动生化分析仪(瑞士罗氏公司),全自动血凝分析仪(日本希森美康公司).
2 实验方法
2.1 hERG实验
2.1.1 化合物准备 测试当天,将20 mmol/L的化合物母液用100% DMSO进行3倍连续稀释,即取10 μL 20 mmol/L的化合物母液加入20 μL DMSO,依次得到6个经DMSO连续稀释的化合物中间浓度.然后再取10 μL的化合物中间浓度加入到4 990 μL细胞外液中,500倍稀释得到需要测试的最终浓度,最高测试浓度为40 μmol/L,依次分别为40、13.3、4.4、1.48、0.49和0.16 μmol/L共6个浓度.阳性对照化合物cisapride准备:取150 μmol/L的cisapride母液用100% DMSO进行3倍连续稀释,即取10 μL 150 μmol/L的cisapride母液加入20 μL DMSO,依次得到5个经DMSO连续稀释的cisapride中间浓度.然后再取10 μL的cisapride中间浓度加入到4990 μL细胞外液中,500倍稀释得到需要测试的最终浓度,最高测试浓度为300 nmol/L,依次分别为300、100、33.3、11.1和3.70 nmol/L共5个浓度.最终测试浓度中的DMSO含量不超过0.2%,此浓度的DMSO对hERG钾通道没有影响[5].
2.1.2 电生理记录过程 稳定表达hERG钾通道的CHO细胞,在室温下用全细胞膜片钳技术记录hERG钾通道电流.尖端电阻为2~5 MΩ左右的玻璃微电极连接至Axopatch 200B(Molecular Devices)膜片钳放大器.钳制电压和数据记录由pClamp 10软件通过电脑控制和记录,采样频率为10 kHz,滤波频率为2 kHz.在得到全细胞记录后,细胞钳制在-80 mV,诱发hERG钾电流(IhERG)的步阶电压从-80 mV给予一个2 s的去极化电压到+20 mV,再复极化到-50 mV,持续1 s后回到-80 mV.每10 s给予此电压刺激,确定hERG钾电流稳定后(1 min)开始给药过程.化合物浓度从低测试浓度开始连续给药,每个测试浓度给予1 min.每个浓度至少测试3个细胞(n≥3).
2.1.3 数据处理 数据分析处理采用pClamp 10,PatchMaster,GraphPad Prism 5和Excel软件.不同化合物浓度对hERG钾电流(-50 mV时诱发的hERG尾电流峰值)的抑制程度用公式(1)计算[6-7]:
Fractional block=[1-(I/I0)]×100%,
(1)
式中,Fractional block代表化合物对 hERG 钾电流的抑制百分率,I和I0分别表示在加药后和加药前hERG钾电流的幅度.
化合物的IC50使用方程(2)进行拟合计算得出[6-7]:
I/I0=1/{1+([C]/IC50)n},
(2)
式中,I0和I分别表示加药前和加药后hERG钾电流的幅度.[C]为化合物的浓度,n为Hill系数.
2.1.4 溶液 细胞外液配方(mmol/L):140 NaCl,5 KCl,1 CaCl2,1.25 MgCl2,10 HEPES和10 Glucose,用NaOH调节pH值至7.4.细胞内液配方(mmol/L):140 KCl,1 MgCl2,1 CaCl2,10 EGTA和10 HEPES,用KOH调节pH值至7.2.
2.1.5 质量控制 报告中的实验数据满足以下质量控制指标:全细胞封接阻抗>1 GΩ;串联电阻如大于10 MΩ补偿80%以上;hERG尾电流幅度> 400 pA;衰减< 2%每分钟;电流稳定性:6次记录的尾电流峰值与平均值不超过2%;药理学指标:多浓度cisapride对hERG通道的抑制效应设为阳性对照.
2.2 Beagle犬心血管系统试验
2.2.1 实验分组 给药途径:经口灌胃,与临床拟用途径一致.给药频率:分4阶段给药,每阶段给药1次,各阶段给药安排见表1.给药体积:5 mL/kg.给药:6只Beagle犬采用6×4改良拉丁方设计依次重复给予LPM3480226或20% Kolliphor(Solutol) HS 15,每只动物的给药量根据最近一次测量的体重进行给药.给药间隔时间:每阶段数据采集结束后再洗脱2~5 d.间隔时间设计依据:Beagle犬经口灌胃给予50、100 mg/kg的LPM3480226,达峰时间Tmax约为4~7.17 h,消除半衰期T1/2约为4 h.首次给药当天作为试验第1天,动物禁食至少12 h,不禁水.

表1 给药安排
2.2.2 一般状态观察 动物饲养人员观察时间与频率:每天2次(上午和下午各1次).试验人员观察时间与频率:给药当天,给药后观察1次,出现症状的当天,给药后观察3次,其余时间,每天观察1次.兽医:每周1~2次.具体观察各组所有存活犬.动物饲养人员观察:死亡、摄食及饮水.试验人员及兽医观察:包括但不限于犬外观体征、被毛、一般行为活动、精神状态、腺体分泌、呼吸状态、粪便性状、生殖器、死亡等情况及其它毒性表现.
2.2.3 体重 每阶段给药前1天称量动物体重,该体重仅用于给药量的计算.
2.2.4 遥测数据采集 首先,进行数据采集前设置:整个遥测系统位于电磁屏蔽室内,隔绝外界环境的电磁干扰.采集过程,动物在笼内自由活动.(1)植入子预先埋置在动物体内,开启后可采集心电及动脉血压信号.(2)RMC-1接收器接收对应植入子信号后,通过交换机最终传输至计算机,由Ponemah软件对采集的信号进行实时处理并储存在计算机硬盘内.(3)采集参数设置:动脉血压(BP)的采集频率为250 Hz;心电(ECG)的采集频率为500 Hz,数据读取率(logging rate)设置为60 s.(4)给药前后具体检测指标包括血压相关指标如收缩压、舒张压、平均动脉压和II导联心电图相关指标如心率、RR间期、PR间期、QRS波时间、QT间期、校正QT间期.
接下来进行首次给药前的数据采集:(1)用于试验的遥测动物在环境适应期时,需对其体内的植入子进行检查,以确定植入子对生理信号的采集正常及计算机显示的采集图形正常.(2)在首次给药前,需连续采集约22 h的心电及血压数据.(3)首次给药前采集的数据将保留在归档电子资料中,但该数据不用于分析或包含在最终报告中.
最后进行给药阶段的数据采集,每阶段给药前,需连续采集至少60 min的心电和血压数据,给药后需连续采集至少24 h.
2.2.5 遥测数据分析 对于心电图的定性分析:(1)给药后约1 h、2 h、4 h、6 h的时间点,截取时间点前后5 min范围内时长约2 min的心电图片段;给药后约7 h、8 h、24 h的时间点,截取时间点前后10 min范围内时长约2 min的心电图片段.(2)评估截取的心电图片段中是否存在心律失常,波形是否异常,判断心电图标记是否正确.时间设计依据:Beagle犬经口灌胃给予50、100 mg/kg的LPM3480226,Tmax约为4 h~7.17 h,T1/2约为4 h.
对于心电图及血压的定量分析:分别对给药前及给药后至24 h的心电和血压数据进行分析,软件根据心电图标记自动计算相应的指标.选取给药前约1 h时长的数据求平均,作为给药前的基础值(Baseline);给药结束后至给药后8 h的时长对每1 h的数据求平均;给药后8~24 h的时长对每4 h的数据求平均.以上平均值用于统计分析.分析时参照以下原则:(1)典型的心电图和血压波形由软件根据内置算法自动识别;(2)未自动识别的心电图由分析人员调用该动物的心电图模板库进行匹配;(3)因动物异常活动或信号传输异常等对波形造成干扰导致无法判读时,标记该数据为坏数据(Bad Data Mark)并保存在最终电子数据中[8-9].
2.3 统计学方法
定性分析结果仅进行描述.
定量分析结果需进行统计分析,方法如下:
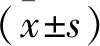
定量指标:定量指标先采用LEVENE检验进行方差齐性检验,当方差齐时(P>0.05),则采用单因素方差分析(ANOVA)进行统计学检验;当方差不齐时(P≤0.05),则采用Kruskal-Wallis H秩和检验(K-W法)进行统计分析.当单因素方差分析显示差异有统计学意义时(P≤0.05),则采用Dunnett’st检验(Dunnett法)对组间差异进行比较;当单因素方差分析显示差异无统计学意义时(P>0.05),则统计分析结束;当 Kruskal-Wallis H秩和检验显示差异无统计学意义时(P>0.05),则统计分析结束.
组间差异在LPM3480226各组与对照组进行.所有检验均为双侧检验α=0.05.所有的统计分析,均使用SPSS 13.0 for Windows软件完成.
3 实验结果与讨论
3.1 hERG试验
在稳定表达hERG钾通道的CHO细胞上,化合物LPM3480226在40 μmol/L浓度给药1 min后对hERG钾电流的抑制百分率小于50%,在此条件下,该化合物抑制 hERG钾电流的IC50值大于40 μmol/L,对hERG钾通道无明显的抑制作用.
化合物LPM3480226和阳性对照化合物cisapride对hERG钾通道电流抑制作用的量效曲线和IC50如图2所示.
3.2 Beagle犬心血管系统试验
3.2.1 一般状态 300 mg/kg组大部分犬(5/6)给药后见呕吐黄色液体/食物或白色泡沫,1只犬(1/6)给药后可见不成形粪便;30 mg/kg组和100 mg/kg组仅在第1阶段给药后各有2只犬(2/6)、1只犬(1/6)呕吐黄色液体/食物.除此以外,各组犬其余时间一般状况良好,自主活动正常,亦未见其他异常反应.

图2 LPM3480226和cisapride对hERG钾通道电流抑制作用的量效曲线图和IC50
3.2.2 对血压的影响 LPM3480226各组犬给药后24 h内的血压各指标的均值与同期对照组相比(图3—5),差异均无统计学意义(P>0.05).
给药后各时间段各指标与自身给药前的差值与同期对照组差值相比,30 mg/kg组犬药后0~1 h,收缩压(图3)、平均动脉压(图5)降低,药后0~1 h、16~20 h,舒张压(见图4)降低;100 mg/kg组犬药后0~1 h,收缩压、舒张压、平均动脉压降低;300 mg/kg组犬药后0~1 h,收缩压、平均动脉压降低,药后0~1 h、12~16 h、16~20 h、20~24 h,舒张压降低;上述差异有统计学意义(P≤0.05).
LPM3480226各组犬给药后部分时间段血压与自身给药前的差值与对照组的差值相比可见小幅度降低,且其均值与同期对照组相比未见明显改变,无明显剂量相关性,无毒理学意义.
除此以外,该组犬在上述时间段其他血压指标与自身给药前的差值与同期对照组差值相比,差异均无统计学意义(P>0.05);在其余时间段,血压各指标与自身给药前的差值与同期对照组差值相比,差异均无统计学意义(P>0.05).
3.2.3 对II导联心电图的影响 定性分析结果:药后1 h、2 h、4 h、6 h、7 h、8 h、24 h时间点,各组犬II导联心电图波形、心率等均未见异常改变.
给药后各时间点,各组犬主要具有诊断意义的心电图异常见表2.除表2中动物以外,给药后各时间段,各组犬未见其他明显异常心电图改变.
窦性心动过缓(心率低于60 bpm)或过速(心率高于180 bpm)是正常Beagle犬常见的自发改变,且本试验中散在发生于个别时间点,非药物因素所致,无毒理学意义.

图3 经口灌胃给予LPM3480226对Beagle犬收缩压的影响

图4 经口灌胃给予LPM3480226对Beagle犬舒张压的影响

图5 经口灌胃给予LPM3480226对Beagle犬平均动脉压的影响

表2 具有诊断意义的心电图异常
定量分析结果:LPM3480226各组犬给药后24 h内各时间段心率(图6)、RR间期(图7)、PR间期(图8)、QRS波时间(图9)、QT间期(图10)、校正QT间期(图11)II导联心电图定量分析指标平均数与同期对照组相比,差异均无统计学意义(P>0.05).
给药后各时间段各指标与自身给药前的差值与同期对照组差值相比,30 mg/kg组犬药后0~1 h、1~2 h、8~12 h、12~16 h,QT间期延长;100 mg/kg组犬药后0~1 h、12~16 h,QT间期延长;300 mg/kg组犬药后0~1 h、2~3 h,RR间期延长,药后0~1 h,心率减慢,药后0~1 h、1~2 h、7~8 h、8~12 h、12~16 h,QT间期延长;上述差异有统计学意义(P≤0.05).
LPM3480226各组犬给药后部分时间段,QT间期可见延长,但相应时间段的校正QT间期未见明显变化,且与同期对照组相比其均值也未见明显变化,无毒理学意义.
300 mg/kg组犬药后0~1 h可见心率小幅度减慢,约16%(均值的幅度),并引起相关联指标RR间期延长,但与同期对照组相比其均值未见明显变化,且无剂量相关性,无毒理学意义.
除此以外,LPM3480226其余组给药后其余时间段II导联心电图各指标与自身给药前的差值与同期对照组差值相比,差异均无统计学意义(P>0.05).

图6 经口灌胃给予LPM3480226对Beagle犬心率的影响

图7 经口灌胃给予LPM3480226对Beagle犬RR间期的影响

图8 经口灌胃给予LPM3480226对Beagle犬PR间期的影响

图9 经口灌胃给予LPM3480226对Beagle犬QRS波时间的影响

图10 经口灌胃给予LPM3480226对Beagle犬QT间期的影响
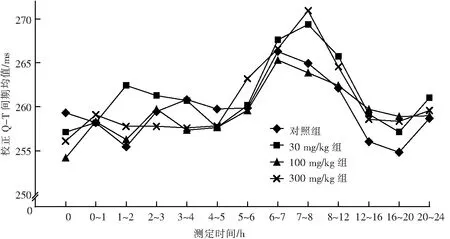
图11 经口灌胃给予LPM3480226对Beagle犬校正QT间期的影响
4 讨 论
在心肌细胞中,hERG基因编码快速激活的延迟整流钾通道(IKr),IKr在心脏复极过程中起到重要作用,阻滞IKr是药物导致QT间期延长,诱发尖端扭转性室速(Torsade de Pointes,TdP)最重要的机制.药源性心脏毒性是导致药物撤市及新药研发失败的主要原因,而QT间期延长又是新药安全性评价的关键指标之一,目前,检测化合物对hERG钾通道的作用是临床前评价药物心脏安全性的关键步骤.最常用的检测方法是通过膜片钳技术测定药物对异源转染hERG钾通道的哺乳动物细胞(HEK293细胞系、CHO 细胞系)上IKr的抑制率[9],得出阻断50% hERG电流所需的药物浓度(即IC50).但是,hERG钾通道检测是体外试验,不能完全反映人类电生理特性,且不同实验室实验条件不同、缺乏相同标准,仍具有一定的局限性.实验中选择cisapride作为阳性对照化合物,之前的文献中有报导称cisapride对hERG钾电流抑制的IC50值范围在5 nmol/L~66 nmol/L[10],本次试验同一天内检测cisapride得到的IC50值为26.6 nmol/L,说明试验系统稳定可靠,测试结果准确.结果表明,各剂量LPM3480226对hERG钾通道无明显的抑制作用.
对于心血管系统的研究,主要测定给药前后血压(包括收缩压、舒张压和平均动脉压等)、心电图(包括QT间期、PR间期、QRS波等)和心率等的变化.观察血压等指标需要选择体型较大的动物,一般可以用大鼠、犬等,实验操作方法分为麻醉动物测定法和清醒动物测定法.麻醉剂和束缚可能会使Beagle犬的血压上升,现多采用清醒动物进行心血管系统指标的测定(如遥测技术等)[11].无线遥测技术近几年在新药安全性评价中得到广泛关注,是国际安全药理学指导原则(ICH S7A)推荐的心血管系统首选的方法[12],更为客观和重要,具有明显的优越性.观察给药前及给药后至24 h内的收缩压、舒张压、平均动脉压和II导联心电图各指标(心率、R-R间期、P-R间期、QRS波时间、Q-T间期、校正Q-T间期).结果表明各剂量LPM3480226对Beagle犬II导联心电图及血压各指标未见影响.
综上所述,本研究通过科学合理的实验设计,综合考虑到药物对钾通道及心血管系统指标的影响,保证了实验的完整性、数据的准确性,为药物安全性评价提供了更为全面的实验研究基础.
5 结 论
LPM3480226对hERG钾通道无明显的抑制作用且对II导联心电图及血压各指标无明显影响,具有良好的心脏安全性.

