联合IDH1、1p/19q和ATRX对胶质瘤分子分型的临床意义
朱文标,卢善明,李海南,罗文娟,肖焕钦,谢寿城,刘晋发
(1.梅州市人民医院病理科,广东 梅州 514031; 2.广东三九脑科医院病理科,广州 510510)
胶质瘤是常见的发生于脑、脊髓等中枢神经系统肿瘤,其中恶性胶质瘤的发病率约有5%~8%,5年病死率高居世界第三[1]。目前WHO主要通过临床及病理组织特征进行胶质瘤分级,作为评估患者病情与预后标准,但这一分级并不能准确地反映胶质瘤患者的预后情况。近年来,关于胶质瘤分子病理研究取得了重大进展,相继发现了一系列与胶质瘤临床特征、病理类型和预后情况均密切相关的分子标志物。异柠檬酸脱氢酶1(IDH1)基因第132位突变存在于80%以上的低级别胶质瘤中,存在IDH1突变的胶质瘤患者提示了较好的预后[2-4]。1号染色体短臂和19号染色体长臂(1p/19q)缺失主要发生在少突胶质细胞瘤中,少部分也发生在星型细胞瘤,是少突胶质细胞瘤的标志检测[5]。α-地中海贫血/智力低下综合征X染色体连锁基因(ATRX)突变在大部分星形细胞胶质和混合型少突星形胶质瘤中存在表达缺失,与1p/19q缺失存在排斥[6]。有文献[2-3,7]指出IDH基因突变状态对胶质瘤预后的评估作用优于组织学分级,1p/19q联合缺失在少突胶质细胞瘤中发生率高达80%~90%,且常伴有IDH突变,而大多数IDH突变型的星形细胞瘤中可见ATRX突变,并且它与lp/19q共缺失排斥,此三种分子分型均为目前临床胶质瘤常检项目。本文联合上述3种分子分型对胶质瘤进行分类,探讨其对于胶质瘤预后评估的价值。
1 资料与方法
1.1 一般资料
回顾2013年8月至2018年10月梅州市人民医院收治的经术后病理证实的104例胶质瘤患者临床及病理资料,所有患者均在本院进行肿瘤切除手术,且术前临床及病理资料完整,术后可以取得联系。其中男55例,女49例;年龄22~81岁,平均(51.92±12.50)岁;病理分型为少突胶质细胞肿瘤14例,星形胶质细胞肿瘤33例,胶质母细胞肿瘤57例;组织学分级低级别为27例,高级别为77例;肿瘤部位为额叶的58例,颞叶为26例,其他部位为20例;肿瘤大小1.30~9.60 cm,平均(5.19±1.72)cm;卡氏功能状态评分(KPS)为10~90分,平均(62.60±21.45)。
1.2 研究方法
收集所有患者术前临床病理资料,包括年龄、性别、病理分型、组织学分级、肿瘤部位、肿瘤大小与KPS评分,通过电话及智慧电子病历系统随访患者的术后生存情况。采用IDH1、1p/19q和ATRX将胶质瘤患者进行分子分型,分析该分型与患者临床病理特征及预后之间的关系。参考癌症基因组图谱(TCGA)[8],首先依据IDH1基因将胶质瘤分为2组,然后依据1p/19q缺失、ATRX突变细分为以下四型。A型:IDH1突变,1p/19q缺失;B型:IDH1突变,1p/19q完整;C型:IDH1野生,ATRX突变;D型:IDH1野生,ATRX野生。
1.3 检测方法
采用免疫组织化学法对存档病理组织蜡块进行IDH1突变、ATRX表达缺失检测。免疫组织化学采用Envision两步法,IDH1(R132H)鼠抗人单克隆抗体(货号:H09)购自福州迈新生物技术有限公司,ATRX人抗兔多克隆抗体(货号:HPA001906)购自美国Sigma-Aldrich公司。具体操作步骤:以PBS作为阴性对照,先对石蜡组织进行二甲苯梯度脱腊,乙醇去二甲苯后自然晾干,使用EDTA修复液在高温高压下修复抗体,过氧化氢溶液室温孵育后,采用山羊血清封闭半小时,弃去血清,加抗体在4 ℃下孵育过夜,次日在37 ℃复温,加入二抗孵育2 h,采用DAB显色,苏木精复染,封片。IDH1结果判读:在显微镜下观察,每张病理切片选取3个高倍镜视野,IDH1突变以细胞质被染成棕褐色为主,明显高于背景的计为IDH1突变阳性。ATRX蛋白表达情况判读:低倍镜下观察,计数5个高倍视野总细胞着色强度与阳性细胞数占比,当细胞着色强度≤30%且>70%以上细胞呈中等、弱或无着色状态,记为表达缺失。
采用荧光原位杂交法检测1p/19q缺失。1p/19q检测探针(货号:F.01081-01)购自广州安必平医药科技股份有限公司。具体操作步骤:先对组织进行脱腊水化后加蛋白酶消化,柠檬酸缓冲液漂洗后,梯度乙醇溶液脱水晾干,56 ℃烤片2~5 min,再于梯度乙醇溶液脱水,自然干燥,同时配置探针置于75 ℃使其变性,将变性后的探针10 μL滴在玻片杂交位置,加盖玻片封片,置于42 ℃杂交24 h,2×SSC 10 min,于室温下在70%乙醇洗涤干燥,载玻片杂交区域滴加10 μL DAPI进行复染,暗处理10~20 min,荧光显微镜下选用合适的滤片来观察。结果判读:选择肿瘤细胞区域,使其在视野下占细胞数超过60%,计数100个完整肿瘤细胞核,观察红/绿信号个数比,正常细胞核为2/2,存在缺失核为单个红信号且红/绿<0.5,除此之外则为信号不平衡的细胞核。当缺失核的肿瘤细胞超过一半,则记为1p/19q共缺失。
1.4 统计学方法
采用SPSS21.0软件进行数据处理。计量资料比较采用单因素方差分析,计数资料比较采用卡方分析。生存分析采用Kaplan-Meier分析,绘制各分子分型生存曲线,采用对数秩检验Log-Rank评估不同分型间总生存率的差异,采用Cox风险回归对胶质瘤的临床病理和分子分型特征进行多因素生存分析,判断其独立风险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 分子分型与临床病理特征间的关系
联合分子分型与胶质瘤患者的年龄、组织学分级、KPS评分与病理分型均有关(P<0.05),其中与病理学分型的相关性最大,而与性别、肿瘤部位和肿瘤大小无关(P>0.05)。A型大多出现在少突胶质细胞肿瘤中;B型患者年龄最小,组织学级别最低,主要位于星型胶质细胞瘤;D型年龄最大,组织学级别最高,KPS评分最低;C型和D型主要存在于胶质母细胞肿瘤中。见表1。
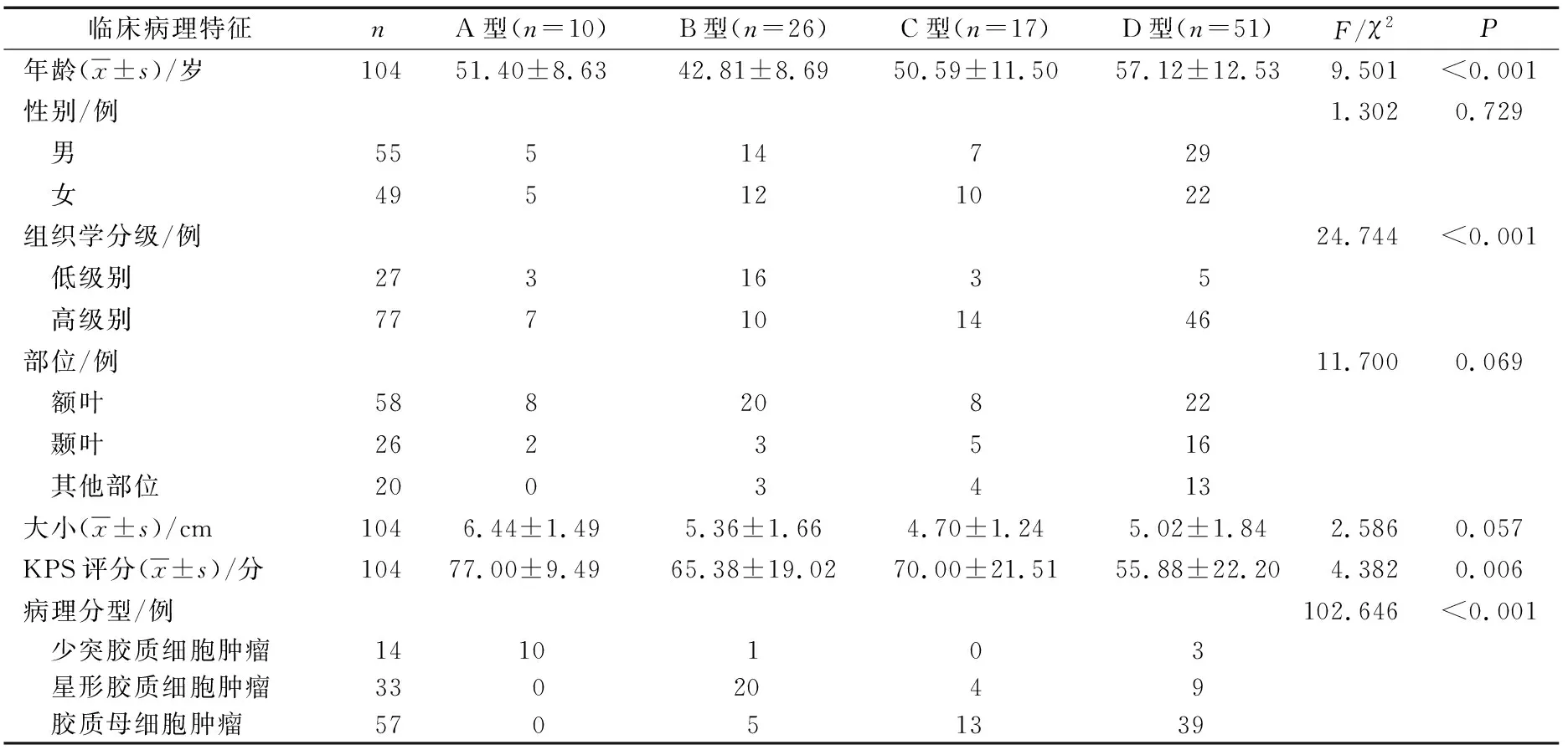
表1 胶质瘤患者IDH、1p/19q和ATRX联合分子分型与临床病理特征间的关系
2.2 分子分型与Kaplan-Meier总生存期的关系
104例患者中,有7例失访,37例生存,60例死亡。Kaplan-Meier生存分析结果显示,4组分子分型的胶质瘤患者术后总生存期差异显著(Log-Rank:χ2=31.631,P=<0.001),其中B型患者的中位生存期最长,由于该组纳入患者死亡率未超过50%,所以无中位生存期统计值;A型患者的中位生存期为(56.500±0.000)个月,C型患者为(43.500±18.425)个月,D型患者中位生存期最短,仅为(11.500±1.782)个月。见图1。
2.3 Cox风险回归分析
COX风险回归分析结果显示,胶质瘤患者的术后生存情况与患者年龄、组织学分级、KPS评分、病理分型、IDH1、ATRX、联合分子分型和治疗方案均独立相关(P<0.05),而与患者性别、肿瘤部位、大小和1p/19q缺失无关(P>0.05),见表2。
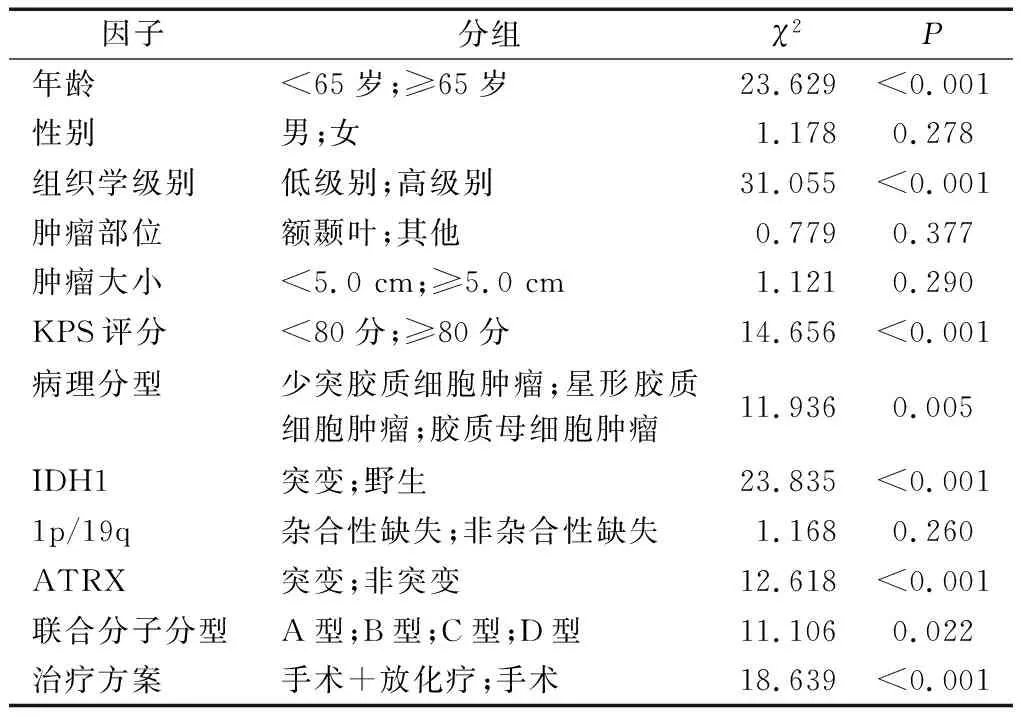
表2 胶质瘤患者Cox风险回归分析
3 讨论
传统组织学分级是预测肿瘤生物学活动的一种常用手段,近年来随着分子生物科学研究的深入和分子检测技术的快速发展,分子诊断逐步运用于各种肿瘤诊疗中,而临床对于胶质瘤的认知也在不断改变中。胶质瘤是一种高度异质性肿瘤,组织特征相似的胶质瘤内部分子遗传学存在很大的差异,从而导致了WHO病理组织分级相同的个体预后差异较大[2]。
IDH1突变、1p/19q缺失与ATRX表达缺失是目前临床胶质瘤的常检项目,本研究通过联合此3种分子状态将胶质瘤患者分为四型,结果显示不同分型间患者年龄、组织学分级、KPS评分均有显著差异,其中与病理学分型的相关性最大,其次是组织学分级。A型大多出现在少突胶质细胞肿瘤中;B型患者年龄最小,组织学级别最低,主要位于星型胶质细胞瘤;D型年龄最大,组织学级别最高,KPS评分最低;C型和D型主要存在于胶质母细胞肿瘤中,这与既往研究[8-10]中单独将这三类分子状态与临床病理组织学分级对照研究结果一致,提示A、B型恶性程度显著低于D型,而C型介于之间。
生存分析结果显示4种亚型间总生存期存在显著的差异,其中D型,即IDH1与ATRX均为野生时,胶质瘤患者预后最差,中位生存期仅为(11.500±1.782)个月;而B型即IDH1突变且1p/19q完整的胶质瘤患者生存情况较好,C型IDH1突变合并1p/19q缺失的患者生存情况较B型稍差,C型IDH1与ATRX均为突变。既往研究[7]指出存在1p/19q共缺失的胶质瘤患者预后较好,这与本研究结果不一致,可能是由于既往研究未分析IDH1突变与1p/19q共缺失的预后情况。IDH编码蛋白是三羧酸循环中的一种关键限速酶,可以催化异柠檬酸氧化成d-酮戊二酸,为细胞新陈代谢提供能量和生物合成的前体物质,其催化反应生成的产物还原型辅酶Ⅱ可作为体内还原性氢的供体,参与细胞抵御氧化应激反应、不饱和脂肪酸的氧化过程,当IDH突变通过产2-羟戊二酸,抑制了α-酮戊二酸依赖性脯氨酸羟化酶,使得细胞内缺氧诱导因子-1α水平升高,进一步诱导DNA甲基化,引起胶质瘤的表观遗传改变[11]。IDH1突变对预后的影响可能与其减少了患者氧化应激反应有关,而1p/19q共缺失的少突胶质细胞瘤生长速度较慢,且对化疗药物敏感,所以单独存在1p/19q共缺失的患者一般推荐化疗[12-13]。ATRX与端粒的延长替代机制有关,同时也影响着与表观遗传调控相关的其他细胞功能,在DNA复制和修复、染色质高阶结构调控和基因转录调控中发挥了组蛋白伴侣的功能,其表达缺失可能促使癌细胞凋亡[14]。
COX风险回归分析显示,患者年龄、组织学分级、KPS评分、病理分型、IDH1、ATRX、联合分子分型和治疗方案均是胶质瘤患者的术后生存情况的独立预测因素,其中联合分子分型为本研究主要探讨的预测因子,而其他因素均已在既往研究[1-3,5-7,9-14]中得到证实。本文为单中心研究,样本量有限,而且由于一部分患者在中途失访或死于其他原因,可能导致结果呈现一定偏倚,因此未来仍需进一步加以实验验证,以期联合这些分子亚型为神经胶质瘤的分类和诊断提供参考,为个体化治疗指明方向。
综上,联合IDH1突变、1p/19q杂合缺失和ATRX突变对胶质瘤患者进行分子分型分为四型,D型恶性程度最高且预后较差,而B型恶性程度相对较低,预后情况较好。分子分型不仅与病理组织学分级密切相关,有助于临床诊断,还可能为患者术后生存情况提供参考。

